
- •1. Электрохимия
- •1.1. Гальванические элементы
- •1.2. Механизм возникновения э.Д.С.
- •Определение величины электродного потенциала
- •2. Поверхностные явления и дисперсные системы
- •2.1. Поверхностные явления и адсорбция
- •Измерение поверхностного натяжения на границе раздела жидкость/жидкость
- •Обработка полученных результатов
- •2.2. Пены. Получение и свойства
- •2.3. Эмульсии и их свойства
- •2.4. Мицеллярные растворы iiab
- •2.5. Вязкость дисперсных систем.Структурная вязкость
- •2.6. Электрические свойства дисперсных систем
- •2.7. Седиментационный анализ суспензий и эмульсий
- •Практикум по курсу “Физическая и коллоидная химия”
- •Отдел оперативной полиграфии издательства *Нефть и газ"
- •11991 Гсп-1 Ленинский проспект, д.65
2.1. Поверхностные явления и адсорбция
П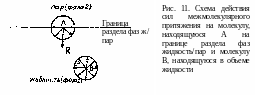 редставим
себе границу раздела жидкость/пар.
Рассмотрим две нелетучие жидкости:
одна
молекула находятся на границе раздела
(А), а другая - в объеме жидкости (В) (рис.
11). На молекулу В в сфере молекулярного
притяженая
действуют
сила притяжения соседних молекул таким
образом, что все силы взаимодействия
скомпенсированы.
редставим
себе границу раздела жидкость/пар.
Рассмотрим две нелетучие жидкости:
одна
молекула находятся на границе раздела
(А), а другая - в объеме жидкости (В) (рис.
11). На молекулу В в сфере молекулярного
притяженая
действуют
сила притяжения соседних молекул таким
образом, что все силы взаимодействия
скомпенсированы.
На молекулу А со стороны молекул жидкости действует большая сила (вследствие меньшего расстояния между: молекулами), чем со стороны молекул пара. Таким образом, равнодействующая всех сил направлена в объем жидкости перпендикулярно поверхности раздела. И эта равнодействующая стремится затянуть молекулу с поверхности жидкости в объем. Сумма равнодействующих для молекул, занимающих 1 см2 границы раздела фаз, называется внутренним давлением. Чем больше силы взаимодействия между молекулами жидкости, тем больше сила внутреннего давления. Следовательно, чтобы молекула могла находиться на границе раздела фаз, она должна обладать избытком энергии. Этот избыток энергии, рассчитанный для количества молекул, занимающих единицу площади поверхности на границе раздела фаз, называется поверхностным натяжением . Или, другими словами, чтобы вытащить из объема жидкости на границу раздела фаз такое количество молекул, которое образует единицу площади поверхности раздела фаз, необходимо совершить работу против силы внутреннего давления. Эта работа и будет являться поверхностным натяжением жидкости. Итак, поверхностное натяжение - это работа равновесного изотермического процесса создания единицы площади новой поверхности.
Часто поверхностное натяжение определяют как силу, действующую тангенциально к поверхности раздела фаз на единицу длины периметра этой поверхности.
В системе единиц СИ поверхностное натяжение измеряется в Дж/м2, мДж/м2 или Н/м, в системе СГС единицами измерения поверхностного натяжения являются зрг/см2 или дин/см:
1 Дж/м2 = 1000 эрг/см2,
1 мДж/м2 = 1 эрг/см2.
Некоторые
вещества способны понижать поверхностное
натяжение жидкостей. Такие вещества
называются поверхностно-активными
(ПАВ).
По
отношению к воде поверхностно-активными
являются карбоновые кислоты, спирты,
альдегиды, амины, белки и некоторые
другие органические соединения.
Схематически строение молекулы ПАВ
изображают следующим образом:
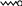 .
Кружочек обозначает полярную группу,
а хвост - неполярную углеводородную
часть. Такое строение молекулы ПАВ
называется дифильным, то есть молекула
обладает сродством к двум различным по
полярности фазам (фильность - сродство).
Такие молекулы способны ориентироваться
(адсорбироваться на границах раздела
фаз), выравнивая полярности этих фаз, и
тем самым, снижая поверхностное
натяжение между ними.
.
Кружочек обозначает полярную группу,
а хвост - неполярную углеводородную
часть. Такое строение молекулы ПАВ
называется дифильным, то есть молекула
обладает сродством к двум различным по
полярности фазам (фильность - сродство).
Такие молекулы способны ориентироваться
(адсорбироваться на границах раздела
фаз), выравнивая полярности этих фаз, и
тем самым, снижая поверхностное
натяжение между ними.
Вещества, которые не изменяют или повышают поверхностное натяжение на границах раздела фаз, называются поверхностно-инактивными (ПИВ). По отношению к воде такими веществами являются сахара (они не изменяют воды) и неорганические соли, основания, кислоты (незначительно повышают воды).
Американским ученым Гиббсом было выведено уравнение, описывающее адсорбцию ПАВ на границах раздела жидкость/газ и жидкость/жидкость:
![]() , (2.1)
, (2.1)
где Г - адсорбция, (моль/см2 или кмоль/м2);
- поверхностное натяжение (эрг/см2 или Дж/м2);
С - концентрация раствора (моль/л, кмоль/м3);
Т - температура, К;
R - универсальная газовая постоянная, Дж/мольК.
Величина
![]() называется поверхностной активностью
вещества и характеризует способность
вещества снижать поверхностное
натяжение. Если g
>
0,
то вещество называется поверхностно-активным
и его адсорбция на границе раздела фаз
Г >0, еcли
же g
< 0, то вещество называется
поверхноcтно-инактивным
и Г<0. Отрицательная величина
адсорбции Г в данное случае означает,
что концентрация растворенного вещества
в объеме раствора больше, чем в
поверхностном слое.
называется поверхностной активностью
вещества и характеризует способность
вещества снижать поверхностное
натяжение. Если g
>
0,
то вещество называется поверхностно-активным
и его адсорбция на границе раздела фаз
Г >0, еcли
же g
< 0, то вещество называется
поверхноcтно-инактивным
и Г<0. Отрицательная величина
адсорбции Г в данное случае означает,
что концентрация растворенного вещества
в объеме раствора больше, чем в
поверхностном слое.
Поверхностно-активные вещества широко используются в нефтяной промышленности. В частности, в бурении и эксплуатации скважин они применяются для увеличения нефтеотдачи коллекторов, вскрытия пластов, предотвращения обвалов при бурении скважин, улучшения условий освоения нефтяных и нагнетательных скважин, повышение их продуктивности и приемистости, предотвращения образования эмульсий в нефтяных cкважинax и деэмульсации нефти, для борьбы с коррозией нефтепромыслового оборудования, понижения твердости разбуриваемых пород, в качестве регуляторов срока схватывания при цементировании скважин.
Для определения поверхностного натяжения жидкостей используют методы капиллярного поднятия жидкости, отрыва кольца или пластинки , сталагмометрический метод (метод счета капель), метод максимального давления пузырька газа и некоторые другие методы.
Лабораторная работа 3. ИЗУЧЕНИЕ ВЛИЯНИЯ КОНЦЕНТРАЦИИ ПАВ НА ВЕЛИЧИНУ ПОВЕРХНОСТНОГО НАТЯЖЕНИЯ РАСТВОРОВ НА ГРАНИЦАХ РАЗДЕЛА ГАЗ/ЖИДКОСТЬ И ЖИДКОСТЬ/ЖИДКОСТЬ
Простым и достаточно точным методом определения величины поверхностного натяжения на границе газ/жидкость является метод максимального давления проскакивания пузырька газа через капилляр, касающийся поверхности жидкости, предложенный П.А. Ребиндером. Схема прибора, основанного на этом методе, представлена на рис. 12.
Рис. 12. Прибор для
измерения поверхностного натяжения
по методу максимального давления
пузырька газа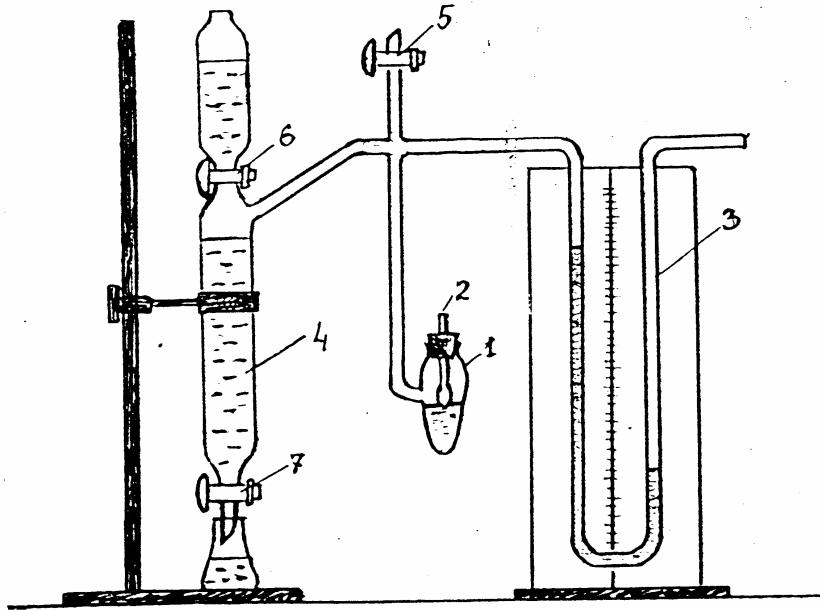
Поверхностное натяжение на границе раздела жидкость/газ прямо пропорционально давлению, соответствующему медленному и равномерному проскакиванию пузырьков газа (воздуха) через капиллярный кончик, который должен лишь касаться поверхности исследуемой жидкости. Глубину погружения капилляра устанавливают вертикальным перемещением капиллярной трубки. Равномерное проскакивание пузырьков воздуха достигается регулированием с помощью крана 7 скорости истечения воды из аспиратора 4.
Максимальное давление проскакивания пузырька воздуха зависит от радиуса капилляра. Для того, чтобы не определять радиус капилляра, измерения проводят относительно стандартной жидкости, для которой известно точное значение поверхностного натяжения при температуре опыта.
Величину поверхностного натяжения исследуемого раствора вычисляют по уравнению:
![]() , (2.2)
, (2.2)
где
i=1, 2,…n;
h0 - разность уровней толуола в коленах манометра для стандартной жидкости;
hi - разность уровней толуола в коленах манометра для i-го исследуемого раствора.
В качестве стандартной жидкости берут дистиллированную воду, точное значение поверхностного натяжения которой известно для широкого диапазона температур. При температуре 20°С для воды 0= 72,75 мДж/м2 (72,75 эрг/см2).
Таким образом, работа сводится к определению показаний манометра (h0) для стандартной жидкости (дистиллированная вода) и для исследуемого раствора (h).
Ход работы.
1. В сосуд 1 наливают пипеткой 10 мл дистиллированной воды, устанавливают капиллярный кончик так, чтобы oн только касался поверхности жидкости. Закрывают краны 5 и 6. Аспиратор 4 должен быть заполнен водой так, как показано на рис. 12. Приоткрывают кран 7 таким образом, чтобы вода выливалась из аспиратора по каплям. При этом в аспираторе 4 и сосуде 1 создается разрежение. Под действием атмосферного давления через капиллярный кончик стеклянной трубки 2 в сосуд 1 проскакивает пузырек воздуха; в момент отрыва пузырька давление газа в нем достигает максимальной величины, равной 2/r0 ( - поверхностное натяжение жидкости в сосуде 1, r0 – радиус капиллярного кончика). В процессе образования пузырька воздуха перепад давления, регистрируемый манометром, растет, а в момент отрыва пузырька – резко падает, что позволяет четко фиксировать максимальное значение перепада давления.
Степень разрежения в аспираторе 4 и сосуде 1 и, следовательно, скорость проскакивания пузырьков регулируют посредством крана 7 так, чтобы число пузырьков не превышало 1-2 в минуту, иначе результаты измерений могут оказаться неправильными. Показания манометра следует отсчитывать очень тщательно.
Для дистиллированной воды измеряют показание манометра h0.
Для стандартной жидкости и делают не менее трех замеров величины перепада давления в коленах манометра и при расчетах по формуле (2.2) используют их среднюю арифметическую величину, которую заносят в таблицу 2.1. Затем таким же образом проводят измерение h для растворов ПАВ. Исходный раствор ПАВ известной концентрации выдается лаборантом.
2. Для изучения влияния концентрации ПАВ на величину поверхностного натяжения раствора в сосуд 1 заливают 10 мл исследуемого раствора I (с наибольшей концентрацией ПАВ) и измеряют максимальную разность уровней жидкости в манометре h при проскакивании пузырька.
3. Затем из сосуда 1 пипеткой отбирают 5 мл раствора, а к оставшейся порции раствора добавляют 5 мл дистиллированной воды. Получают раствор ПАВ, разбавленный в 2 раза, по сравнению с исходным, и определяют величину h1.
4. В дальнейшем повторяют разведение, как описано в п.3, несколько раз и определяют последовательно: h2 - для раствора, разведенного в 4 раза, h3 - для раствора, разведенного в 8 раз, h4 - в 16 раз и т.д. Полученные величины заносят в таблицу 2.1.
Таблица 2.1.
Результаты измерения зависимости поверхностного натяжения раствора ПАВ (указать какого) от концентрации. Исходная концентрация раствора – (указать единицы измерения)
Исследуемая жидкость |
Концентрация в долях от исходной |
hi, мм |
, мДж/м2 |
z, мДж/м2 |
, кмоль/ м2 |
Дистиллир. вода |
0 |
|
|
|
|
Р-р 1 |
1 |
|
|
|
|
Р-р 2 |
1/2 |
|
|
|
|
Р-р 3 |
1/4 |
|
|
|
|
Р-р 4 |
1/8 |
|
|
|
|
Р-р 5 |
1/16 |
|
|
|
|
Р-р 6 |
1/32 |
|
|
|
|
Обработка экспериментальных результатов.
Подставляя величины hi, полученные для растворов ПАВ, в уравнение (2.2), рассчитывают их поверхностное натяжение, внося полученные значения в таблицу 2.1. По полученным результатам строят график зависимости = f (С). Так как все измерения проводились при постоянной температуре, то полученная кривая носит название изотермы поверхностного натяжения (рис. 13). Экспериментальная кривая = f (С) и уравнение адсорбции Гиббса
![]() (2.3)
(2.3)
позволяют графическим методом вычислить величину адсорбции Г на границе раздела фаз раствор ПАВ/воздух при различных концентрациях ПАВ в растворе и построить изотерму адсорбции Г = f (С).
Для построения изотермы адсорбции к разным точкам изотермы поверхностного натяжения (рис. 13), лучше к точкам наибольшей кривизны, проводят касательные до пересечения с осью ординат (способ проведения касательных, приведен в конце практикума).
По
построению
![]() , откуда
, откуда
![]() (2.4)
(2.4)
Из сопоставления уравнения Гиббса (2.3) с выражением (2.4) получаем
![]() . (2.5)
. (2.5)
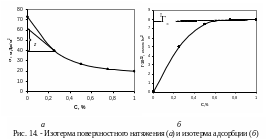
На графике (рис. 14 а) z - отрезок на оси ординат, отсекаемый касательной и прямой, параллельной оси абсцисс. Найдя из графика (рис, 12) величину z, выраженную в единицах поверхносного натяжения, для всех выбранных точек по уравнению (2.5) вычисляют соответствущие значения величин адсорбции Г. Полученые значения используют для построения изотермы адсорбции (рис. 14 б).
Если кривая Г = f (С) при всех значениях С не имеет точек перегиба, то зависимость адсорбции ПАВ от концентрации раствора можно выразить уравненнем Лэнгмюра:
![]() , (2.6)
, (2.6)
для которого
необходимо
рассчитать постоянные
![]() (предельная
адсорбция) и K
(характеризует
сродство
адсообируемого вещества к поверхности
адсорбента).
(предельная
адсорбция) и K
(характеризует
сродство
адсообируемого вещества к поверхности
адсорбента).
и K можно рассчитать, подставив известные значения Г и С в уравнение Лэнгмюра и решив систему двух уравнений с двумя неизвестными, или определить графически.
Графический способ определения и K основан на следующих преобразованиях уравнения Лэнгмюра:
![]() . (2.7)
. (2.7)
Введем обозначения
![]() ,
,
![]() ,
тогда уравнение (2.7) можно представить
в виде:
,
тогда уравнение (2.7) можно представить
в виде:
![]() , (2.8)
, (2.8)
которое является
уравнением прямой в координатах
![]() - С.
- С.
Откладывая по оси абсцисс известные концентраций растворов, a по оси ординат - соответствующие им вычисленные значения С/Г, получают прямую, из тангенса угла наклона которой вычисляют величину , а из отрезка, отсекаемого прямой на оси ординат, постоянную К (рис. 15).
З
Рис. 15. Зависимость
С/Г
от С
tg=A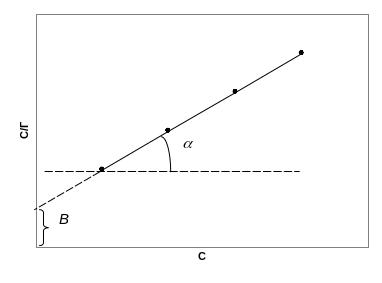
![]()
вычисляют
площадь, приходящуюся на
одну молекулу в адсорбционном слое (NA
– число Авогадро), а из
,
молекулярного
веса М
и плотности d
растворенного
вещества определяют толщину адсорбционного
слоя l.
Если теория Лэнгмюра для
мономолекулярного
адсорбционного
слоя на границе раздела жидкость/газ
верна, то l
будет
соответствовать
длине молекулы, рассчитываемой по
формуле:
![]() .
.
