- •Задания для самостоятельной работы по теме «Ионные равновесия в растворах электролитов».
- •Задания для самостоятельной работы по теме «гидролиз солей»
- •Задания для самостоятельной работы по теме «коллигативные свойства растворов»
- •Задания для самостоятельной работы по изучаемой теме:
- •Задания для самостоятельной работы по теме «буферные растворы»
- •Задания для самостоятельной работы студентов 1 курса лечебного, педиатрического и медико-профилактического факультетов по теме «Химия элементов ia-iia групп»
- •Задания для самостоятельной работы по теме «химические свойства р-элементов и их соединений»
- •Задания для самостоятельной работы по изучаемой теме:
- •Г) характеризуется высокой прочностью
- •Задания для самостоятельной работы по изучаемой теме:
- •Задания для самостоятельной работы по теме « Коллоидные растворы».
- •3. Процесс электролитической диссоциации в воде веществ с ионным и ковалентным типом связи.
- •Задания для самостоятельной работы по теме «основные понятия в биоорганической химии»
- •Задания для самостоятельной работы по теме «номенклатура органических соединений»:
- •Задания для самостоятельной работы по теме «изомерия органических соединений»
- •Задания для самостоятельной работы студентов по теме «кислотность и основность органических соединений»
- •Задания для самостоятельной работы по изучаемой теме:
- •Задания для самостоятельной работы по теме «поли- и гетерофункциональные соединения»
- •Вопросы для самостоятельной работы по теме «гетероциклические соединения»
- •Задания для самостоятельной работы по теме «α-аминокислоты»
- •Тестовые задания
- •Задания для самостоятельной работы по теме «пептиды и белки»
- •Задания для самостоятельной работы по теме «нуклеиновые кислоты»
Тестовые задания
Выберите те утверждения, которые верно описывают строение и свойства α-аминокислот:
α-аминокислоты – гетерофункциональные соединения, содержащие карбоксильную и аминогруппу, находящиеся у одного и того же атома углерода.
гетерофункциональные соединения, содержащие аминогруппу при α- углеродном атоме и карбоксильную группу находящуюся у β-углеродного атома.
α-аминокислоты – кристаллические вещества, растворимые в воде.
α-аминокислоты растворимы в неполярных растворителях.
Основным источником α-аминокислот для живого организма служат пищевые белки.
α-аминокислоты имеют низкую температуру плавления.
Перечислите незаменимые α-аминокислоты:
…..
…..
…..
…..
…..
…..
…..
…..
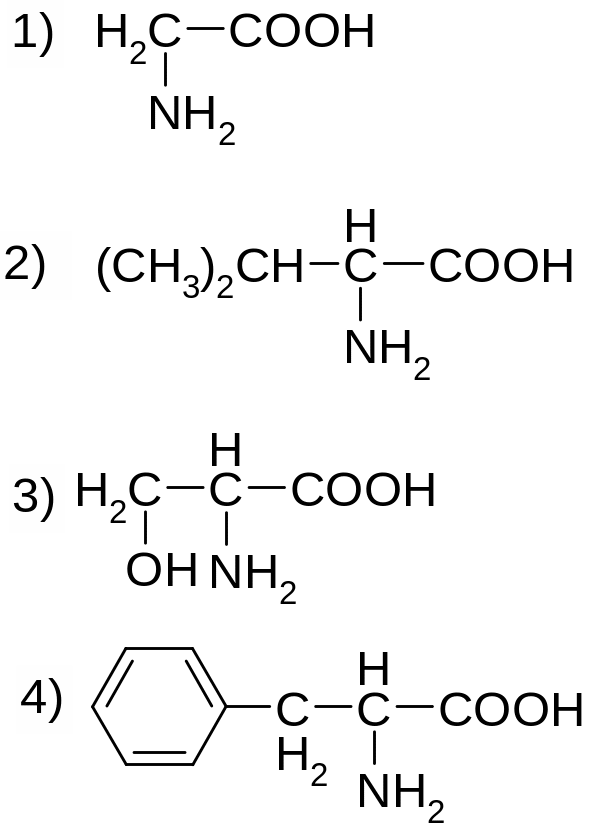
Установите соответствие между формулой α-аминокислоты и ее тривиальным названием:
|
А) Валин Б) Фенилаланин В) Лизин Г) Глицин Д) Тирозин Е) Серин |
Алифатические α-аминокислоты в зависимости от числа карбоксильных групп и аминогрупп в молекуле делятся на:
……
……
……
(Привести примеры)
Изобразите с помощью проекционных формул Фишера энантиомеры аланина:
……………….
Почти все природные α-аминокислоты принадлежат к ………. – ряду.
Амфотерность α-аминокислот обусловлена наличием в их молекулах функциональных групп: …………………….. и ………………………..
(Привести примеры реакций)
В водном растворе α-аминокислота существует в виде равновесной смеси ……………………., …………………… и ………………………. Положение равновесия зависит от …………...
.С катионами тяжелых металлов α-аминокислоты образуют …………….. (Написать схему взаимодействия глицина с карбонатом меди (II).) Полученные при взаимодействии α-аминокислоты с катионом Cu2+ растворы, окрашены в ………….. цвет.
Схема взаимодействия глицина с азотистой кислотой:
……………………………………………………………….
При этом образуются ……………. Реакция используется для …………
Основания Шиффа образуются при взаимодействии α-аминокислот с …...
Написать схему реакции для аланина.
Для обнаружения ароматических и гетероциклических α-аминокислот используется ……….............. реакция. Написать уравнение реакции тирозина с конц. азотной кислотой.
α-Аминокислоты образуют с 2,4-динитрофторбензолом (ДНФБ) окрашенные в желтый цвет ……………………………..
Написать схему реакции для аланина.
Выберите верные ответы. Ксантопротеиновая реакция – это качественная реакция на следующие α-аминокислоты:
фенилаланин
аланин
серин
тирозин
лейцин
аспаргин
гистидин
цистеин
триптофан
Определите Х и У в схеме реакции:
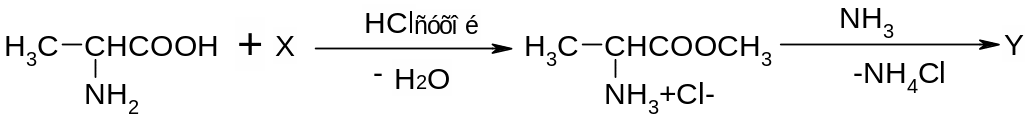
Задания для самостоятельной работы по теме «пептиды и белки»
Вопросы для проверки базового (исходного) уровня:
Конформационные представления в органической химии.
Кислотность и основность органических соединений
Водородная связь
Строение и химические свойства α-аминокислот.
Биологически важные химические реакции α-аминокислот.
Студент должен знать:
|
Литература:
Основная:
Дополнительная:
|
Студент должен уметь:
|
Основная:
Дополнительная:
|
Задания для самостоятельной работы по изучаемой теме:
Первичная структура пептидов и белков. Состав и аминокислотная последовательность. Ферментативный гидролиз белков.
Химические способы определения первичной структуры пептидов и белков: метод динитрофенилирования, метод Эдмана, дансильный метод.
Пространственное строение полипептидов и белков:
Строение пептидной группы.
Вторичная структура полипептидов и белков: α-спираль, β-складчатая структура, спираль коллагена.
Третичная структура белков; электростатические и гидрофобные взаимодействия в структуре, водородные и дисульфидные связи; активный центр («щель») в третичной структуре лизоцима.
Четвертичная структура белка.
Денатурация и ренатурация нативной конформации
4.Приведите синтез дипептидов Ала-Гли, Иле-Тре, Тре-Мет, Фен-Гис, Тир-Сер
6.Определите N-концевую аминокислоту в пептидах Лей-Иле-Фен, Сер-Гли-Тре, Гли-Ала-Мет методом дегидратации по Эдману.
7.Какими видами взаимодействия определяется стабилизация вторичной структуры белков? Покажите образование водородных связей на участке полипептидной цепи Вал-Гли-Тир-Лей-Ала.
8.К какому виду взаимодействия могут приводить пространственно сближенные α-аминокислотные остатки двух молекул цистеина; лизина и аспарагиновой кислоты; лизина и глутаминовой кислоты.
Тестовые задания:
Олигопептиды содержат в цепи:
не более 10 аминокислотных остатков;
до 100 аминокислотных остатков;
более 100 аминокислотных остатков
Определите рН среды, в которой находится изоэлектрическая точка трипептида Вал-Фен-Лей:
кислая;
нейтральная
щелочная
Основную роль в формировании и поддержании вторичной структуры белка играет:
ионное (электростатическое) взаимодействие
гидрофобное взаимодействие
дисульфидные связи
водородные связи
Глобулярные белки – это:
коллаген и альбумин
миоглобин и кератин
глобин и альбумин
фиброин и миоглобин
Выберите верные утверждения (правильных ответов – 3):
молекулы фибриллярных белков обычно имеют β-структуру
молекулы фибриллярных белков хорошо растворяются в воде
молекулы фибриллярных белков имеют волокнистое строение
молекулы фибриллярных белков имеют цилиндрическое или сферическое строение
к фибриллярным белкам относятся альбумин и миоглобин
на поверхности фибриллярных белков много гидрофобных радикалов
Ответ: _________________
Выберите верные утверждения об инсулине (правильных ответов – 3) :
инсулин – гормон, ответственный за контроль метаболизма углеводов, жиров и белков
молекулярная масса инсулина 3500
инсулин состоит из двух пептидных цепей, соединенных двумя дисульфидными мостиками
инсулин состоит из двух пептидных цепей, соединенных четырьмя дисульфидными мостиками
инсулины вырабатывается поджелудочной железой
Установите соответствие между трипептидом и средой его изоэлектрической точки:
|
А) кислая Б) нейтральная В) щелочная |
1 |
2 |
3 |
4 |
|
|
|
|
Определите x, y, z в схеме реакции
![]()
Напишите структурные формулы для x, y и z.