
Лекция 2
Весовой анализ (гравиметрический)
Гравиметрией называют метод количественного анализа, заключающийся в точном измерении массы определяемого компонента пробы, выделенного в виде соединения известного состава или в форме элемента. Этот метод основан на законе сохранения массы веществ при хим. превращениях.
Это наиболее точный из химических методов анализа и универсальный.
Его характеристики: предел обнаружения 0,01% - 0,005%, правильность 0,2отн.%.
В гравиметрии используют реакции обмена, замещения, разложения, и комплексообразования, а также электрохимические методы.
Классификация методов весового анализа
Метод выделения
Выделение определяемого компонента (ОК) из анализируемого вещества (АВ) в свободном состоянии с последующим взвешиванием на аналитических весах. (Например, определение Au в Au-Cu сплаве путем растворения сплава, селективного восстановления Au и взвешивание восстановленного Ме)
Метод осаждения
Наиболее распространен метод осаждения, при котором навеску анализируемого в-ва растворяют и прибавляют 1,5 кратный избыток реагента-осадителя, соблюдая необходимые условия осаждения. Полученный осадок называют осаждаемой формой. Осадок отделяют от раствора (чаще всего фильтрованием), промывают, затем высушивают или прокаливают и взвешивают, получая гравиметрическую (весовую) форму.
OH- t
Fe3+ → Fe(OH)3 ↓ → Fe2O3
определяемое форма весовая
вещество осаждения форма
Метод отгонки
Определяемый компонент количественно отгоняют в виде летучего соединения, образующегося в том числе в результате воздействия на АВ реагента. При этом о массе определяемого компонента судят по уменьшению массы АВ (косвенные методы отгонки) или по увеличению массы поглотителя (прямые методы отгонки). , Например, определение CO2 в карбонатных породах.
MeCO3 + H+→Me2+ +CO2↑ + H2O
CO2 + 2NaOH→Na2CO3 + H2O
(поглотитель – натронная известь (CaO+NaOH).
Содержание определяемого компонента СA определяют по формуле:
![]()
где mв-масса высушенного или прокаленного осадка, г;
F- гравиметрический фактор (фактор пересчета), определяемый по химической формуле гравиметрической формы;
а – навеска анализируемого вещества.
Гравиметрический фактор (аналитический множитель, фактор пересчета) вычисляют как отношение молекулярной массы определяемого компонента к молекулярной массе гравиметрической формы с учетом стехиометрических коэффициентов. Их значения обычно приводятся в справочниках.
Пример
Вычислить гравиметрические факторы (факторы пересчета) для следующих гравиметрических определений
Определяемый компонент |
Al |
CO2 |
Cr2O72- |
H3PO4 |
Гравиметрическая форма |
Al2O3 |
BaCO3 |
BaCrO4 |
Mg2P2O7 |
Решение.
![]()
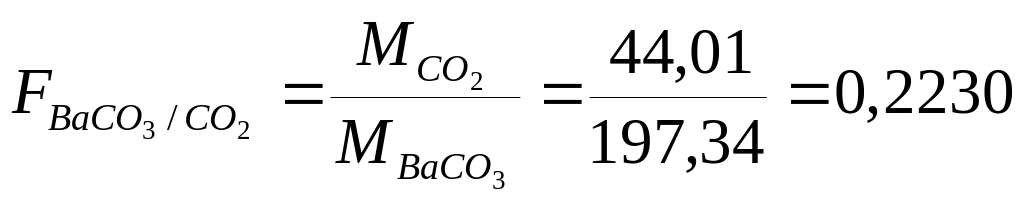
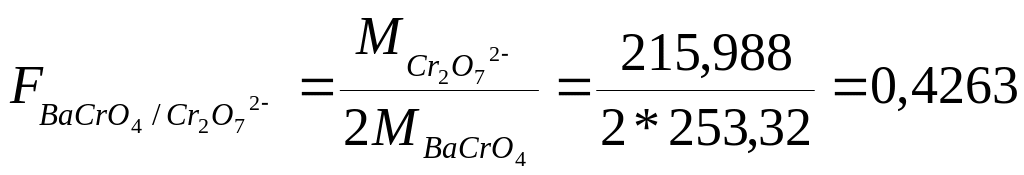
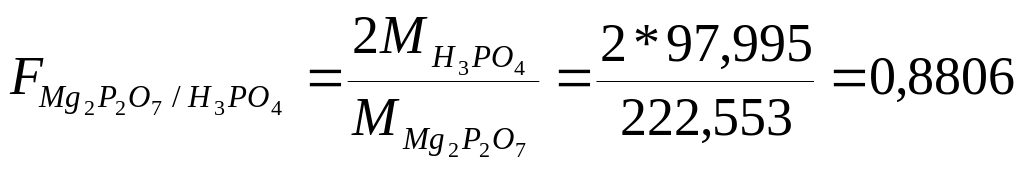
Реагент-осадитель, осаждаемая и гравиметрическая (весовая) форма должны отвечать определенным требованиям.
Определяемый компонент должен осаждаться по возможности полно (растворимость не более 10-4-10-5моль/дм3), при этом остальные компоненты должны оставаться в растворе.
Осаждаемая форма легко и полностью превращается в гравиметрическую.
Гравиметрическая форма должна иметь строго постоянный точно известный химсостав и должна быть устойчива на воздухе. Гравиметрическая форма должна иметь возможно большую молярную массу, а содержание определяемого элемента в ней было меньшим.
Таблица 2.1 - Условия образования и растворения осадка
Соотношение П и ПР |
Характеристика раствора |
Состояние твердой фазы |
П<ПР |
Ненасыщен |
Растворяется |
П=ПР |
Насыщен |
Равновесие с раствором |
П>ПР |
Пересыщен |
Осаждается |
П – произведение концентраций ионов
ПР – произведение растворимости
Некоторые положения теории образования осадков
Для начала выпадения осадка требуется некоторая степень пересыщения раствора, которую характеризуют обычно относительным пересыщением и выражают приближенной эмпирической формулой (справедливой для случаев смешения равных объемов растворов с одинаковой концентрацией реагирующих веществ):
![]()
![]()
где Р=С/2 (С—исходная концентрация каждого из реагентов);
Ро—растворимость малорастворимого вещества в этих же условиях.
Очевидно, чем выше относительное пересыщение, т. е. чем ниже растворимость образующегося осадка и чем выше концентрация осаждаемого вещества, тем больше образуется первичных (зародышевых) кристаллов. И наоборот, чем ниже относительное пересыщение, т. е. чем выше растворимость образующегося осадка и чем ниже концентрация осаждаемого вещества, тем меньше образуется первичных кристаллов.
Последующие процессы—агрегация и ориентация первичных кристаллов
Агрегацией называется соединение первичных кристаллов в более крупные частицы (агрегаты), состоящие из десятков, сотен молекул.
Ориентацией называются процессы, приводящие к совершенству кристаллов: правильному расположению ионов в кристаллической решетке, уменьшению числа дефектов, уменьшению общей поверхности осадка.
Следует иметь в виду, что резкой грани между кристаллическими и аморфными осадками не существует. Одни и те же малорастворимые соединения в зависимости от условий осаждения могут быть выделены как в кристаллическом, так и в аморфном состоянии.
Например, типично кристаллические в водной среде осадки BaS04, PbS04 и другие в смеси воды с 30—60% спирта, который сильно понижает их растворимость, образуют аморфные осадки или коллоидные растворы.
Процессом созревания (или старения) осадков называют необратимые структурные изменения (укрупнение и уплотнение) свежеосажденных осадков, оставленных на некоторое время в маточном растворе.
Основные операции гравиметрии
Последовательность выполнения:
1. взятие навески,
ее растворение,
выбор осаждаемой формы и условий ее получения,
выполнение осаждения, последующая обработка осадка (фильтрование, промывание, озоление) и получение весовой формы.
Взятие навески. Навеской называют количество вещества, необходимое для выполнения анализа. Практикой установлено, что в макроанализе наиболее удобны в работе кристаллические осадки с массой около 0,5 г и объемистые аморфные осадки с массой около 0,1—0,3 г.
Величину навески m рассчитывают из пропорции, составленной на основании уравнения реакции, по формулам: для осаждения:
кристаллических осадков
![]()
для осаждения аморфных осадков
![]()
где Ма—молекулярная масса определяемого вещества;
МВ—молекулярная масса весовой формы,
а, b—коэффициенты из уравнения реакции.
Навеску берут на аналитических весах, взвешивая с точностью-до десятых долей миллиграмма.
Растворение навески анализируемого вещества
Подходящий растворитель подбирают предварительно, делая пробы с отдельными порциями вещества.
Если вещество нерастворимо в воде, используют кислоты, смеси кислот, смеси кислот с окислителями и т. п., нагревают раствор. Процессы растворения при этом часто сопровождаются разложением веществ вследствие окисления—восстановления и комплексообразования и превращением их в растворимые соединения.
Выбор осаждаемой формы
Очень важно, чтобы взвешиваемый осадок имел строго постоянный, точно известный химический состав, отвечающий определенной формуле. Дело в том, что при прокаливании выделенные осадки ведут себя по-разному: одни не изменяют, другие изменяют свой химический состав. В связи с этим в гравиметрии принято различать осаждаемую и весовую формы.
Осаждаемой формой (или формой осаждения) называют соединение, которое осаждается из раствора при действии реагента-осадителя, а весовой формой—соединение, которое взвешивают для получения конечного результата. Для некоторых соединений, не изменяющих свой химический состав при прокаливании, осаждаемая и весовая форма совпадают (BaSО4, SrSО4, AgCl, многие сульфиды металлов); в большинстве случаев весовая форма отличается от формы осаждения.
Например, осаждаемой формой может быть водный оксид Fе2О3*nН2О [условно обозначаемый Fе(ОН)3], весовой—безводный оксид Fe2O3; при определении Mg2+ (Zn2+, Cd2+) формой осаждения может быть фосфат, например MgNH4PО4, весовой формой —пирофосфат Mg2P2О7 и т. д.
Осаждаемая форма должна удовлетворять ряду требований:
1. Обладать достаточно малой растворимостью (не превышающей 10-4—
10-5 моль/дм3).
2. Выделяться в виде крупных кристаллов. Крупнокристаллические осадки имеют слабо развитую поверхность, вследствие чего мало загрязняются примесями раствора, легко отмываются от них, хорошо фильтруются, не забивая при этом поры фильтра и не проходя через фильтр.
Достаточно легко и полностью превращаться в весовую форму при высушивании или прокаливании.
Выбор реагента-осадителя
Требования, предъявляемые к осаждаемой форме, определяют выбор реагента–осадителя.
1. Из возможных осадителей следует выбирать тот, который обеспечивает наиболее полное осаждение определяемого элемента.
2. Желательно, чтобы осадитель был веществом летучим, так как в этом случае захваченная осадком часть осадителя, не удаленная при промывании, легко удаляется при прокаливании. Так, для осаждения сульфатов используют обычно H2SО4, а не ее соли; для осаждения гидроксидов – NH4ОН, а не NaOH или КОН (NH40H нельзя использовать для осаждения Сu2+, Ni2+, Co2+ и других ионов, образующих с избытком NНз растворимые аммиакаты состава, например [Cu(NH3)4]2+ и т. п.).
3. Реагент-осадитель должен быть достаточно специфическим.
Например, для осаждения ионов никеля—диметилглиоксим, ионов кобальта—α-нитрозо-β -нафтол, редких элементов (тантала, ниобия, титана и др.) —таннин, пирогаллол и т. д.
Реагент-осадитель должен быть взят в количестве, обеспечивающем превышение ПР осаждаемого соединения и практически полное его осаждение. В гравиметрическом анализе осаждение вещества считают практически полным, если в растворе остается не более 2*10-4 г осаждаемого вещества.
Практически полное осаждение в гравиметрии достигается взятием полуторного (1,5) избытка осадителя, что способствует значительному понижению растворимости осадка
Полнота осаждения иона проверяется «пробой на полноту осаждения». Для этого к совершенно прозрачному раствору над осадком прибавляют осторожно по стеклянной палочке или стенке стакана 2—3 капли раствора осадителя. Если при этом в месте смешения растворов появится хотя бы легкая муть, считают, что полнота осаждения не достигнута, и производят доосаждение с повторной пробой на полноту осаждения.
Соосаждение – захват осадком посторонних ионов раствора, которые сами по себе в данных условиях осадка не образуют. Причины соосаждения различны, они определяются химическими свойствами компонентов и условиями осаждения.
Различают адсорбционное соосаждение, окклюзию, изоморфное, химическое соосаждение и послеосаждение.
Получение весовой формы
Весовая форма должна отвечать следующим требованиям.
1. Состав весовой формы должен быть строго определенным, точно соответствовать химической формуле. Удерживаемая осадком вода, неотмытые летучие примеси (NH3, CO, СО2 и др.) должны быть полностью удалены при прокаливании; полным должно быть озоление фильтра.
2. Весовая форма должна обладать достаточной химической устойчивостью, крайне нежелательны процессы поглощения весовой формой паров Н2О или СО2 из воздуха, разложение, окисление, восстановление и т. п. Для предотвращения подобных процессов либо прибегают к определенного рода предосторожностям, либо переводят малоустойчивый осадок в более устойчивый.
Например, оксид кальция СаО, легко поглощающий Н2О и CO2 из воздуха, действием H2S04 переводят в более устойчивую форму CaS04, а остаток H2S04 удаляют прокаливанием.
3. Желательно, чтобы весовая форма имела возможно большую молекулярную массу, а содержание определяемого элемента в молекуле было меньшим. Погрешности анализа при этом (ошибки взвешивания, потери от растворимости, потери при перенесении осадка на фильтр и др.) меньше влияют на окончательный результат.
Взвешиваемый осадок должен быть достаточно чистым.
Способами получения весовых форм являются: а) высушивание осадков без нагревания (обработка спиртом, затем эфиром); б) высушивание осадков при слабом нагревании (около 100°С); в) прокаливание осадков при температуре 600—1100°С; г) прокаливание в струе инертного газа и др.
РАСЧЕТЫ В ГРАВИМЕТРИЧЕСКОМ АНАЛИЗЕ
Расчет величины навески. Величина навески зависит от характера осадка (осаждаемой формы), а также от процентного содержания осаждаемого элемента в анализируемой пробе. Оптимальным количеством осадка - весовой формой - в случае кристаллического осадка является 0,4—0,5 г, в случае аморфного осадка около 0,1—0,2 г. Если осадок с трудом поддается прокаливанию, масса его должна составлять около 0,1 г.
Примеры: 1. Нужно определить содержание Са в известняке, который состоит в основном из карбоната кальция СаСОз. Осаждение будет проводиться оксалатом аммония (NН4)2С204 в виде оксалата кальция; CaC204 - осадок кристаллический, весовая форма - оксид кальция СаО, количество весовой формы ~0,5г.
Уравнения основных реакций:
CaCO3+2H+→Ca2++H2O +CO2↑
Ca2++ C2O42-→CaC2O4↓
toC
CaC2O4→CaO →CO+CO2
Следовательно:
H+ C2O42- t0C
СаСОз → Са 2+ → СаС2O4 → СаО.
Поскольку молекула СаСОз (100,09) соответствует одной молекуле СаО (56,08), составляем пропорцию:
