
- •Глава 3 местные и общие реакции организма на повреждение
- •3.1.2. Нарушение функций мембранных структур клетки при действии повреждающих агентов
- •Критерии оценки увеличения проницаемости цитоплазматической мембраны
- •Нарушение структуры и функций митохондрий
- •Изменение активности ферментов и рецепторов. Активация ферментов лизосом
- •Повреждение рибосом и полисом
- •3.1.3. Повреждение генетического аппарата клетки
- •3.1.4. Необратимое повреждение _ клеток при острой гипоксии
- •Иокы кальция и активация фосфолипазы
- •3.1.6. Основные механизмы нарушения барьерной функции биологических мембран при патологии
- •Механическое (осмотическое) растяжение
- •Свободные радикалы и их роль в патологии
- •Методы изучения свободных радикалов.
- •3.1.7. Свободнорадикальное (перекисное) окисление липидов
- •3.1.8. Стабильность липидного слоя мембран и явление электрического пробоя
- •3.2. Общие реакции организма на повреждение
- •] 3.2.1. Общий адаптационный f синдром (стресс)
- •Роль калликреин-кининовой системы
- •Роль системы комплемента
- •Ведущими патогенетическими звеньями
- •3.2.4. Кома
3.1.7. Свободнорадикальное (перекисное) окисление липидов
Все радикалы, образующиеся в организме человека, можно разделить на природные и чужеродные. В свою очередь природные радикалы можно разделить на первичные, вторичные и третичные (рис. 8).
Первичные радикалы - те радикалы, образование которых осуществляется при участии определенных ферментных систем. Прежде всего к ним относятся радикалы (семихиноны), образующиеся в реакциях таких переносчиков электронов, как коэнзим Q (обозначим радикал как Q) и флавопротеины. Два других радикала - су-

пероксид (00 ) и монооксид азота (N0) также выполняют полезные для организма функции.
Из первичного радикала - супероксида, а также в результате других реакций в организме образуются весьма активные молекулярные соединения: перекись водорода, гипохлорит и гидроперекиси липидов. Под действием ионов металлов переменной валентности, в первую очередь Fe2+, из этих веществ образуются вторичные радикалы (радикал гидроксила и радикалы липидов), которые оказывают разрушительное действие на клеточные структуры.
Для защиты от повреждающего действия вторичных радикалов в организме используется большая группа веществ, называемых антиок-сидантами, к числу которых принадлежат ловушки, или перехватчики свободных радикалов. Примером последних служат альфа-токоферол, тироксин, восстановленный убихинон (QH2) и женские стероидные гормоны. Реагируя с ли-пидными радикалами, эти вещества сами превращаются в радикалы антиоксидантов, которые можно рассматривать как третичные радикалы.
Наряду с этими радикалами, постоянно образующимися в том или ином количестве в клетках и тканях организма человека, разрушительное действие могут оказывать радикалы, появляющиеся при таких воздействиях, как ионизирующее излучение, ультрафиолетовое облучение или даже освещение интенсивным видимым светом, например светом лазера. Такие радикалы можно назвать чужеродными. К ним принадлежат также радикалы, образующиеся из по-
павших в организм посторонних соединений, ксенобиотиков, многие из которых оказывают токсическое действие именно благодаря свободным радикалам, образующимся при метаболизме этих соединений.
Радикалы кислорода. Клетки-фагоциты (к которым относятся гранулоциты и моноциты крови и тканевые клетки - макрофаги), соприкасаясь с поверхностью клеток, бактерий, начинают энергично выделять супероксид: радикалы, образующиеся в результате переноса электрона от НАДФН-оксидазного ферментного комплекса, встроенного в мембрану клеток и внутриклеточных везикул-фагосом, на растворенный молекулярный кислород

При этом каждая молекула НАДФН, окисляясь, отдает два электрона в цепь переноса электронов, а каждый из этих электронов присоединяется к молекуле кислорода, в результате чего образуется супероксид анион-радикал (рис. 9).
Супероксидные радикалы, как мы увидим позже, могут нанести вред как самим фагоцитам, так и другим клеткам крови и, разумеется, микробам, вызвавшим активацию макрофага. Естественно, что все эти клетки стараются избавиться от супероксид-радикалов, для чего они вырабатывают ферменты, называемые суперок-сиддисмутазами. Различаясь по строению активного центра и структуре полипептидной цепи, все СОД катализируют одну и ту же реакцию дисмутации супероксидного радикала:

род и перекись водорода. Судьба последней может быть разной (рис. 10).
В норме фагоциты используют перекись водорода для синтеза гипохлорита, выделяя специальный фермент - миелопероксидазу (МП). Миелопероксидаза катализирует реакцию
![]()
Гипохлорит разрушает стенку бактериальной клетки и тем самым убивает бактерии. Перекись водорода диффундирует в клетки, но там разрушается в результате активности ферментов ка-талазы и глутатионпероксидазы (GSH-перокси-дазы), которые катализируют соответственно такие реакции:

В присутствии ионов двухвалентного железа перекись водорода разлагается с образованием гидроксильного радикала (НО):
![]()
Эта реакция (известная как реакция Фентон) приводит к тяжелым последствиям для окружающих клеток. Радикал гидроксила чрезвычайно активен химически и разрушает почти любую встретившуюся ему молекулу. Действуя на SH-группы, гистидиновые и другие аминокислотные остатки белков, НО' вызывает денатурацию последних и инактивирует ферменты. В нуклеиновых кислотах НО' разрушает углеводные мостики между нуклеотидами и таким об-

разом разрывает цепи ДНК и РНК, в результате чего происходят мутации и гибель клеток. Внедряясь в липидный слой клеточных мембран, гидроксильный радикал запускает (инициирует) реакции цепного окисления липидов, что приводит к повреждению мембран, нарушению их функций и гибели клеток.
Гидроксильный радикал образуется не только в реакции Фентон, но и при взаимодействии ионов железа (Fe2+) с гипохлоритом (реакция Осипова):
![]()
Супероксидный радикал (00 )и продукты его метаболизма (Н202, НО', СЮ) называют активными формами кислорода.
Окись азота. К числу радикалов, синтезируемых клетками, относится монооксид азота ' N0, называемый также нитроксидом. Нитроксид образуется клетками стенок кровеносных сосудов (эндотелия); эта реакция катализируется гемсо-держащим ферментом N0 -синтазой. 'NO играет ключевую роль в регуляции тонуса сосудов и кровяного давления: его недостаток приводит к гипертензии, избыток - к <гипотензии. Нарушение метаболизма фактора расслабления вызывает заболевания, связанные с изменением кровяного давления.
' N0 выделяется также клетками-фагоцитами и вместе с супероксид-радикалами используется для борьбы с микробами (преимущественно грибковой природы). Полагают, что цитотоксическое действие ' N0 обусловлено его реакцией с супероксидом
![]()
Пероксинитрит, образующийся в этой реакции, может разлагаться с образованием 'ОН:
О = N - О - ОН -> О = N - О + ОН (радикал гидроксила)
Образование пероксинитрита и радикала гидроксила приводит к повреждению клеток. По-видимому, одна из функций супероксиддисму-тазы состоит в предотвращении образования пероксинитрита за счет удаления супероксида из зоны образования окиси азота.
Радикал коэнзима Q. Биологическое окисление субстратов клеточного дыхания, таких как глюкоза, пировиноградная и янтарная кислоты и другие, осуществляется, как известно, в два этапа. На первом этапе в цикле трикарбоновых кислот происходит последовательный отрыв атомов водорода от субстрата и образование восстановленных форм пиридиннуклеотидов НАДН и НАДФН. На втором этапе электроны от НАДН и НАДФН переносятся по так называемой дыхательной цепи на кислород. В состав дыхательной цепи входят флавопротеиды, комплексы негемового железа, убихинон и гемопротеиды (цитохромы a, b и с и цитохромоксидаза). Схема дыхательной цепи дана на рис. 11.
Важным звеном цепи переноса электронов служит убихинон (коэнзим Q) :

радикал которого (семихинон, 'QH на рис. 11) образуется либо при одноэлектронном окислении

убихинона (QH2, гидрохинон-форма):

либо при одноэлектронном восстановлении убихинона (Q на рис. 11):

В норме этот радикал является рядовым участником процесса переноса электронов, но при нарушении работы дыхательной цепи он может стать источником других, менее безобидных радикалов, в первую очередь радикалов кислорода.
Основные стадии цепного окисления. Реакция цепного окисления липидов играет исключительную роль в клеточной патологии. Она протекает в несколько стадий, которые получили название инициирование, продолжение, разветвление и обрыв цепи (см. схему 3).
Инициирование цепной реакции начинается с того, что в липидный слой мембран или ли-попротеинов внедряется свободный радикал.
Чаще всего это радикал гидроксила. Будучи небольшой по размеру незаряженной частицей, он способен проникать в толщу гидрофобного липидного слоя и вступать в химическое взаимодействие с полиненасыщенными жирными кислотами (которые принято обозначать как LH), входящими в состав биологических мембран и липопротеинов плазмы крови. При этом образуются липидные радикалы:
![]()
Липидный радикал (L') вступает в реакцию с растворенным в среде молекулярным кислородом, при этом образуется новый свободный радикал - радикал липоперекиси (LOO):
![]()
Этот радикал атакует одну из соседних молекул фосфолипида с образованием гидроперекиси липида LOOH и нового радикала L':
![]()
Чередование двух последних реакций как раз и представляет собой цепную реакцию перекис-ного окисления липидов (см, схему 3).
Существенное ускорение пероксидации липидов наблюдается в присутствии небольших количеств ионов двухвалентного железа. В этом случае происходит разветвление цепей в результате взаимодействия Fe2+ с гидроперекисями ли-
пидов:
![]()
Образующиеся радикалы L0' инициируют новые цепи окисления липидов (см. схему 3):
![]()
В биологических мембранах цепи могут состоять из десятка и более звеньев. Но в конце концов цепь обрывается в результате взаимодействия свободных радикалов с антиоксидантами (InH), ионами металлов переменной валентности (например, теми же Fe2+) или друг с другом:
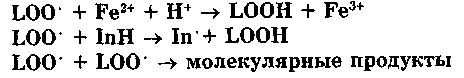
Последняя реакция особенно интересна, поскольку она сопровождается свечением (хеми-люминесценцией). Интенсивность этой хемилю-минесценции очень мала, поэтому ее иногда называют «сверхслабым свечением». Интенсивность свечения пропорциональна квадрату концентрации свободных радикалов в мембранах, а

скорость перекисного окисления прямо пропорциональна концентрации тех же радикалов. Поэтому интенсивность «сверхслабого» свечения однозначно отражает чскорость липидной пероксидации в изучаемом биологическом материале и измерение хемилюминесценции довольно часто используется при изучении перекисного окисления липидов в различных объектах.
Повреждающее действие пероксидации липидов. На рис.12 показаны основные мишени перекисного окисления липидов в мембранных структурах клеток. Повреждаются либо белковые структуры, либо липидный бислой в целом. В последнее время ученые уделяют все большее внимание взаимодействию мембран с нуклеиновыми кислотами в ядре и митохондриях. По-видимому, одним из результатов пероксидации


липидов может стать повреждение этих молекул со всеми вытекающими последствиями.
Наиболее чувствительны к перекисному окислению липидов сульфгидрильные, или тиоловые, группы (- SH) мембранных белков: ферментов, ионных каналов и насосов. В ходе окисления тиоловых групп образуются радикалы (- S')» которые затем либо взаимодействуют друг с другом с образованием дисульфидов (- SS-), либо связываются с кислородом с образованием сульфитов и сульфатов (- S03 и - S04). Большую роль в патологии клетки играет также повреждение ионтранспортирующих ферментов (например, Са2+ , М£2+-АТФазы), в активный центр которых входят тиоловые группы (рис. 12-1). Инактивация Са2+-АТФазы приводит к замедлению откачивания из клетки ионов кальция и ускорению их «протечки» в клетку (где их концентрация меньше). Это вызывает рост уровня ионов кальция в цитоплазме и повреждение клеточных структур.
Окисление тиоловых групп мембранных белков приводит к появлению дефектов в мембранах клеток и митохондрий. Под действием электрического поля через такие дефекты в клетки входят ионы натрия, а в митохондрии - ионы калия. В результате происходит увеличение осмотического давления внутри клеток и митохондрий и их набухание. Это приводит к еще большему повреждению мембранных структур.
Еще одним интересным примером может служить окисление белков и последующее образо-
вание белковых агрегатов в хрусталике глаза, вызванное пероксидацией липидов. Процесс приводит к помутнению хрусталика и может считаться одной из причин развития старческой и других видов катаракты у человека.
Наряду с белками и нуклеиновыми кислотами мишенью повреждающего действия перекис-ного окисления служит сам липидный бислой. Было показано, что продукты перекисного окисления липидов делают липидную фазу мембран проницаемой для ионов водорода и кальция (рис. 12-2; 12-3). Это приводит к тому, что в митохондриях окисление и фосфорилирование разобщаются и клетка оказывается в условиях энергетического голода. Одновременно из митохондрий в цитоплазму выходят ионы кальция, которые повреждают клеточные структуры (см. выше).
Но, быть может, самый важный результат пероксидации - это уменьшение электрической стабильности липидного слоя, которое приводит к электрическому пробою мембраны собственным мембранным потенциалом (рис. 12-4). Электрический пробой вызывает полную потерю мембраной ее барьерных функций.
Клеточные системы защиты от повреждения свободными радикалами. Свободные радикалы преследовали живую материю с первых же моментов ее появления на Земле, и неудивительно, что в ходе эволюции клетки и организм в целом выработали нечто подобное глубокоэше-лонированной обороне, которая включает в себя ферменты и низкомолекулярные соединения, в
совокупности называемые антиоксидантами (табл. 10).
