
- •Введение
- •Глава 1. Основные положения координационной теории
- •1.1. Определение комплексных соединений
- •1.2. Основные понятия
- •1.3. Номенклатура комплексных соединений
- •1.4. Классификация комплексных соединений
- •1.5. Изомерия комплексных соединений
- •Глава 2. Природа химической связи в комплексных соединениях
- •2.1. Электростатическая теория
- •2.2. Метод валентных связей
- •2.3. Теория кристаллического поля
- •2.4. Теория поля лигандов
- •Глава 3. Свойства комплексных соединений
- •3.1. Окраска комплексных соединений
- •Периода в водном растворе
- •3.2. Магнитные свойства комплексных соединений
- •3.3. Равновесия в растворах комплексных соединений
- •3.4. Устойчивость комплексных соединений
- •3.4.1. Природа центрального атома и лигандов
- •3.4.2. Хелатный эффект
- •3.4.3. Стерические факторы
- •3.5. Кинетика и механизм реакций обмена лигандов
- •3.6. Кислотно - основные свойства комплексных соединений
- •3.7. Окислительно-восстановительные свойства комплексных соединений
- •Глава 4. Координационные соединения металлов
- •4.1. Подгруппа железа
- •4.1.1. Железо
- •4.1.2. Кобальт
- •4.1.3. Никель
- •В комплексных соединениях металлов подгруппы железа
- •4.2. Платиновые металлы
- •В комплексных соединениях платиновых металлов
- •4.3. Подгруппа марганца
- •В комплексных соединениях металлов подгруппы марганца
- •4.4. Подгруппа хрома
- •Комплексных соединениях металлов подгруппы хрома
- •4.5. Подгруппа ванадия
- •В комплексных соединениях металлов подгруппы ванадия
- •4.6. Подгруппа титана
- •В комплексных соединениях металлов подгруппы титана
- •4.7. Подгруппа цинка
- •В комплексных соединениях металлов подгруппы цинка
- •4.8. Подгруппа меди
- •В комплексных соединениях металлов подгруппы меди
- •4.9. Подгруппа алюминия
- •4.10. Комплексные соединения s-элементов
- •Катионов подгрупп iАи iiа при 25оС
- •Глава 5. Координационные соединения и медицина
- •5.1.Основные биолиганды
- •5.2. Некоторые основные биометаллы
- •5.3. Избыток и недостаток металлов-микроэлементов
- •5.4. Хелатотерапия
- •5.5. Лекарственные препараты в качестве лигандов
- •5.6. Координационные соединения металлов как противоопухолевые средства
- •Приложение
- •Им окраски
- •Литература
- •Оглавление
- •Глава1.
- •Глава2.
- •Глава3.
- •Глава 4
- •Глава5. Координационные соединения
- •Учебное пособие
- •117997, Москва, ул. Островитянова, д.1.
2.2. Метод валентных связей
Применение метода валентных связей к комплексным соединениям принадлежит Полингу. Полинг показал, что, используя метод валентных связей, можно предсказать геометрическую форму и магнитные свойства комплексов. Теория метода валентных связей объясняет образование комплексов за счёт донорно-акцепторной или координационной связи. Эта связь, как частный случай ковалентной связи, осуществляется между атомом - комплексообразователем, имеющим свободные орбитали и являющимся акцептором электронов, и лигандами, имеющими неподелённые электронные пары, донорами которых они являются. Донором может быть и комплексообразователь. Когда координационная связь образована, она практически ничем не отличается от обычной ковалентной связи.
Например, в комплексном ионе [BF4] донором электронной пары служит анион фтора, а акцептором - атом бора в молекуле BF3 , обладающий незанятой орбиталью внешнего электронного слоя и переходящий при комплексообразовании в состояние
sp3- гибридизации (конфигурация иона – тетраэдр).
Следующие комплексы: [Zn(NH3)4]2+,[Cd(NH3)4]2+, [HgI4]2
также имеют геометрическую конфигурацию тетраэдра (рис.15):
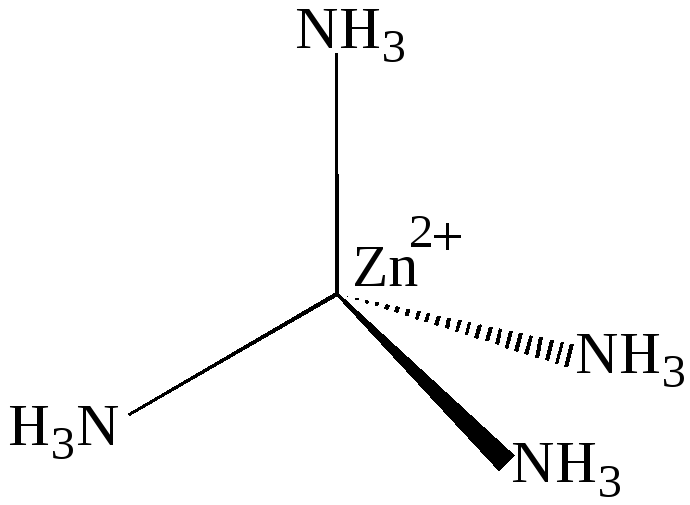
Рис. 15. Структура комплексного катиона [Zn(NH3)4]2+.
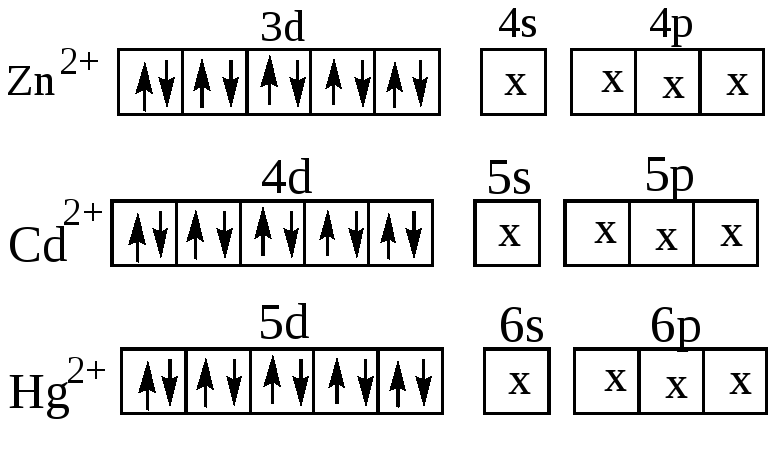
Образование этих комплексных ионов можно объяснить тем, что ионы цинка, кадмия и ртути, имея четыре свободных орбитали (Zn2+- одну 4s и три 4р- орбитали, Cd2+- одну 5s и три 5р -орбитали , Hg2+- одну 6s и три 6р-орбитали) могут быть акцепторами электронных пар лигандов, причём осуществляется
sр3 –гибридизация, соответствующая размещению лигандов в вершинах тетраэдра:
Координационному числу 2 отвечает sp-гибридизация и линейная координация лигандов, как, например, в комплексе
[Ag(NH3 )2]+:
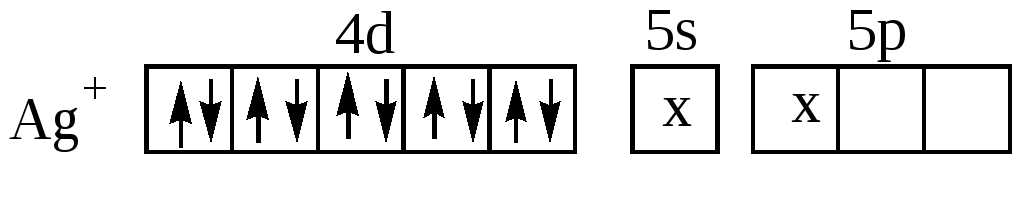
Кроме тетраэдрической конфигурации координационному числу 4 соответствует так же квадратная координация лигандов, как, например, в комплексах [Pt(NH3)4]2+, [Pd(NH3)4]2+, [AuCl4](рис.16) :
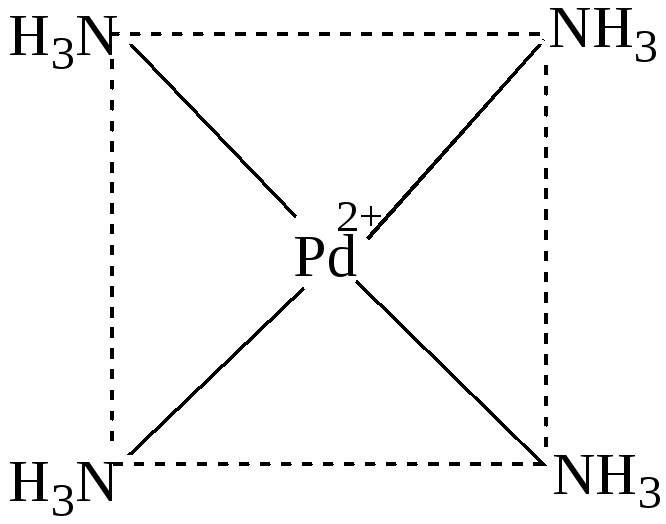
Рис. 16. Структура комплексного катиона [Pd(NH3)4]2+.
Ионы Pt2+,Pd2+,Au3+, имея четыре занятых d –орбитали, предоставляют для электронных пар лигандов одну d , одну s и две р-орбитали. При этом осуществляется гибридизация dsр2:
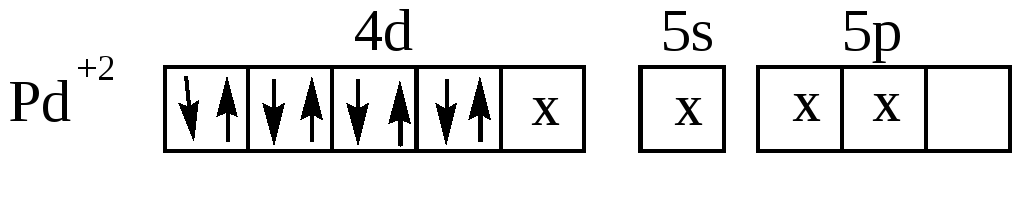

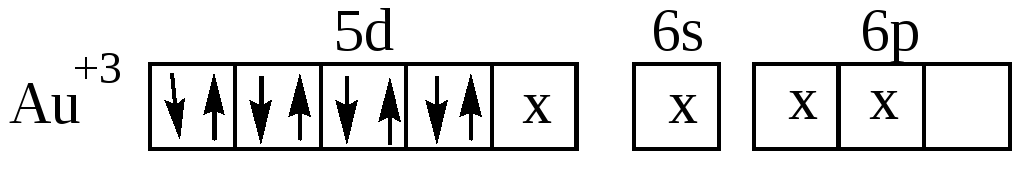
Наиболее распространённым координационным числом является 6, которому соответствует гибридизация d2sp3 или sp3d2 и октаэдрическое расположение лигандов. Такая структура комплекса характерна для Cr3+,Co3+,Pt4+,Fe3+, Fe2+ и многих других.
Например: Cr3+ имеет две свободные 3d –, одну 4s –и три
4р – орбитали, которые они предоставляют для электронных пар лигандов, при этом осуществляется d2sp3- гибридизация. Комплексный ион [Cr(CN)6]3- (рис.17) содержит три неспаренных электрона и, следовательно, парамагнитен:
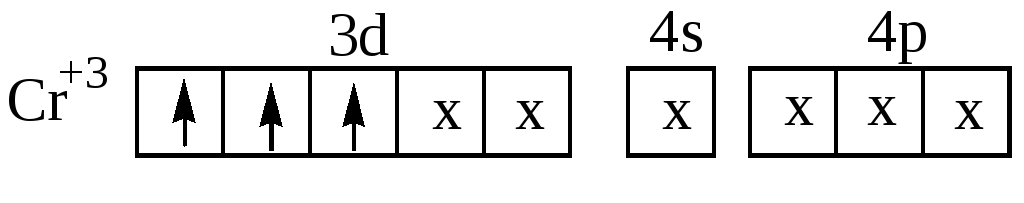

Рис.17. Структура комплексного аниона [Cr(CN)6]3-.
Рассмотрим также два комплексных иона Co3+:
[Co(NH3)6]3+ и [CoF6]3.
Известно, что первый из них диамагнитен, второй парамагнитен.
Ион-комплексообразователь в этих комплексных ионах имеет электронную конфигурацию 3d6. В соответствии с правилом Хунда эти шесть электронов в d–состоянии располагаются по энергетическим ячейкам следующим образом:
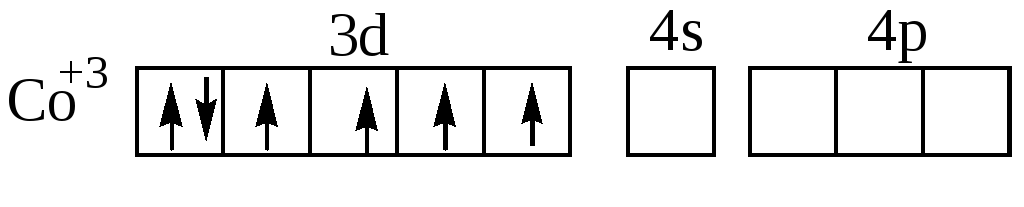
При образовании комплексного иона [Co(NH3)6]3+ четыре
d-электрона сначала образуют электронные пары, освобождая две 3d–орбитали:
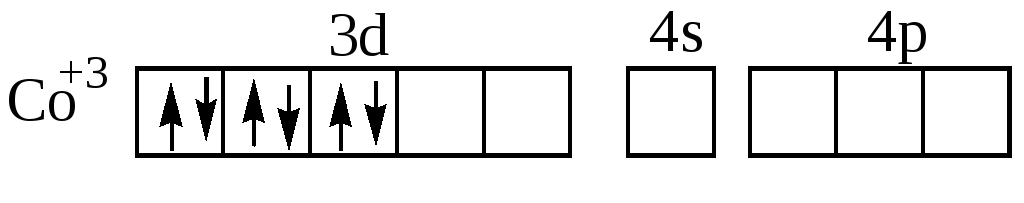
Затем образуется ион [Co(NH3)6]3+, имеющий строение
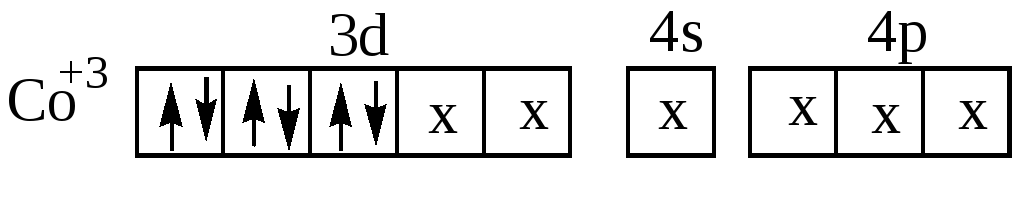
При образовании этого комплекса имеет место d2sp3 -гибридизация, причём она осуществляется при участии внутренних d-орбиталей третьего энергетического уровня иона Co3+. В случае иона [CoF6]3 образования пар d-электронов в ионе Co3+ не происходит. Шесть неподелённых электронных пар ионов F располагаются в свободных s-,p-, d- орбиталях четвёртого энергетического уровня. Комплексный ион [CoF6]3 имеет строение:
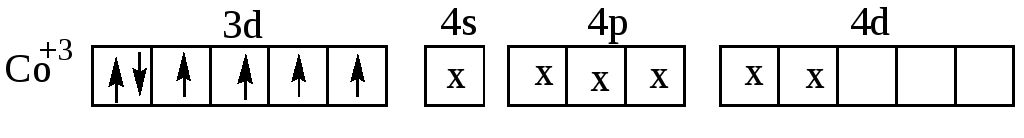
Этот комплексный ион образуется за счёт sp3d2-гибридизации, причём в образовании этого иона участвуют d– орбитали иона Co3+ четвёртого энергетического уровня (внешнего).
Комплексный ион [CoF6]3, в образовании которого участвуют
d-орбитали иона Co3+ четвёртого энергетического уровня, более реакционноспособен, чем ион [Co(NH3)6]3+ , так как в [CoF6]3 лиганды слабее связаны с ионом Co3+,чем в [Co(NH3)6]3+, и могут легче отделяться от комплексообразователя.
Рассмотренные примеры показывают, что метод валентных связей успешно объясняет определённые значения координационных чисел и геометрические формы комплексных частиц, различия в магнитных свойствах (диамагнитность или парамагнитность) этих частиц. Однако, некоторые свойства комплексных соединений (например, спектры поглощения) не находят удовлетворительного объяснения с позиций метода валентных связей. Нельзя объяснить с этих позиций также π- дативную связь.
Спаривание же d–электронов Co3+ в [Co(NH3)6]3+ и отсутствие его в [CoF6]3 удовлетворительно объясняется в рамках теории кристаллического поля.
