
- •Введение
- •Глава 1. Основные положения координационной теории
- •1.1. Определение комплексных соединений
- •1.2. Основные понятия
- •1.3. Номенклатура комплексных соединений
- •1.4. Классификация комплексных соединений
- •1.5. Изомерия комплексных соединений
- •Глава 2. Природа химической связи в комплексных соединениях
- •2.1. Электростатическая теория
- •2.2. Метод валентных связей
- •2.3. Теория кристаллического поля
- •2.4. Теория поля лигандов
- •Глава 3. Свойства комплексных соединений
- •3.1. Окраска комплексных соединений
- •Периода в водном растворе
- •3.2. Магнитные свойства комплексных соединений
- •3.3. Равновесия в растворах комплексных соединений
- •3.4. Устойчивость комплексных соединений
- •3.4.1. Природа центрального атома и лигандов
- •3.4.2. Хелатный эффект
- •3.4.3. Стерические факторы
- •3.5. Кинетика и механизм реакций обмена лигандов
- •3.6. Кислотно - основные свойства комплексных соединений
- •3.7. Окислительно-восстановительные свойства комплексных соединений
- •Глава 4. Координационные соединения металлов
- •4.1. Подгруппа железа
- •4.1.1. Железо
- •4.1.2. Кобальт
- •4.1.3. Никель
- •В комплексных соединениях металлов подгруппы железа
- •4.2. Платиновые металлы
- •В комплексных соединениях платиновых металлов
- •4.3. Подгруппа марганца
- •В комплексных соединениях металлов подгруппы марганца
- •4.4. Подгруппа хрома
- •Комплексных соединениях металлов подгруппы хрома
- •4.5. Подгруппа ванадия
- •В комплексных соединениях металлов подгруппы ванадия
- •4.6. Подгруппа титана
- •В комплексных соединениях металлов подгруппы титана
- •4.7. Подгруппа цинка
- •В комплексных соединениях металлов подгруппы цинка
- •4.8. Подгруппа меди
- •В комплексных соединениях металлов подгруппы меди
- •4.9. Подгруппа алюминия
- •4.10. Комплексные соединения s-элементов
- •Катионов подгрупп iАи iiа при 25оС
- •Глава 5. Координационные соединения и медицина
- •5.1.Основные биолиганды
- •5.2. Некоторые основные биометаллы
- •5.3. Избыток и недостаток металлов-микроэлементов
- •5.4. Хелатотерапия
- •5.5. Лекарственные препараты в качестве лигандов
- •5.6. Координационные соединения металлов как противоопухолевые средства
- •Приложение
- •Им окраски
- •Литература
- •Оглавление
- •Глава1.
- •Глава2.
- •Глава3.
- •Глава 4
- •Глава5. Координационные соединения
- •Учебное пособие
- •117997, Москва, ул. Островитянова, д.1.
2.3. Теория кристаллического поля
В 1929г. Г.Бете в статье «Расщепление атомных термов в кристаллах» заложил основы теоретического подхода к описанию распределения электронов в d- и f-оболочках центрального атома, координирующего относительно себя группы лигандов в окружениях различной симметрии. Этот подход, получивший название теории кристаллического поля, включает следующие основные положения:
а) Природа сил, вызывающих наличие координационных связей и определяющих устойчивость координационного соединения, сводится к чисто электростатическому взаимодействию между центральным ионом-комплексообразователем и лигандами.
б) Лиганды независимо от их реальной структуры рассматриваются в теории кристаллического поля как точечные заряды, характер расположения которых относительно центрального иона определяет симметрию действующего на него внешнего электростатического поля.
в) Электронная конфигурация центрального иона учитывается в рамках квантово-механических представлений.
В свободном атоме или ионе энергии всех d –электронов, принадлежащих к одной и той же электронной оболочке, одинаковы, т.е. имеет место вырождение энергетических уровней. Между электронными облаками d–электронов и лигандами действуют силы отталкивания, приводящие к увеличению энергии
d–электронов. Однако воздействие лигандов на различные
d–орбитали неодинаково. Энергия электронов на d–орбиталях, расположенных близко к лигандам, возрастает больше, чем на
d–орбиталях, удалённых от лигандов; в результате под действием лигандов происходит расщепление энергетических уровней
d–орбиталей.
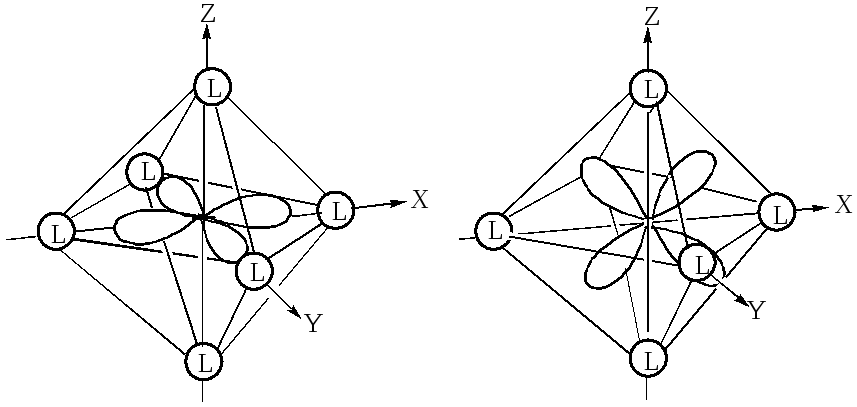
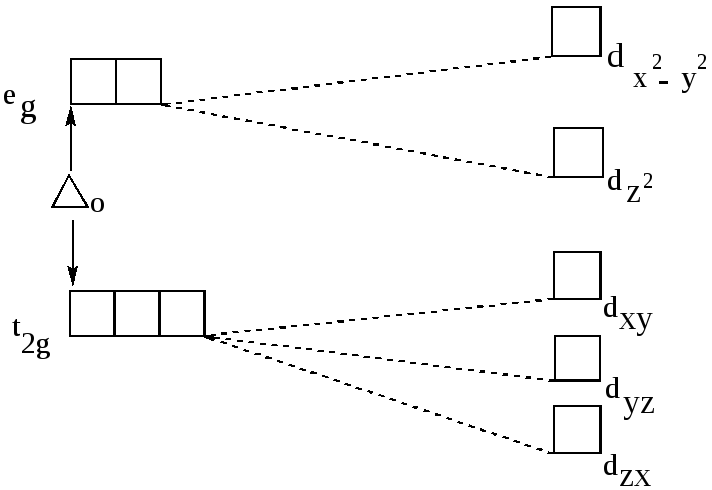
При октаэдрическом расположении лигандов вокруг центрального атома наибольшее отталкивание испытывают электроны, находящиеся на орбиталях dz2 и dx2-y2 , направленных к лигандам (рис.18), поэтому их энергия будет более высокой, чем у электронов, находящихся на орбиталях dxy,dxz,dyz, расположенных
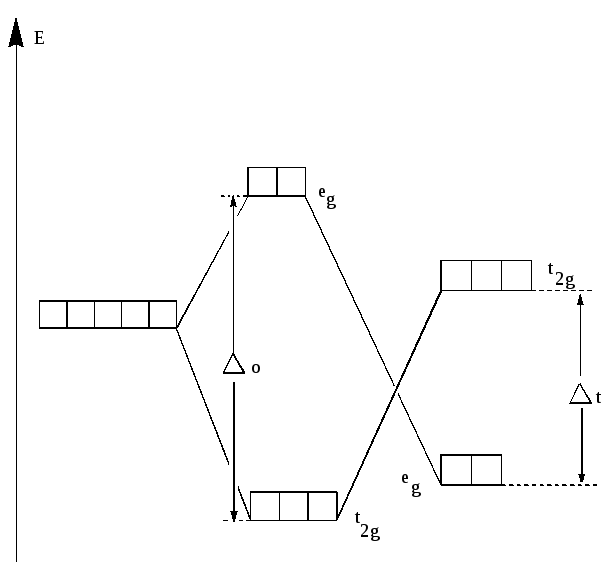
между лигандами. В октаэдрическом поле лигандов происходит расщепление d –уровня на два энергетических уровня: более высокий eg (соответствует орбиталям dz2,dx2-y2 ) и более низкий уровень t2g ( соответствует орбиталям dxy,dxz,dyz).Таким образом, вырождение пяти d –орбиталей иона снимается частично, что приводит к образованию двукратно вырожденного уровня eg и трёхкратно вырожденного уровня t2g.
Разница в энергиях уровней eg и t2g называется энергией расщепления . Расчёты показывают, что если за точку отсчёта принять энергию d–уровня, то энергия уровня eg равна о + 3/5, а уровня t2g соответственно, о - 2/5,где о-изменение энергии уровня под действием сферически симметричной части поля лигандов, -энергия расщепления.
а) б)
Рис. 18. Орбитали dx2-y2 (а) и dxy(б) в октаэдрическом поле
лигандов

а) б)
Рис.19. Орбитали dx2-y2 (а) и dxy(б) в тетраэдрическом поле
лигандов
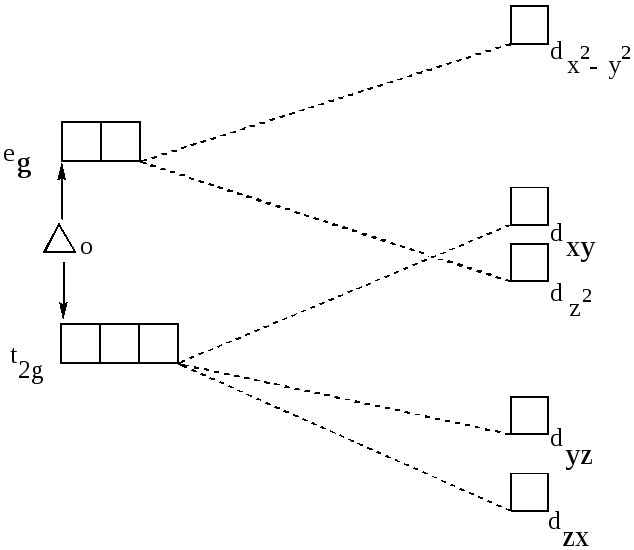
При тетраэдрическом расположении лигандов вокруг центрального атома наиболее близки к лигандам dxy-,dxz- dyz- орбитали (рис.19). Поэтому dxy-, dxz- dyz- электроны испытывают большее электростатическое отталкивание, чем dz2 - и dx2 -y2 – электроны и, следовательно, dxy-, dxz- dyz- орбитали обладают более высокой энергией, а dz2 - dx2-y2 - орбитали – низкой энергией. В этом случае образуется трёхкратно вырожденный уровень eg и двукратно вырожденный уровень t2g.. Для тетраэдрического окружения энергия расщепления меньше, чем для октаэдрического. Если лиганды и их расстояние от комплексообразователя одинаковы,
то t= 4/9о, где о - энергия расщепления в октаэдрическом комплексе, а t -энергия расщепления в тетраэдрическом комплексе ( рис. 20):
d-орбитали иона Ион в окта- Ион в тетра-
в сферическом эдрическом эдрическом
поле поле поле
Рис.20. Расщепление d-орбиталей кристаллическим полем
разной симметрии
eg – орбитали( dz2, dx2-y2) t2g- орбитали(dxy,dxz,dyz).
Поглощение света комплексными соединениями d-элементов теория кристаллического поля объясняет переходом электронов с t2g – подуровня на eg – подуровень в октаэдрических комплексах и с eg – подуровень на t2g – подуровень в тетраэдрических комплексах. При этом поглощается квант света, энергия которого равна энергии расщепления: h=, где h- постоянная Планка,- частота колебаний. Энергия расщепления, таким образом, оказывается математически связана с частотой колебания света в максимуме поглощения и, следовательно, с длиной волны максимума поглощения: =/h и =с/, где с- скорость света.
Основные факторы, влияющие на величину расщепления
а) Энергия расщепления тем больше, чем больше заряд катиона-комплексообразователя при прочих равных условиях (одинаковая электронная конфигурация, размеры ионов, одинаковое лигандное окружение, симметрия, число и природа лигандов). С увеличением заряда иона значение увеличивается, так как лиганды ближе подходят к иону и, следовательно, вызывают большее расщепление d-уровня. Экспериментально показано, что двухзарядные катионы 3-d переходного ряда имеют о в среднем 7500-12500см-1, а трёхзарядные 14000-25000 см-1 .
Например, аквакомплексы [Cr(H2O)6]2+ и [Mn(H2O)6]3+имеют соответственно синюю и вишнево-красную окраску. Ионы Cr2+ и Mn3+ изоэлектронны, их электронная конфигурация 3d4.Красное окрашивание [Mn(H2O)6]3+ свидетельствует о поглощении комплексом более коротких волн, т.е. о большей энергии расщепления, чем у комплекса [Cr(H2O)6]2+,который поглощает более длинные волны (красно-зелёная часть спектра видимого света),
и, следовательно, имеет более низкую энергию расщепления.
б) Для данного заряда (и электронной конфигурации) катиона-комплексообразователя, принадлежащего к ряду d–элементов, при заданном лигандном окружении расщепление тем больше, чем больше атомный номер элемента, образующего центральный ион. Так, в ряду гексааммиакатов Co3+,Rh3+,Ir3+ с d6-электронной конфигурацией{[Co(NH3)6]3+, [Rh(NH3)6]3+, [Ir(NH3)6]3+} расщепление увеличивается от Co к Ir . Это объясняется тем, что протяжённость d -орбиталей растёт в ряду 3d-4d-5d. Это приводит к усилению электростатического отталкивания между лигандами и электронами d-орбиталей центрального иона, что увеличивает неравноценность энергетического состояния электронов на t2g и eg - орбиталях, т.е. величина расщепления увеличивается.
в) Расщепление в октаэдрическом поле больше при прочих равных условиях, чем в тетраэдрическом. Объясняется это тем, что при одинаковом расстоянии металл-лиганд суммарный заряд лигандов и их суммарное отталкивание от d-орбиталей больше в октаэдре, чем в тетраэдре ( t 4/9о).
г) Величина расщепления зависит от природы лиганда, что определяется положением лиганда в спектрохимическом ряду:
I < Br < SCN- < Cl <NO3- < F < OH < ONO- < C2O42 < H2O
< NCS < CH3CN < NH3 < глицин < пиридин < этилендиамин<
дипиридил < о-фенантролин < NC- < NO2 < CN < CO.
Принято считать, что левее аммиака в спектрохимическом ряду располагаются лиганды “слабого поля”, а правее – лиганды “сильного поля”, дающие при прочих равных условиях большую величину расщепления.
Удовлетворительного обоснования расположению лигандов в этом ряду теория кристаллического поля не даёт. Например, теория не объясняет, почему более полярные лиганды, в частности, Н2О,( =1,85D) дают более слабое поле, чем менее полярные,например,NH3( =1,47 D).
Если общее число электронов, находящихся на d–орбиталях центрального атома, не превышает трёх, то они размещаются на орбиталях более низкого энергетического уровня по правилу Хунда. Например, три d-электрона иона Cr3+ в октаэдрическом поле занимают три d–орбитали с низкой энергией ( t2g): t2g3eg0 .
Благодаря такой электронной конфигурации комплексы Cr3+ очень прочны, так как электронные облака t2g-орбиталей располагаются между лигандами и слабо экранируют заряд ядра хрома. Поэтому комплексов Cr3+ известно очень много.
При наличии в ионе-комплексообразователе числа электронов, превышающего число орбиталей с низкой энергией, возможны
два варианта заполнения орбиталей электронами. В случае слабого поля энергетически более выгодным оказывается равномерное распределение d-электронов по всем d–орбиталям в соответствии с правилом Хунда. В этом случае центральный ион сохраняет высокое значение спина, так что образуется высокоспиновый парамагнитный комплекс (например: [FeF6]3 (рис.21).
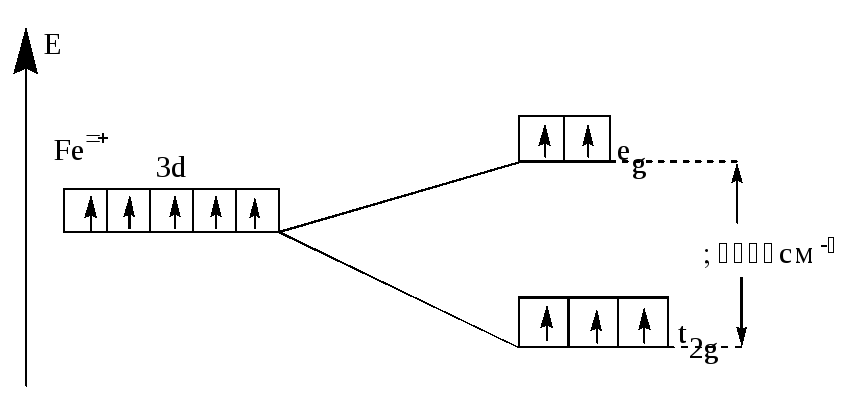
Рис.21. Распределение d-электронов по орбиталям иона Fe3+
в октаэдрическом комплексе [FeF6]3-.
В случае же сильного поля энергетически более выгодным будет размещение максимального числа электронов на t2g -орбиталях, при этом образуется низкоспиновый диамагнитный комплекс(например: [Fe(CN))6]3- (рис.22).
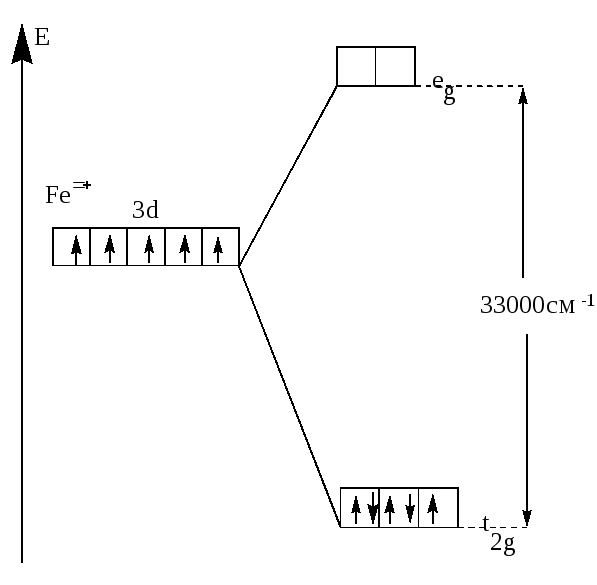
Рис.22. Распределение d-электронов по орбиталям иона Fe3+
в октаэдрическом комплексе [Fe(CN)6]3-.
Табл.1 показывает, что подразделение комплексов на высокоспиновые и низкоспиновые имеет смысл только в случае электронных конфигураций d4,d5,d6 и d7 ..
Таблица 1. Электронные конфигурации комплексообразователя в октаэдрических комплексных соединениях в слабом и сильном полях
|
Электрон- ная кон- фигурация
|
Распределение электронов по подуровням в слабом поле
|
Максим. спин
|
Распределение электронов по подуровням в сильном поле
|
Максим. спин
|
|
d1 |
t2g1eg0 |
0,5 |
t2g1eg0 |
0,5 |
|
d2 |
t2g2eg0 |
1,0 |
t2g2eg0 |
1,0 |
|
d3 |
t2g3eg0 |
1,5 |
t2g3eg0 |
1,5 |
|
d4 |
t2g3eg1 |
2,0 |
t2g4eg0 |
1,0 |
|
d5 |
t2g3eg2 |
2,5 |
t2g5eg0 |
0,5 |
|
d6 |
t2g4eg2 |
2,0 |
t2g6eg0 |
0,0 |
|
d7 |
t2g5eg2 |
1,5 |
t2g6eg1 |
0,5 |
|
d8 |
t2g6eg2 |
1,0 |
t2g6eg2 |
1,0 |
|
d9 |
t2g6eg3 |
0,5 |
t2g6eg3 |
0,5 |
|
d10 |
t2g6eg4 |
0,0 |
t2g6eg4 |
0,0 |
Стереохимия соединений d-элементов определяется теми же принципами что и для остальных элементов, т.е. тенденцией электронных пар занимать положения с минимальным взаимодействием между собой. Но для d –элементов приходится учитывать дополнительное влияние несвязывающих электронов на
(n -1)d- орбиталях. Если несвязывающая (n -1)d- конфигурация симметрична по отношению к октаэдрическому полю лигандов, то все шесть лигандов будут отталкиваться в одинаковой степени, и следует ожидать правильного октаэдрического строения. Такими конфигурациями являются:
do , например Ti+4 в [TiF6]4-
t2g3 , например Cr+3 в [Cr(C2O4)3]3-
t2g3 eg2(высокоспиновая), например Mn+2 в [MnF6]4-
Fe+3 в [FeF6]3-
t2g6 (низкоспиновая), например Fe+2 в [Fe(CN)6]4-
Co+3 в [Co(NH3)6]3+
t2g6eg2 , например Ni+2 в [NiF4]2- и [Ni(NO2)4]4-
t2g6eg4, например Zn+2 в [Zn(NH3)6]2+
Низкоспиновые комплексы (d6) ионов Co3+ и Fe2+ ,имеющие
d–электроны только на слабо экранирующих ядро t2g -орбиталях, весьма прочны и их известно очень много.
Неполное укомплектование электронами орбиталей t2g или eg нарушает симметрию комплексов. Так как t2g –орбитали направлены в пространство между лигандами, несимметричная конфигурация их мало влияет на стереохимию. С другой стороны, несимметричные eg – конфигурации оказывают большее влияние, так как их орбитали направлены прямо на лиганды, и, следовательно, некоторые из них будут отталкиваться сильнее, чем другие. В результате высокосимметричное координационное окружение центрального атома подвергается искажению, причём понижение симметрии сопровождается дополнительным расщеплением орбиталей, что приводит к появлению более устойчивых систем (рис.23).Это называется эффектом Яна-Теллера. Наиболее ярко эффект Яна-Теллера проявляется у комплексов, образованных лигандами сильного поля. В этом случае энергетическая выгода от дополнительного расщепления орбиталей особенно велика. Согласно теореме Яна-Теллера данный эффект может проявляться только в тех случаях, когда электронная структура центрального иона допускает двоякое распределение электронов по подуровням и тогда электроны могут разместиться на более выгодных подуровнях, появившихся вследствие дополнительного расщепления, а менее выгодные уровни оставить вакантными или менее заселёнными. Этот эффект проявляется в следующих электронных конфигурациях центрального атома:
t2g6eg1(d7- конфигурация, сильное поле),
t2g6eg2(d8-конфигурация, сильное поле),
t2g6eg3(d9 –конфигурация).
Более слабый эффект наблюдается в высокоспиновых системах:
t2g1eg0(d1-конфигурация),
t2g2eg0 (d2- конфигурация),
t2g4eg2( d6- конфигурация,слабое поле).
Октаэдр Искажённый октаэдр ( по оси z)
Рис.23. Слабое тетрагональное искажение октаэдрического поля.
Например, гексакоординационные комплексы меди(II) склонны к тетрагональному искажению, так как электронная конфигурация центрального иона Cu2+ как в слабом, так и в сильном октаэдрическом поле имеет вид t2g6eg3, а такое состояние допускает двоякое распределение электронов на eg -подуровне:
либо (dz2)2(dx2-y2)1, либо (dz2)1(dx2-y2)2.
У меди(II) электронами в той или иной мере заняты все
d–орбитали. Так как орбиталь dx2-y2 лежит выше в искаженном октаэдре, чем орбиталь dz2, неспаренный eg1 у меди размещается на высоколежащей dx2-y2 орбитали. На dz2 – орбитали оказывается элетронная пара eg2. Это приводит к очень сильному отталкиванию лигандов от центрального иона именно в направлении оси dz2, т.е. происходит вытягивание октаэдра.
Например, в комплексе [Cu(NH3)4(H2O)2]SO4 четыре связи
(Cu-N) имеют длину 2,05 Ао, длина связей (Cu-O) больше – 2,59 и 3,37(Ао). Таким образом, 4 лиганда (NH3), находящиеся в плоскости xy, прочно связаны с ионом меди, а два лиганда (H2O) связаны слабо и удалены. Это приводит к тетрагональному искажению октаэдру – он становится вытянутым.
В некоторых комплексах вследствие очень большого удаления от центрального иона лигандов, расположенных по оси z, координационное число уменьшается от 6 до 4. Октаэдр превращается в плоский квадрат (рис.24):
Октаэдр Сильно искажённый октаэдр
или квадрат
Рис.24. Сильное тетрагональное искажение октаэдрического комплекса с превращением его в квадратный комплекс.
Квадратные комплексы являются типичными для центральных ионов с d8-электронной конфигурацией, особенно для 4d- и 5d -переходного ряда. Многие комплексы Ni2+ имеют плоское квадратное строение. Однако превращение октаэдра в квадрат у Ni2+ достигается только в случае лигандов сильного поля. К числу таких комплексов относится, например,[Ni(CN)4]2-.Лиганды слабого поля дают парамагнитные высокоспиновые комплексы с различной степенью тетрагонального искажения в зависимости от силы поля, например, [Ni(H2O)6]2+.
Особенно характерны квадратные комплексы для d-элементов 5и 6 периодов таблицы Д.И.Менделеева с d8-электронной конфигурацией. Для этих элементов вследствие большой величины параметра расщепления образование квадратных комплексов происходит даже в случае лигандов слабого поля. Так, все комплексы Pd2+ и Pt2+ имеют плоское квадратное строение. Комплексы [PdCl4]2-, [PtCl4]2-, [Pt(NH3)4]2+ (слабое поле) и [PtCN)4]2-(сильное поле) являются низкоспиновыми, диамагнитными.
Не может проявляться эффект Яна-Теллера в высокоспиновых комплексах, образованных центральными ионами с электронной конфигурацией d5(t2g3eg2)- ионы Mn2+,Fe3+; d3(t2g3eg0)- ион Cr3+; d8(t2g6eg2)- ион Ni2+. В этих случаях перераспределение электронов невозможно, так как на t2g и eg нет свободных или неэквивалентных позиций, а изменение электронной конфигурации возможно только в случае сильного кристаллического поля. Экспериментально подтверждено для таких электронных конфигураций отсутствие искажений в октаэдрических комплексах.
