
Все лаборатарные работы
.pdf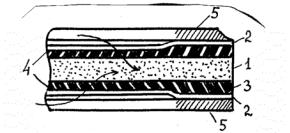
налов для прохода концентрируемой жидкости вдоль мембран. Фильтрующие элементы составлены из опорно-дренажных пластин, воспринимающих высокое давление и обеспечивающих отвод фильтрата. Опорно-дренажные пластины выполняются пористыми (из прессованных порошков полимеров, металлов, керамики), а также сочетания различных материалов, как на рис.3.3, или сплошными (например, из винипласта) с фрезерованными или сверлеными каналами для отвода фильтрата. Полупроницаемые мембраны в таких аппаратах - обычно полимерные пленки: ацетатцеллюлозные, нитроцеллюлозные, поливинилхлоридные, поликарбонатные, нейлоновые и т.д.
Рис. 3.3. Фильтрующий элемент аппарата «Фильтр-пресс»: 1-опорно-дренажная крупнопористая пластина; 2-мембрана; 3-водонепроницаемая фольга; 4-мелкопористая подложка под мембрану (например, ватман); 5-прокладки, разделяющие фильтрующие элементы
3.5.5. Флотация и электрофлотация (к опыту 3.7)
Для очистки от взвешенных веществ (нефтепродуктов, жиров, волокон, твердых частиц) пенная флотация получила наибольшее техническое распространение. В основе метода флотации лежит использование различий в смачивании разделяемых частиц водой. Рассмотрим механизм флотации на примере малых гидрофобных и гидрофильных минеральных частиц на границе раздела вода-воздух или вода-масло. Гидрофильные частицы смачиваются водой, и под действием поверхностного натяжения на границе вода-воздух или вода-масло частица втягивается в воду. Наряду с силой поверхностного натяжения на частицу действует и сила тяжести. В результате частица, смачиваемая водой, целиком перейдет в водную фазу и потонет.
Гидрофобные частицы вода не смачивает и под действием поверхностного натяжения на границе вода-воздух или вода-масло частица может остаться на границе раздела, если только она не слишком велика и сила тяжести не превысит флотационную силу. Схематически эти оба случая изображены на рис. 3.4. Практически флотационное разделение малоэффективно. Поэтому в настоящее время широкое применение получила
190

пенная флотация. Она заключается в том, что в суспензию тем или иным способом вводят пузырьки воздуха или газа.
Рис. 3.4. Разделение гидрофильных (а) и гидрофобных (б) частиц путем флотации:
1-водная фаза; 2-воздух или масло; 3-твердое тело
При всплывании пузырьки собирают по своей поверхности те частицы, на которых вода образует большой краевой угол. Частным случаем пенной флотации является электрофлотация.
Сущность метода электрофлотации состоит в том, что удаление твердых частиц дисперсной фазы осуществляется путем флотации их тонкодиспергированными пузырьками водорода и кислорода, образующимися в результате электролиза водной части осветляемой жидкости. При этом на катоде происходит реакция:
2 H2O + 2 |
е |
|
→ H2 + 2 OH − . |
(3.13) |
|
Образовавшиеся OH- - ионы движутся в направлении анода, где |
|||||
отдают свой заряд с выделением кислорода: |
|
||||
4 OH − - 4 |
|
→ 2 H2O + O2. |
(3.14) |
||
е |
|||||
Использование газов, выделяющихся при электролизе воды, приводит к изменению флотационных свойств в большей степени, чем использование обычных молекулярных газов, так как в момент образования эти газы более активны и выделяются в тонкодиспергированном виде.
3.5.6. Электрофорез и электроосмос (к опыту 3.6)
Наличие у частиц дисперсных систем электрического заряда было открыто еще в 1808 г. Процесс переноса частиц в электрическом поле получил название электрофореза. Процесс переноса жидкости при приложении разности потенциалов через пористую перегородку назван электроосмосом. Причем установлено, что количество жидкости, прошедшей через пористую перегородку пропорционально силе тока, и при
191

постоянной силе тока не зависит от площади сечения или толщины перегородки.
Причина обоих явлений одна и та же - наличие разноименных зарядов у твердой и жидкой фазы. В зависимости от того, что является неподвижным - жидкость или твердая поверхность, - наблюдается передвижение твердой фазы (электрофорез) или жидкости (электроосмос).
При электрофорезе (рис. 3.5) в результате возникновения электрического поля между электродами, благодаря малому размеру частиц дисперсной фазы, происходит перенос отрицательно заряженной дисперсной фазы к положительному электроду. При электроосмосе (рис.3.6) под влиянием электрического поля по капиллярам перегородки к отрицательному электроду передвигается положительно заряженная жидкость.
Заряд на частицах, проявляющийся при электрофорезе, обусловлен наличием на их поверхности двойного электрического слоя (ДЭС) из ионов, возникающего либо в результате избирательной адсорбции одного из ионов электролита, либо за счет ионизации поверхностных молекул вещества.
Рис. 3.5. |
Рис. 3.6. |
Схематическое изображение |
Схематическое изображение |
электрофореза |
электроосмоса |
При действии электрического поля на частицы, несущие двойной электрический слой, происходит явление, напоминающее электролиз. Если дисперсная фаза заряжена отрицательно, коллоидные частицы вместе с адсорбированными на них отрицательными потенциал-определяющими ионами движутся к аноду, а положительно заряженные противоионы - к катоду. Если дисперсная фаза заряжена положительно, направление движения частиц и ионов меняется на обратное. Явление электрофореза можно объяснить с помощью рис. 3.7.
192

Рис. 3.7. Схема движения частиц и противоионов при электрофорезе
Аналогичное объяснение имеет явление электроосмоса. ДЭС в этом случае образуется на внутренней поверхности капилляров перегородки либо в результате избирательной адсорбции одного из ионов электролита, присутствующего в жидкости, заполняющей капилляр, либо ионизации молекул вещества, из которого состоит капилляр, либо в результате
адсорбции на поверхности капилляра ионов OH − и H+. При наложении на капилляр электрического поля слой противоионов в капилляре будет смещаться параллельно неподвижному слою потенциал-определяющих ионов к катоду, что вызовет и перемещение к катоду всей жидкости, заполняющей капилляр, под действием сил трения и молекулярного сцепления.
3.6. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Цель работы: освоение навыков:
- извлечения ионов металла из раствора и перевод их в осадок реагентным способом;
-отделения осадка различными методами;
-определения выхода твердой фазы (осадка) по отношению к исходному раствору;
-оценки эффективности методов отделения твердой фазы.
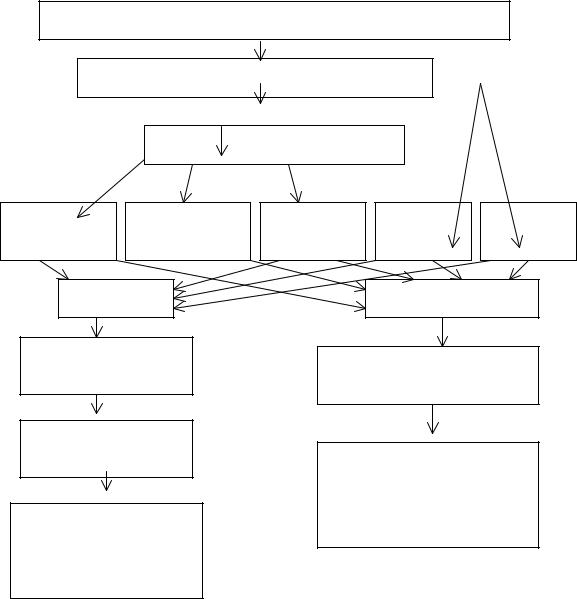
Порядок выполнения эксперимента: схема основных операций представлена на рис. 3.8.
Опыт 3.1. Осаждение ионов металлов реагентным методом
При электрохимической обработке различных металлов и сплавов в электролит переходят ионы тяжелых металлов: железа, никеля, хрома, кобальта и другие . Для более полного вовлечения этих металлов в шлам, а также очистки электролита от ионов металлов наибольшее распространение получил реагентный метод осаждения.
Выбор реагента-осадителя определяется следующим:
-осадитель должен обладать селективным действием, чтобы получаемый осадок не содержал ионы других металлов;
-для облегчения отделения и промывки желательно, чтобы образующийся осадок был крупнокристаллическим;
193
- для достижения полноты осаждения образующийся осадок должен обладать малой растворимостью.
Осаждением достигается снижение остаточного содержания ионов металла в электролите, улучшение условий отделения и получение более плотного осадка. Одним из реагентов для осаждения данных ионов металлов является Ca(OH)2. Действие его основано на проведении реакции
|
|
|
|
|
|
|
n+ |
+ n Ca(OH)2 |
3+ |
3+ |
2+ |
. |
(3.15) |
Me |
2 Me(OH) |
2+ n Ca |
|
|||
Раствор, содержащий ионы Fe (Crn ↓ |
, Ti ) |
|
|
|||
Проведение
Осаждение иона реагентным
Получение суспензии
Седиментация |
|
|
флокулянтом |
|
|
Осадок |
Рабочая жидкость |
|
Промывка дистил- |
Проведение качественной |
|
лированной водой |
||
реакции на ион |
||
|
||
Сушка при постоян- |
|
|
ной температуре |
Количественное опреде- |
|
|
ление содержания ионов |
|
Гравиметрическое |
фотоэлектроколоримет- |
|
рическим методом |
||
определение выхода |
|
|
осадка на исходный |
|
|
раствор |
|
Рис. 3.8. Схема проведения эксперимента
Для обеспечения рН осаждения гидроксидов (рНГО) (табл. 3.2) проводят корректировку рН системы.
194
Протеканию реакций осаждения гидроксидов благоприятствует повышение температуры и рН раствора. Если концентрация ионов OH − чрезмерно высока, гидроксиды многих металлов (например алюминия, цинка) вновь растворяются. Установлено, что ионы таких металлов, как железо, никель, кобальт, алюминий, титан, цинк, кадмий и некоторые другие, связываются водой в гидроксиды практически в нейтральной среде (табл. 3.2).
Таблица 3.2
Ионы |
Значения рН осажде- |
Произведения |
раст- |
металлов |
ния гидроксидов |
воримости гидроксидов |
|
Cr3+ |
4,5 – 7,5 |
6,3·10-31 |
|
Ni2+ |
6,5 – 9,4 |
6,3·10-18 |
|
Fe3+ |
1,7 – 8,3 |
6,3·10-38 |
|
Fe2+ |
5,0 – 7,2 |
8,0·10-16 |
|
Al3+ |
4,0 – 5,5 |
1,0·10-32 |
|
Ti3+ |
0,5 – 2,0 |
8,0·10-34 |
|
Co2+ |
6,6 – 9,2 |
2,0·10-16 |
|
Zn2+ |
7,0 |
1,2·10-17 |
|
Cd2+ |
6,8 |
2,2·10-14 |
|
Таким образом, для перевода ионов в нерастворимое соединение необходимо достижение соответствующего рН раствора.
План выполнения эксперимента
Наличие остаточных ионов металлов в растворе предварительно подтверждается использованием качественных реакций. Для обнаружения ионов Fe3+ в пробирку налейте 1-2 мл суспензии и добавьте 2 - 3 капли 0,5 M раствора соли K4[Fe(CN)6]. Синее окрашивание, обусловленное
образованием берлинской лазури Fe34+[Fe(CN)6]34− , доказывает наличие
ионов железа (III).
Количественное содержание Fe3+ определите, используя фотоэлектроколориметр, с помощью калибровочной кривой. Для этого к 50 мл суспензии прибавьте 3 мл раствора K4[Fe(CN)6]. Измерения проводите с использованием светофильтра (λ = 520 нм).
Затем проведите осаждение ионов железа раствором Ca(OH)2. Объем раствора Ca(OH)2, необходимого для осаждения, рассчитайте, используя стехиометрическое соотношение
2 Fe3+ + 3 Ca(OH)2 2 Fe(OH)3 ↓ + 3 Ca2+ , |
(3.16) |
учитывая, что концентрация Ca(OH)2 составляет 1 моль/л.
195
Для осаждения ионов Fe3+ отмерьте мерным цилиндром небольшой избыток раствора Ca(OH)2 по сравнению с расчетным. К 100 мл шламосодержащего раствора, находящегося в химическом стакане, приливайте небольшими порциями по стеклянной палочке раствор Ca(OH)2 до достижения рН~7, соответствующего рН образования гидроксида (табл. 3.2). С использованием универсального индикатора убедитесь, что рН = 7. Для этого каплю исследуемого раствора нанесите на индикаторную бумагу и получаемую окраску бумаги сравните с цветной шкалой, прилагаемой к пакету индикатора. При достижении рН = 7 определите объем раствора Ca(OH)2, который использовался для полного осаждения ионов Fe3+, и сопоставьте с объемом, полученным расчетным путем.
В отчете опишите суть реагентного метода с приведением химических реакций, расчет количества Ca(OH)2, необходимого для осаждения ионов Fe3+, план проведения эксперимента и наблюдения, уравнения качественных реакций.
После операции осаждения осадок необходимо отделить от электролита, так называемой рабочей жидкости. Для этого суспензию, полученную осаждением Ca(OH)2 , делят на три части. Каждую часть суспензии направляют на выделение осадка соответствующим методом: фильтрацией, центрифугированием и седиментацией.
Опыт 3.2. Центрифугирование как метод отделения твердой фазы
Для отделения осадка методом центрифугирования примерно третью часть осажденной суспензии, полученной в предыдущем опыте, поместите в специальную пробирку и установите на 5 минут в центрифугу. Под действием центробежных сил происходит разделение суспензии и уплотнение осадка. Затем из пробирки осторожно слейте рабочую жидкость в другую пробирку и проведите качественную оценку содержания иона металла в отделенном растворе. Для этого к отделенному раствору добавьте 1 мл 1 М раствора HCl, затем по каплям K4[Fe(CN)6]. Отсутствие окраски свидетельствует о разделении суспензии. Перед определением ионов Fe3+ в осадке, его растворите в 2 мл 1 М раствора HCl. Отчет оформляйте по общепринятой схеме.
Опыт 3.3. Седиментация
Для осаждения осадка седиментацией налейте в химический стакан третью часть суспензии, полученной в опыте 3.1. После этого флокулянт, в качестве которого используется 0,1 % раствор полиакрилоамида (ПАА), добавьте медленно в суспензию при непрерывном перемешивании раствора. ПАА добавляют из бюретки или пипетки, причем так, чтобы раствор флокулянта стекал по внутренней стенке, а не падал каплями в середину стакана, так как это может привести к разбрызгиванию. Суспензию
196

перемешайте стеклянной палочкой, следя за тем, чтобы палочка не касалась дна и стенок стакана. После добавления заданного количества флокулянта проверьте полноту осаждения. Для этого дают осадку собраться на дне стакана и, когда жидкость над осадком посветлеет, добавляют несколько капель ПАА. Если в месте падения капель раствора ПАА не появляется муть, то полнота осаждения достигнута. Отметьте время седиментации.
Затем отделите осадок, осторожно сливая рабочую жидкость из стакана. Рабочую жидкость и осадок проверьте на содержание иона металла путем проведения качественной реакции.
Опыт 3.4. Фильтрация суспензии
Установите стеклянную воронку на колбу, в которой будет собираться рабочая жидкость - фильтрат. Укладывайте фильтр в воронку так, чтобы он плотно прилегал к стенкам воронки, для чего фильтр смочите дистиллированной водой. Воронку с фильтром поместите в кольцо штатива, подставив под нее чистый стакан так, чтобы скошенный конец трубки касался стенки стакана (рис. 3.9).
Рис. 3.9. Фильтрование
Оставшуюся в стакане третью часть осажденной суспензии (опыт 3.1) небольшими порциями слейте на фильтр. Чтобы при фильтровании избежать разбрызгивания, эту операцию необходимо проводить с помощью стеклянной палочки, как показано на рис.3.9. После того как вся суспензия количественно перенесена на фильтр и стекли последние капли фильтруемой жидкости, фильтрат исследуйте на содержание иона металла проведением качественной реакции. Осадок, промыв и высушив в сушильном шкафу при
120 оС, взвесьте и рассчитайте его выход на исходный раствор (отношение массы получаемого осадка к объему утилизируемого раствора). Подробное описание операции промывки, высушивания осадков показано в 3.5.
После отделения твердой фазы тремя методами (опыты 3.2-3.4) все полученные результаты сведите в табл. 3.3.
197

Таблица 3.3 |
|
|
№ Метод отделения |
Время, |
Наличие ионов Fe3+ |
твердой фазы |
τ, мин |
в рабочей жидкости в осадке |
1Центрифугирование
2Седиментация
3Фильтрование
Проведя анализ результатов эксперимента и теоретической части, опишите достоинства и недостатки каждого метода.
Опыт 3.5. Промывание, высушивание и взвешивание осадка
а) Промывание осадка
После разделения суспензии на осадок и рабочую жидкость осадок необходимо промыть. Цель промывания осадка заключается в удалении адсорбированных на поверхности осадка примесей, а также рабочей жидкости, пропитывающей осадок. Осадок после центрифугирования и седиментации промывают декантацией. После фильтрации осадок промойте сначала декантацией, а под конец на фильтре. Процесс декантации заключается в добавлении в стакан с осадком некоторого количества промывной жидкости и тщательном перемешивании. После того как частицы осядут как можно полнее, слейте жидкость по палочке и затем внесите в стакан новую порцию промывной жидкости. При этом отмывание осадка от примесей и электролита сильно ускоряется. Декантацию повторите несколько раз.
Промывание декантацией не всегда полезно. Например, объемистые студенистые осадки, которые оседают слишком медленно, не рекомендуют промывать декантацией, так как это очень увеличивает время промывания.
Рис. 3.10. Фильтрование под вакуумом: 1-фильтрующий тигель; 2-колба для отсасывания; 3-вакуум-насос; 4-предохранительная склянка
Для того чтобы не потерять осадок при сливе промывной жидкости, операцию разделения суспензии можно проводить после промывки. Осадок после промывки декантацией полностью перенесите на фильтр. Для этого стакан обмойте малыми порциями промывочной жидкости и каждый раз
198
сливайте ее вместе с частицами осадка на фильтр. Затем промойте осадок на фильтре.
б) Высушивание и взвешивание осадка
После стадии промывки осадок необходимо высушить. Для этого поместите его в тщательно высушенный и взвешенный тигель или бюкс и высушите при постоянной температуре в сушильном шкафу, снабженном терморегулятором, периодически взвешивая охлажденный тигель или бюкс до тех пор, пока масса осадка не перестанет изменяться.
Разность массы чистого тигля m1 и тигля с высушенным осадком m2 дает массу непосредственно осадка ∆m. Отнеся массу высушенного осадка (∆m) к объему исходной суспензии (V), из которого этот осадок был выделен,
найдите концентрацию осадка в растворе по формуле |
|
|||||
С = |
m2 −m1 |
= |
∆m |
(г/л). |
(3.17) |
|
V |
V |
|||||
|
|
|
|
|||
Опыт 3.6. Отделение твердой фазы методом электрофореза
В опыте используется суспензия гидроксида Fe3+, в которой дисперсной фазой являются скоагулированные коллоидные частицы, образующиеся при гидролизе FeCl3 по реакции
FeCl3 + 3 H2O Fe(OH)3 + 3 HCl. |
(3.18) |
горяч. красно-бурый |
|
Гидроксид железа (III) является ядром мицеллы. В зависимости от концентрации компонентов адсорбционный потенциал-определяющий слой может быть представлен разными ионами (FeO+; Fe3+; H+), т. е. формула мицеллы может быть выражена одним из следующих вариантов:
m {[Fe(OH)3 ] nFeO+(n − x) Cl−}xCl− |
(3.19) |
или |
|
m {[Fe(OH)3 ] nFe3+3(n − x) Cl−}3xCl− , |
(3.20) |
или |
|
m {[Fe(OH)3 ] nH+(n − x) Cl−}xCl− . |
(3.21) |
Приготовленную суспензию гидроксида железа (III) поместите в U- образную трубку 2 прибора, изображенного на рис. 3.11.
После проверки электрической схемы преподавателем, замкните ключ 6 и реостатом 5 установите необходимую силу тока в цепи, равную 1 А. Отметьте время начала процесса.
199
