
Все лаборатарные работы
.pdfЭлектрохимическим восстановлением на катоде можно удалить из сточных вод металлы с положительным значением электродного потенциала, такие как Hg2+, Сг2+, Pb2+, Ni2+, можно восстановить непредельные
органические соединения, осуществить восстановление соединений Cr6+ до
Cr3+ и др.
Процесс электрохимического восстановления и окисления в значительной степени определяется составом электролита и величиной рН сточных вод, условиями проведения электролиза.
При электрофлотации на катоде и аноде образуются пузырьки водорода и кислорода, которые оказывают флотационное действие. Прилипая к частицам дисперсной фазы, поднимают их на поверхность.
Очистка сточных вод электрофорезом и электродиализом основана на использовании направленного движения ионов и заряженных частиц в процессе электролиза. Осуществляют такую очистку с помощью селективных ионообменных мембран (электродиализ) или фильтрующих материалов (электрофорез).
Электрокоагуляция. В процессе анодного растворения образуются коагулянты - гидроксиды металлов, которые снижают поверхностный заряд частиц под воздействием электрического поля.
В электролитах, содержащих активирующие ионы, такие как Cl − , Br − , стальной электрод при наложении электрического поля ионизируется по реакции
Feo - |
|
+ H2O → Fe(OH)адс + H+ ; |
(2.7) |
||
е |
|||||
Fe(OH)адс - |
|
+ H2O → Fe(OH)2 адс + H+ . |
(2.8) |
||
е |
|||||
Врезультате анодного растворения и последующего гидролиза
происходит накопление коагулирующего компонента. Гидроксид Fe(OH)2 образуется при рН > 4,5 и потенциале 0,8 В в виде коллоидного раствора.
Химические методы обработки сточных вод основаны на применении химических реакций, в результате которых загрязнения превращаются в соединения, безопасные для потребителя, или легко выделяются в виде осадков.
Вособую группу химических методов следует выделить хлорирование
иозонирование сточных вод, содержащих органические примеси, а также цианиды и другие пахнущие неорганические вещества. Хлорирование и озонирование наиболее часто применяют для доочистки и обезвреживания питьевой воды на городских водопроводных станциях.
Биологическая очистка - широко применяемый на практике метод очистки производственных сточных вод, позволяющий очистить их от многих органических примесей. Биологическое окисление осуществляется сообществом микроорганизмов (биоценозом), включающим множество различных бактерий, простейших и ряд более высокоорганизованных организмов - водорослей, грибов и т. д., связанных между собой в единый комплекс сложными взаимоотношениями (метабиоза, симбиоза и
160
антагонизма). Главенствующая роль в этом сообществе принадлежит бактериям, число которых варьирует от 106 до 1014 клеток на 1 г сухой биологической массы (биомассы). Число родов бактерий может достигать 5- 10, число видов - нескольких десятков и даже сотен.
Такое разнообразие видов бактерий обусловлено наличием в очищаемой воде органических веществ различных классов. Если же в составе сточных вод присутствует лишь один или несколько близких по составу источников органического углерода, т. е. один или несколько близких гомологов органического соединения, то возможно развитие монокультуры бактерий.
Сообщество микроорганизмов представлено одними бактериями в том случае, если очистку проводят в анаэробных условиях или при слишком неблагоприятном уровне питания, который представляет собой отношение количества органических веществ к числу микроорганизмов. Неблагоприятным уровнем питания может оказаться, например, слишком высокое соотношение количеств подаваемых на очистку загрязнений и биомассы микроорганизмов. Если очистку проводят в аэробных условиях (в присутствии растворенного кислорода), то при благоприятной обстановке в сообществе микроорганизмов развиваются простейшие, представленные числом видов от 1 до 15-30.
Механизм биологического окисления в аэробных условиях может быть представлен следующей схемой:
органические вещества + O2 + N + P → микроорганизмы + CO2 + H2O + биологически неокисляемые растворимые вещества. (2.9)
Реакция (2.9) символизирует окисление исходных органических загрязнений сточных вод и образование новой биомассы. В очищенных сточных водах остаются биологически неокисляемые вещества, преимущественно в растворенном состоянии, так как коллоидные и нерастворенные вещества удаляются из сточной воды методом сорбции.
Эффективность процессов биологической очистки зависит от многих факторов:
- существенно влияет на развитие микроорганизмов концентрация водородных ионов. Значительная часть бактерий развивается лучше всего в среде нейтральной или близкой к ней, однако имеются виды, хорошо развивающиеся в кислой среде рН = 4 - 6 (грибы, дрожжи) или, наоборот, в слабощелочной среде (актиномицеты).
Для эффективного процесса биологической очистки сточной воды, для нормального процесса синтеза клеточного вещества в среде должна быть
достаточная концентрация всех основных элементов питания - органического углерода, азота, фосфора. При нехватке N и P их добавляют искусственно в виде суперфосфата, аммофоса, ортофосфорной кислоты, хлорида аммония, мочевины и др.
161
Большое влияние на биологическое окисление оказывает кислородный режим и наличие токсичных веществ в среде. Токсичное действие на биологические процессы могут оказывать органические и неорганические вещества. Токсичное действие может быть и микробостатическим, если задерживается рост и развитие микроорганизмов, и убивающим (микробоцидным). Большинство веществ проявляет то или иное действие в зависимости от концентрации их в очищаемой смеси.
Биологическая очистка сточных вод может осуществляться как в естественных условиях (поля орошения, поля фильтрации, биологические пруды), так и в специальных сооружениях (аэратенки, метантенки).
При термической очистке сжигают жидкие отходы нефтепродуктов и других горючих в печах и горелках различной конструкции. Подлежащие сжиганию сточные воды должны иметь высокое содержание нефтепродукта, обычно не менее 30 %. Для этого сточные воды собирают в резервуарнакопитель, отстаивают и слой нефтепродукта подают на сжигание. В зоне горения поддерживается температура 800-1200 оС и избыток кислорода. При полном сгорании образуются продукты, не способные к дальнейшему горению: CO2, H2O и др. При неполном сгорании образуются H2S; HCN; COCl3 и др. Оптимальную температуру процесса, при которой обнаруживается минимальное количество загрязняющих веществ, определяют практическим путем.
2.2.3. Методы очистки цианистых сточных вод 2.2.3.1. Химические методы очистки
Среди известных методов химической нейтрализации сточных вод, содержащих цианистые соединения, техническое применение нашли лишь немногие. Примерный состав сточных вод в гальванических ваннах приведен в табл.2.3.
Самый старый метод основан на выделении ионов CN − в виде труднорастворимой комплексной соли, образующейся в основной среде в присутствии ионов Fe2+.
В зависимости от условий, в которых протекают эти реакции, возникает осадок берлинской лазури Fe4[Fe(CN)6]2 или турнбулевой сини Fe3[Fe(CN)6]2. Метод применим в случае очень точной выдержки всех установленных условий реакции и в особенности рН реакционной среды.
162
Таблица 2.3 Примерный состав сточных вод в гальванических ваннах
Показатели |
Концентрация сточных вод, г/л |
|
||
загрязнения |
|
|
|
|
|
цианистых |
хромовых |
кислых и основных |
|
Реакция, рН |
7 - 9,5 |
3 - 6 |
5 – 11 |
|
Взвесь, г/л |
0,1 - 0,4 |
0,05-0,2 |
0,3 |
- 3,5 |
Сухой остаток, |
|
|
|
|
г/л |
0,5 - 1,2 |
0,30-0,8 |
0,6 |
- 3,0 |
Хлориды, г/л |
<0,05 |
<0,05 |
0,1 |
- 0,7 |
Сульфаты, г/л |
<0,1 |
0,05-0,2 |
0,1 |
- 0,8 |
Тяжелые |
|
|
|
|
металлы, г/л |
0,005-0,080 |
0,005-0,1 |
0,01- 0,2 |
|
Цианиды, г/л |
<0,1 |
- |
|
- |
Применяемый метод удаления цианистых соединений из сточных вод базируется на их окислении хлором (либо гипохлоридом) в основной среде. Наиболее часто для этой цели применяют гипохлорид натрия, хлорную известь и газообразный хлор. Соединения эти в основной среде гидролизуются с получением ионов ClO − , которые с цианидами реагируют в
соответствии с реакцией |
|
CN − + HOCl → CNCl + OH − ; |
(2.10) |
CNCl + 2 OH − → CNO − + Cl − + H2O . |
(2.11) |
Реакция окисления цианидов до цианатов |
протекает в две стадии: |
сначала образуется хлорциан, который затем гидролизируется до цианата. Так как хлорциан является сильно отравляющим газом, то в
реакционной среде необходимо иметь такие условия, чтобы скорость реакции (2.11) была больше скорости реакции (2.10). Такие условия наблюдаются в том случае, когда концентрация цианидов в сточных водах не превышает 1 г/л, температура сточных вод меньше 50 оС и когда они имеют щелочную реакцию (рН > 8,5).
Из исследований скорости гидролиза хлорциана следует, что она значительно
зависит от рН среды: |
|
|
|
|
|
рН среды |
8 |
9 |
10 |
11 |
12 |
Продолжительность |
|
|
|
|
|
гидролиза CNCl, ч |
20 |
12 |
4 |
1 |
0,25 |
Установлено, что расход гипохлорида натрия при окислении цианидов до цианатов также зависит от рН реакции среды. При рН = 8,5 его расходуется на 35-80 % больше, чем следует из стехиометрических расчетов,
163
а при рН = 11 - на 10 % больше. Это связано с расходом гипохлорида на дальнейшее окисление части цианатов до двуокиси углерода и азота:
2 CNO − + OCl − + H2O → 2 OH − + Cl − + 2 CO2 + N2 . |
(2.12) |
Несмотря на то, что цианаты примерно в 1000 раз менее токсичны по сравнению с цианидами, все же они требуют дальнейшей нейтрализации, которая может протекать вышеприведенным способом, путем окисления до CO2 и N2 либо путем их гидролиза до солей аммония по реакции
CNO − + 2 H2O + 2 H+ → NH 4+ + H2CO3 . |
(2.13) |
При рН < 3 реакция гидролиза продолжается в течение двух минут. Гипохлоритный метод окисления цианидов до цианатов применяют
при очистке обычных сточных вод гальванических отделений, в которых концентрация цианидов (в пересчете на ионы CN − ) не превышает 100-200 мг/л. Сточные воды с более высокой концентрацией цианидов требуют соответствующего разбавления или других методов нейтрализации ввиду опасности выделения очень ядовитого цианида хлора.
2.2.3.2. Электрохимические методы очистки
Целесообразно применение электрохимических процессов для очистки цианистых сточных вод.
В процессе электролиза сточных вод, содержащих цианидные соединения, на аноде происходит окисление ионов CN − , а также комплексных ионов, например, [Cu(CN)3]2-, [Zn(CN)4]2- и других до цианатных ионов по реакции
CN − + 2 OH − - 2 |
|
→ CNO − + H2O, |
(2.14) |
||||
е |
|||||||
[Cu(CN)3]2- + 6 OH − - 7 |
|
|
→ Cu2+ + 3 CNO − + 3 H2O, |
(2.15) |
|||
е |
|||||||
[Zn(CN)4]2- + 8 OH − - 8 |
|
→ Zn2+ + 4 CNO − + 4 H2O, |
(2.16) |
||||
е |
|||||||
а на катоде наступают разгрузка и выделение катионов металла. Образующиеся в приведенных реакциях ионы цианата по мере
повышения их концентрации окисляются на аноде до CO2 в соответствии с реакцией
2 CNO − + 4 OH − + 6 |
е |
→ 2 CO2 + N2 + 2 H2O . |
(2.17) |
||
Так как реакционная среда основная, то на аноде протекает следующая |
|||||
реакция |
|
||||
4 OH − - 4 |
|
→ O2 + 2 H2O . |
(2.18) |
||
е |
|||||
Введение хлоридных ионов в реакционную среду приводит к значительному ускорению окисления цианидов с одновременным повышени-
164
ем выхода по току процесса более чем на 100 % (в среднем с 35 на 80 %) при одновременном снижении расхода электроэнергии на 30 %.
Лучшие результаты получают при электрохимическом окислении очень концентрированных растворов цианидов, а не разбавленных растворов. Установлено, что процесс электрохимического окисления цианидов протекает благоприятно в следующих условиях:
1)реакция сточных вод должна быть основной (рН > 11);
2)концентрация хлоридов не должна превышать концентрацию цианидов (CN − ) более чем в пять раз;
3)аноды должны быть изготовлены из графита, а катоды из кислотоупорной стали (расстояние между электродами 8 - 10 мм);
4)анодная плотность тока должна быть 0,001 А/см2;
5) сточные воды должны перемешиваться сжатым воздухом. Сравнительный анализ стоимости очистки цианистых сточных вод
химическим и электрохимическим способами отдает предпочтение электрохимическому методу. Этот метод прост в применении, а также не требует строительства сложных устройств, типичных для химического метода.
2.2.4. Очистка хромовых сточных вод
Наибольшее распространение в практике очистки промышленных сточных вод от шестивалентного хрома нашел реагентный метод. Реагентная (химическая) очистка заключается в том, что сначала Cr6+ восстанавливается до Cr3+, который затем осаждают в виде Cr(OH)3. Для восстановления Cr6+ используются широко распространенные восстановители: сернистый газ (SO2), бисульфит и сульфит натрия (Na2SO3), железный купорос (FeSO4). Осаждение трехвалентного хрома проводят известковым молоком, щелочью, углекислым натрием при рН = 8 - 9. Восстановление Cr6+ можно проводить также посредством других неорганических и органических веществ, как, например, стальные стружки, опилки, сахар, патока, бумага и др. Во всех случаях при осаждении трехвалентного хрома выпадает большое количество осадков, особенно при восстановлении хрома солями железа и осаждении известковым молоком. Восстановление протекает по уравнениям
K2Cr2O7+3Na2SO3+4H2SO4 →Cr2(SO4)3+3Na2SO4+K2SO4+4H2O, |
(2.19) |
|
K2Cr2O7 |
+ FeSO4 + H2SO4 →Cr2(SO4)3+Fe2(SO4)3+K2SO4+H2O, |
(2.20) |
K2Cr2O7 |
+ 3SO2 + H2SO4 → Cr2(SO4)3 + K2SO4 + H2O. |
(2.21) |
Затем в щелочной среде выпадает осадок в виде |
|
|
|
Cr3+ + 3 OH − → Cr(OH)3 ↓. |
(2.22) |
165
Характер реакции между Cr6+ и сернистым ангидридом определяется величиной рН; она протекает количественно и довольно быстро только при наличии избытка в растворе сернистой кислоты и при рН ниже 5. Этот процесс можно использовать не только для очистки сточных вод от Cr6+, но и для санитарной очистки газов от SO2.
Обезвреживание хромсодержащих стоков можно осуществить электрохимическим методом. В процессе электрокоагуляции на аноде из железа или стали происходит анодное растворение с образованием Fe(OH)2. Ионы двухвалентного железа являются восстановителями, поэтому термодинамически возможно протекание реакции восстановления Cr6+ до Cr3+, который не обладает токсичным действием. Восстановление протекает в кислой среде по реакции
Cr2O 72− + 6 Fe2+ + 14 H+ → 2 Cr3+ + 6 Fe3+ + 7 H2O |
(2.23) |
Кроме того, восстановление Cr2O 72− может происходить не только в объеме электролита, но и у катода:
Cr2O 72− + 14 H++ |
6 |
|
→Cr3+ + 7 H2O, |
(2.24) |
||
е |
||||||
2H+ + 2 |
|
|
→H2 . |
(2.25) |
||
е |
||||||
В результате протекания этих реакций величина рН увеличивается и ионы Fe3+ и Cr3+ осаждаются в виде гидроксидов.
Степень электрохимической очистки хромсодержащих вод зависит от плотности тока и увеличивается с возрастанием последней, приемлемая
плотность тока 3 А/м2, при большей концентрации Cr2O 72− - более 150 мг/л
можно использовать плотности тока до 100 А/м2 при рН = 3.
Процесс очистки сточных вод от шестивалентного хрома может быть осуществлен при использовании анодов из свинца; восстановление бихромат-ионов происходит у катода, а свинцовый электрод не растворяется.
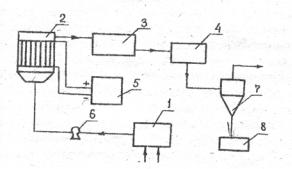
Принципиальная схема очистки хромовых сточных вод представлена на рис. 2.2.
Широкое распространение для извлечения ионов металлов (в частности, шестивалентного хрома) получил гальванокоагуляционный метод. В основе данного метода лежит принцип восстановления бихромата ионами двухвалентного железа в кислой среде, которая появляется вследствие работы бесконечно большого количества короткозамкнутых элементов типа
Fe-кокс, Fe-Cu.
В короткозамкнутом гальваническом элементе происходят следующие процессы: железные опилки являются анодами короткозамкнутого
166
гальванического элемента, а кокс является катодом. На катоде происходит восстановление воды и, следовательно, идет защелачивание, а на аноде образуются ионы железа по реакции
Fe0 → Fe2+ + 2 |
|
. |
(2.26) |
е |
Рис. 2.2. Схема очистки хромсодержащих сточных вод:
1 – усреднитель; 2 – коагулятор; 3 – сборник; 4 – напорный бак; 5 – источник тока; 6 – насос; 7 – циклон; 8 – шламонакопитель
Сточные воды предварительно направляют в усреднитель 1, в котором рН воды доводится до оптимальных значений ( ≈3). Затем сточные воды перекачиваются насосом 6 в проточный электрокоагулятор 2, футерованный винипластом.
Двухвалентные ионы железа, будучи восстановителями, вступают в реакцию с шестивалентным хромом в кислой среде по реакции:
6 Fe2+ + Cr2O 72− + 14 H+ → 6 Fe3+ + 2 Cr3+ + 7 H2O. |
(2.27) |
Таким образом, для прохождения гальванокоагуляции необходимо введение твердой фазы Fe-кокс и создание кислой среды.
2.2.5. Нейтрализация кислых и щелочных сточных вод
Кислые и щелочные воды перед выпуском в водоем или подачей в биологические очистные сооружения должны быть нейтрализованы.
Нейтрализация сточных вод достигается добавкой в сточные воды таких веществ, под влиянием которых наступает нейтрализация содержащихся в них кислот или щелочей и выделение в виде осадка других загрязнений, в основном ионов тяжелых металлов. Применяемые реагенты должны способствовать образованию легко фильтрующихся осадков.
Кроме того, нейтрализация сточных вод необходима для предотвращения коррозии трубопроводов, канализационных сооружений.
167
Применяют следующие способы нейтрализации: а) взаимную нейтрализацию кислых и щелочных сточных вод (если они имеются на данном предприятии); б) нейтрализацию реагентами; в) фильтрование через нейтрализующие материалы (известняк CaCO3, магнезит MgCO3, доломит CaCO3·7MgCO3, обожженный магнезит MgO).
Кислые сточные воды травильных отделений нейтрализуются известковым молоком до рН = 8-9, вследствие чего наступает нейтрализация содержащихся в них кислот и выделение железа и других металлов в виде осадка соответствующих гидроокисей.
Рассмотрим ряд химических реакций, иллюстрирующих влияние
оксида кальция на различные составляющие травильной ванны: |
|
H2SO4 + CaO + H2O → CaSO4 + 2 H2O, |
(2.28) |
FeSO4 + CaO + H2O → CaSO4 + Fe(OH)2, |
(2.29) |
2 HCl + CaO + H2O → CaCl2 + 2 H2O, |
(2.30) |
FeCl2 + CaO + H2O → CaCl2 + Fe(OH)2. |
(2.31) |
При нейтрализации травильных сточных вод растворами NaOH и Na2CO3 выпадает в осадок лишь гидроокись или карбонат закиси железа.
Наименьший объем занимают осадки, полученные при нейтрализации концентрированных сточных вод травильных отделений растворами карбоната натрия, однако из-за технологических трудностей (обильное выделение CO2) этот реагент применяют редко.
Осаждение выделенных осадков, содержащих гидроксид железа и образованных в процессе нейтрализации известняковым молоком, можно значительно ускорить добавками определенных соединений коагуляционного и флокуляционного действия (например, полиакриламида). В промышленной практике часто применяют перемешивание нейтрализованных сточных вод сжатым воздухом, что способствует окислению Fe(OH)2 до Fe(OH)3 и образованию очень быстро оседающей взвеси.
Для нейтрализации любых щелочей применимы серная, соляная, азотная, фосфорная и другие кислоты. Для нейтрализации щелочных сточных вод можно использовать углекислый газ. Основным преимуществом нейтрализации углекислым газом является низкая стоимость проведения процесса, так как для этой цели можно использовать CO2 дымовых газов.
Общее уравнение реакции углекислого газа с растворами гидроокисей следующее:
CO2 |
+ OH − → CO 2− + H2O. |
(2.32) |
|
3 |
|
2.2.6. Очистка сточных вод от нефтепродуктов
Сточные воды, содержащие нефтепродукты (бензин, керосин, масла, мазут, смазочно-охлаждающие жидкости), образуются в процессе обработки
168
деталей, их промывки, расконсервации, а также при использовании в качестве топлива бензина или керосина.
Общепринятая схема очистки сточных вод от нефтепродуктов включает три стадии: 1) механическая очистка от грубодисперсных примесей, твердых и жидких; 2) физико-химическая очистка от мелкодисперсных частиц (например, флотация); 3) глубокая очистка сточных вод (озонирование, сорбция, биологическая очистка).
Для отделения масел, жиров, смол, нефти и нефтепродуктов, плавающих на поверхности сточных вод, используют различной конструкции маслоуловители, жироловки, нефтеловушки.
Механическая очистка нефтепродуктов осуществляется в нефтеловушках. Они представляют собой горизонтальный отстойник, оборудованный трубопроводами для слива верхнего слоя, содержащего в основном нефтепродукты, и нижнего - для слива осветленной воды. Продолжительность пребывания воды в нефтеловушке обычно составляет 2 ч, при расчетной скорости потока 3-8 мм/с. Остаточное содержание нефтепродуктов после осветления составляет 50-1000 мг/л.
Вторая стадия очистки нефтесодержащих сточных вод - флотация. Содержание нефтепродуктов в воде после флотационной обработки составляет 10-20 мг/л. Для слива в водоемы необходимо проводить очистку от нефтепродуктов до санитарных норм, т. е. до величины 0,1- 0,3 мг/л. Это достигается путем доочистки воды озонированием, сорбционной или биологической очисткой.
169
