
Все лаборатарные работы
.pdf
1-бюретка;
2-водяная рубашка;
3-напорная склянка;
4-гребенка;
5-трехходовые краны на поглотительных сосудах; 6,7-поглотительные
сосуды; 8-фильтр; 9-трехходовой кран
для отбора газа
Рис. 5. 7. Схема газоанализатора ГХП-ЗМ
Порядок работы
1. Подготовка прибора к работе.
Перед началом работы необходимо удалить из прибора воздух. Для этого сначала устанавливают поглотительные растворы на уровне меток, наносимых на капиллярной трубке поглотительного сосуда. Для этого ставят трехходовой кран 9 в такое положение, чтобы газоанализатор сообщался с атмосферным воздухом. Поднимают уравнительную склянку и вытесняют газ в атмосферу, при этом затворную жидкость доводят приблизительно до половины бюретки. Затем трехходовой кран поворачивают таким образом, чтобы прибор был изолирован от атмосферы. Открывают кран 5 на поглотительном сосуде, уровень поглотителя в котором необходимо поднять, и очень медленно опускают напорную склянку. Следует обратить внимание на то, чтобы жидкость не попадала на гребенку.
Когда поглотительные растворы во всех баллонах 6 доведены до метки, проверяют прибор на герметичность. Для этого заполняют бюретку до верхней метки запорной жидкостью, прибор изолируют от окружающей среды и ставят уравнительную склянку на нижнюю полку прибора. Если уровень жидкости в поглотительных сосудах и в бюретке сначала несколько опускается, а затем остается постоянным, то прибор герметичен.
2.Взятие пробы на анализ
Кгазоанализатору через фильтр 8 присоединяют газовую пипетку с контрольной пробой газа для анализа. При этом напорную склянку устанавливают на верхнюю полку прибора. Кран 9 должен быть в таком положении, чтобы бюретка была соединена с газовой пипеткой и разобщена
сатмосферой. Открывая краны на газовой пипетке, медленно опускают напорную склянку газоанализатора - газ поступит в бюретку. Для удаления
145
воздуха из гребенки и отростков ее промывают газом: наполняют газом часть бюретки (20-25 мл) и затем впускают газ через кран 9 в атмосферу. Промывку повторяют 2-3 раза, затем отбирают пробу для анализа. В бюретку набирают газ немного больше 100 мл. Поднятием напорной склянки сжимают газ и доводят уровень запирающей жидкости в бюретке до деления 100 мл, быстрым поворотом крана 9 выпускают избыток газа в атмосферу. После взятия пробы газа на анализ прибор изолируют от источника газа.
3. Проведение анализа
Анализ газа начинают с определения содержания СО2. Газ переводят из бюретки в поглотительный сосуд 1 с раствором КОН. Для этого на сосуде открывают кран 5 и медленно поднимают уравнительную склянку. Не закрывая крана на сосуде 1, опускают уравнительную склянку, переводя частично газ снова в бюретку (следить, чтобы поглотительные растворы не попадали на гребенку). Так делают 3-4 раза, после чего доводят уровень жидкости в поглотительном сосуде до метки. Закрывают кран 5 и измеряют оставшийся объем. Для этого подносят уравнительную склянку к бюретке и устанавливают уровень жидкости на одной высоте. Замеренный объем записывают. Поглощение продолжают до постоянного объема (разница между двумя измерениями должна быть меньше 0,2 мл). Так же проводят поглощение кислорода и СО. После этого готовят прибор к анализу следующей пробы. Для этого сообщают кран 9 с атмосферой и вытесняют остаток газа из системы, доведя уровень жидкости в бюретке до верхней метки.
Результаты опыта заносят в таблицу по образцу, приведенному в табл.5.7.
Таблица 5.7 Запись результатов анализа (взято 100 мл газа)
|
Кол-во газа |
Расчет |
|
||
|
после погло- |
|
|
|
|
Компо |
щения, мл |
|
|
|
|
нент |
|
|
|
|
|
|
|
|
мл |
об.% |
|
1 |
2 |
3 |
|
4 |
|
СО2 |
85,60 |
100 −83,20 |
16,80 |
||
|
84,80 |
||||
|
83,20 |
|
|
|
|
|
16,80 |
|
|
||
|
83,20 |
|
|
|
|
O2 |
82,80 |
|
|
|
0,80 |
|
82,60 |
|
|
|
|
146

|
|
82,40 |
|
83,20 −82,40 |
|
|
|
|
82,40 |
|
|
|
|
|
0,80 |
|
|
|||
CO |
|
81,40 |
|
|
|
6,80 |
|
|
76,80 |
|
82,40 −75,60 |
||
|
|
75,60 |
|
|
|
|
|
|
|
6,80 |
|
|
|
|
|
75,60 |
|
|
|
|
N2 |
|
75,60 |
|
75,60 |
|
75,60 |
|
ИТОГО |
|
100,00 |
|
100,00 |
|
4. Расчеты
Содержание компонентов газовой смеси вычисляют в % об. по формуле
ma = VVa , (5.26)
общ
где Va - объем компонента в анализируемой газовой смеси, мл; Vобщ. - объем газовой смеси, взятой для анализа, мл.
Опыт 5.9. Определение хлористого водорода в воздухе производственных помещений
Определение малых количеств НС1 в воздухе проводят нефелометрическим методом, основанным на определении мутности растворов при образовании хлорида серебра.
Пробу для анализа отбирают, пропуская воздух с заданной скоростью через поглотительные растворы. Анализируемое вещество накапливается в поглотительных растворах, и затем его определяют соответствующим методом. Поглотительный сосуд для хлористого водорода содержит воду. Воздух со скоростью 50 л/ч пропускают в течение 10 мин через 2 поглотительных сосуда, содержащих 10 мл воды.
Ход определения
В 2 пробирки для колориметрирования емкостью по 10 мл введите по 5 мл раствора из поглотительных сосудов. Приготовьте серию эталонных растворов в семи таких же пробирках. Для этого в шесть пробирок введите из микробюретки 0,5; 1,0; 2,0; 3,0; 4,0; 5,0 мл стандартного раствора КС1 с содержанием хлорид-ионов 0,01 мг/мл, что соответствует содержанию хлорид-иона 0,005; 0,01; 0,02; 0,03; 0,04 и 0,05 мг. В первую пробирку стандартный раствор не вводите. Объемы растворов в пробирках доведите водой до 5 мл. В пробирки с исследуемыми и эталонными растворами добавьте из пипеток по 2 мл 10 % раствора азотной кислоты и 1 мл 1 %
147
раствора нитрата серебра, перемешайте и через 10 мин сравните на черном фоне интенсивность помутнения исследуемых и эталонных растворов.
Расчет содержания хлористого водорода Содержание НС1 (в мг/м3) вычисляют по формуле
|
a V |
|
|
a1 V1 |
|
|
|
||
|
|
|
|
×1,03 1000, |
(5.27) |
||||
|
|
V |
|
+V V |
|||||
X = V |
2 |
0 |
|
||||||
|
|
|
3 0 |
|
|
|
|||
где а и а1 - содержание хлоридов в эталонах, интенсивность помутнения которых оказалась наиболее близкой к исследуемым растворам, мг; V и V1 - объемы воды, взятые для определения из поглотительных сосудов, мл; V2 и V3 - объемы растворов, взятые для определения из поглотительных сосудов, мл; V0 - объем воздуха, отобранного для анализа, приведенный к нормальным условиям, л ; 1,03 - коэффициент пересчета хлорид-иона на НС1.
Объемы воздуха приводят к нормальным условиям по формуле
V |
0 |
= |
Vв 273 Р |
, |
(5.28) |
|
|
||||||
|
(273 |
+t) 760 |
|
|
||
|
|
|
|
|||
где Vв - объем воздуха при отборе пробы, л; Р - атмосферное давление при отборе пробы, мм. рт. ст.; t - температура в помещении, оС.
Сравните полученные данные с ПДК НС1 в воздухе производственных помещений.
Опыт 5.10. Определение хлора в воздухе производственных помещений
Данный экспресс-метод основан на реакции окисления хлором о-толуидина с образованием соединения, окрашенного в желтый цвет.
Ход определения
В поглотительный сосуд емкостью 5 мл внесите пипеткой 3 кг поглотительного раствора и пропустите 20 мл анализируемого воздуха из шприца. Раствор из поглотительного сосуда перенесите в колориметрическую пробирку и сравните интенсивность его окраски со шкалой стандартов.
Содержание хлора в воздухе (в мг/м3) определите по формуле
X = |
a 1000 |
, |
(5.29) |
|
V |
||||
|
|
|
||
0 |
|
|
||
148
где а - содержание хлора, найденное по шкале стандартов, мг; V0 - объем воздуха, отобранного для анализа, приведенный к нормальным условиям, л.
Сравните полученное содержание хлора в воздухе с ПДК.
5.3.4. Анализ газовых смесей методом газоадсорбционной хроматографии
Характерной особенностью метода является многократность повторения адсорбции и десорбции разделяемых компонентов, что обусловливает достаточную его эффективность.
Разделение веществ происходит в колонках, заполненных твердым адсорбентом. Подвижная фаза (газ-носитель) в определенной последовательности, зависящей от склонности к адсорбции отдельных компонентов газовой смеси, выносит их из колонки. Контроль разделения осуществляется детектором, реагирующим на изменение состава газа при его выходе из колонки. Обычно сравнивают теплопроводности газаносителя и анализируемого вещества.
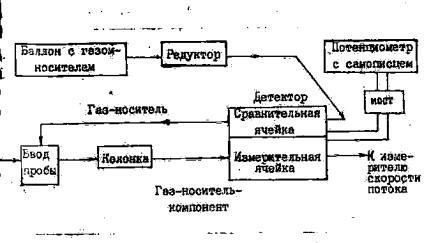
Аппаратура для хроматографического разделения газовых смесей состоит из четырех основных узлов: 1) устройства для подачи газа-носителя и регулирования газового потока; 2) входной ячейки для впуска пробы - исследуемой газовой смеси; 3) хроматографической колонки; 4) детектора.
Принципиальная схема газового хроматографа приведена на рис.5.8.
Рис.5.8. Принципиальная схема газового хроматографа
Прочность удерживания сорбентом поглощенных веществ зависит от их физико-химических свойств и от условий, при которых осуществляется хроматографический анализ. Прочность удерживания исследуемых компонентов определяется так называемым временем удерживания и служит характеристикой этих компонентов. Кривая изменения концентрации разделенных веществ в зависимости от времени удерживания называется хроматограммой.
На рис. 5.9 изображена хроматограмма газовой двухкомпонентной
149
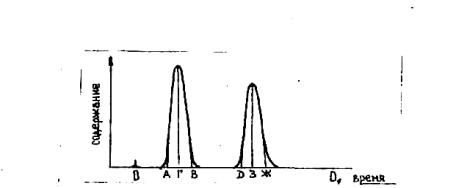
смеси. 001 - нулевая линия. Точка 0 соответствует вводу анализируемой пробы. Кривые АГВ и ДЗЖ носят название хроматографических пиков разделенных веществ. На хроматограмме время удерживания соответствует времени выхода пика, которое принято считать с момента ввода пробы до появления максимума пика, т. е. ОГ и ОЗ. Чтобы в значительной мере исключить влияние условий хроматографирования на этот параметр, находят относительное время удерживания, т. е. отношение времени удерживания данного компонента к времени удерживания вещества, принятого за эталон.
Расшифровка хроматограммы проводится различными методами. Одно из возможных направлений - сравнение времени удерживания анализируемых компонентов с временем удерживания известных соединений.
Рис.5.9. Хроматограмма двухкомпонентной газовой смеси
Для этого к исследуемой пробе добавляют стандартное вещество и по значениям относительных времен удерживания характеризуют компоненты смесей. Наличие или отсутствие компонента может быть определено добавлением этого вещества к анализируемой смеси. В первом случае происходит увеличение соответствующего пика хроматограммы, во втором - появляется новый пик. Концентрацию компонентов анализируемой смеси рассчитывают как отношение площади соответствующего пика к сумме площадей всех пиков.
Опыт 5.11. Хроматографический анализ газовой смеси, состоящей из O2, N2, СО, СН4
Анализ проводят на хроматографе ХЛ-4.
Условия анализа: газ-носитель водород, скорость 30 см3/мин, рабочая температура колонки и детектора 20 оС, рабочий ток детектора 100 мА, объем пробы для анализа 2 мл. Колонка хроматографа длиной 1,5 м, диаметром 4 мм заполнена молекулярными ситами СаХ с зернением 0,25- 0,5 мм, активированным при 600 оС в течение 4 ч.
Проведение анализа
150
Прибор подготовьте к работе. Из газовой бюретки через дозатор в систему введите пробу исследуемого газа и запишите пики выходящих компонентов. После проведения анализа обработайте хроматограмму. Найдите площадь пиков на хроматограмме. Умножьте полученные площади пиков хроматограммы на коэффициенты, учитывающие разницу в теплопроводности (табл. 5.8). Площадь пика каждого компонента есть произведение высоты пика на его ширину, измеренную на половине высоты.
Содержание каждого компонента определите по формуле |
|
||||
X |
i |
= |
Si 100 |
, |
(5.30) |
|
|||||
|
|
∑Si |
|
||
где Xi - содержание компонента, |
%; Si - исправленная |
площадь пика |
|||
компонента; Σ Si - суммарная исправленная площадь.
Таблица 5.8 Поправочные коэффициенты, учитывающие разницу в теплопроводности (газ-носитель водород, стандарт н-бутан)
Соединение |
Азот |
Кислород |
CO |
CH4 |
CO2 |
Поправочный |
|
|
|
|
|
коэффициент |
1,76 |
1,95 |
1,87 |
2,03 |
1,55 |
5.3.5. Утилизация вредных примесей
Опыт 5.12. Утилизация диоксида серы
Для очистки газов, содержащих SO2, используют хемосорбционные методы. Для абсорбции используются вода, водные растворы и суспензии солей щелочных и щелочноземельных металлов, аммиачная вода. В пробирку насыпьте кристаллы сульфита натрия, добавьте 6-8 капель 4 н раствора серной кислоты и быстро закройте пробкой с газоотводной трубкой. Выделяющийся в пробирке газ направьте поочередно в две пробирки с водой и аммиачной водой. В пробирку с водой добавьте нейтральный раствор лакмуса, а в пробирку с аммиачной водой - раствор фенолфталеина. Наблюдайте изменение цвета лакмуса и фенолфталеина.
Напишите уравнения реакций получения диоксида серы, реакции его с водой и NH4OH.
Опыт 5. 13. Утилизация сероводорода фосфатным методом
Для абсорбции сероводорода фосфатным методом применяют растворы, содержащие 40-50 % фосфата калия.
151
В пробирку насыпьте мелкие кусочки сульфида железа FeS. Добавьте 8-10 капель концентрированной соляной кислоты (d = 1,19 г/см3). Закройте пробирку пробкой с газоотводной трубкой, направьте газ в пробирку с 40 % раствором К3РO4:
К3РO4 + Н2S = КНS + К2НРO4. |
(5. 31) |
После окончания реакции проверьте наличие сероводорода в воздухе пробирки, проведя качественную реакцию на сероводород. Запишите наблюдения.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1.Назовите основные источники загрязнения атмосферы машиностроительным комплексом.
2.Загрязнение атмосферы транспортом.
3.Что такое организованный и неорганизованный промышленный
выброс?
4.Виды газовых выбросов и их состав.
5.Вредное влияние компонентов газовых выбросов на организм человека. ПДК.
6.Методы очистки газов от пыли и принцип действия пылеулавливающих аппаратов.
7.В чем заключаются абсорбционные методы очистки газов? Их классификация.
8.Способы очистки газов от SO2, оксидов азота, сероводорода, оксида углерода, галогенов и их соединений.
9.Характеристика и селективность абсорбентов.
10.Суть адсорбционных методов очистки газов.
11.Каталитические методы очистки газов.
12.Методы контроля и приборы для измерения концентраций примесей в атмосфере.
152
6. БИОЛОГИЧЕСКАЯ ОЧИСТКА СТОЧНЫХ ВОД
Биотехнологию можно определить как совместное использование биохимии, микробиологии и химической технологии для промышленного применения полезных свойств микроорганизмов и культур тканей.
Экологическая биотехнология - это специфическое применение биотехнологии для решения проблем защиты и восстановления окружающей среды.
К сфере экологической биотехнологии могут быть отнесены следующие основные направления природоохранной деятельности:
-аэробная и анаэробная биоочистка и стабилизация сточных вод;
-переработка твердых отходов, утилизация ила сточных вод;
-переработка отходов сельского хозяйства, биокомпостирование;
-разложение галогенорганических загрязнений окружающей среды, генная инженерия;
-использование микроорганизмов в качестве гербицидов и биопестицидов;
-получение металлов методом «бактериального выщелачивания» сульфидных минералов.
6.1. ЦЕЛЬ РАБОТЫ
Ознакомление с основными направлениями экологической биотехнологии и экспериментальное изучение практического использования свойств микроорганизмов в природоохранной деятельности человека.
6.2.ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
6.2.1.Биологическая очистка сточных вод
Биологическая очистка - это широко применяемый на практике метод очистки производственных и бытовых стоков с помощью микроорганизмов - минерализаторов, которые используют органические вещества в процессе своей жизнедеятельности. Сообщества этих микроорганизмов сформировались в окружающей среде в процессе длительной эволюции и являются важнейшими элементами экологических систем. Они включают множество различных бактерий, простейших и ряд более высокоорганизованных организмов - водорослей, грибов и т. д., связанных между собой в единый комплекс сложными взаимоотношениями (метабиоза, симбиоза и антагонизма).
Для биологической очистки сточных вод используются два типа процессов:
1) аэробные процессы, в которых микроорганизмы используют кислород, растворенный в сточных водах;
153
2)анаэробные процессы, в которых микроорганизмы не имеют доступа ни к свободному растворенному кислороду, ни к другим акцепторам электронов, таким как нитрат-ион. В этих условиях, в качестве акцептора электронов микроорганизмы используют углерод, входящий в состав органических молекул.
Аэробная очистка сточных вод с точки зрения экологической биотехнологии наиболее важна для очистки и стабилизации сточных вод. Для этой цели существует много различных конструкций реакторов, но в общем они разделяются на два основных типа: гомогенные реакторы (аэротенки, циркуляционные окислительные каналы) и реакторы, в которых неподвижная биопленка нанесена на инертный материал (биофильтры). В процессах с активным илом загрязнения в очищаемых стоках окисляются взвешенными бактериальными флокулами, а в биофильтрах загрязнения окисляются в биопленке, образуемой бактериями, прикрепленными к твердой насадке.
Впростейшем случае процесс очистки состоит из двух стадий: взаимодействие отфильтрованных (отстоявшихся) стоков с воздухом и частицами активного ила в аэротенке и отделения очищенной жидкости от частиц активного ила в отстойнике. Из отстойника удаляют большую часть свободной от твердых частиц надыловой жидкости, а активный ил возвращается в аэротенк. Частицы активного ила представляют собой флокулированную смесь бактерий и простейших.
Применительно к илу термин «активный» значит, что биомасса:
1)представляет собой микрофлору, содержащую все ферменты системы, необходимые для деградации загрязнений, которые следует удалить;
2)имеет поверхность с сильной адсорбционной способностью;
3)способна образовывать стабильные флокулы, которые легко осаждаются при отстаивании.
Вактивном иле идентифицированы бактерии множества различных видов, среди которых можно выделить только три основные группы:
углеродокисляющие флокулообразующие бактерии, углеродокисляющие нитчатые бактерии, бактерии - нитрификаторы. Флокулообразователи необходимы не только для деградации, но и для образования стабильных флокул, которые способны быстро осаждаться с образованием плотного ила
вотстойнике. Нитрификаторы превращают аммонийный азот в нитраты:
NH3 |
+O2 |
Nitrosomonas |
|
- |
; |
→NO |
2 |
||||
- |
+O2 |
NitroBacter |
- |
|
|
NO2 |
→NO3. |
|
|
||
Простейшие потребляют бактерии и обеспечивают низкую мутность выходных стоков. Всего было идентифицировано около 200 видов
154
