
- •Конспект лекций для подготовки по направлению
- •220700 Автоматизация технологических процессов и производств
- •1. Введение
- •2.2. Горение оксида углерода(II) и водорода
- •2.4. Горение твердого углерода
- •3. Диссоциация и образование химических соединений
- •Рассмотрим вопрос на примере диссоциации оксида Ме(II) по реакции
- •В качестве примера рассмотрим влияние плавления Ме и МеО на упругость диссоциации МеО.
- •3.3. Диссоциация оксидов и сульфидов, образующих растворы
- •Из выражения (18) находим , проводим преобразования полученной зависимости с учетом закона Генри и ее анализ.
- •3.4. Механизм и кинетика диссоциации соединений
- •4.1. Окисление твердых сульфидов Термодинамика процесса
- •Кинетика окисления твердых сульфидов
- •4.2. Взаимодействие сульфидов с оксидами
- •5. Процессы восстановления оксидов металлов
- •5.1. Газовое восстановление свободных оксидов нелетучих металлов
- •5.2. Газовое восстановление оксида летучего металла
- •5.3. Газовое восстановление оксида металла из расплава
- •6. Металлургические расплавы
- •7. Потери цветных металлов со шлаками
- •7.1. Электрохимические потери
- •7.2. Механические потери цветных металлов со шлаками
- •8. Процессы, основанные на ликвации, испарении и конденсации
- •8.1. Ликвационные процессы
- •8.2. Процессы, основанные на испарении и конденсации
- •9. Выщелачивание
- •10.1. Основы экстракционных процессов
- •10.2. Основы ионообменных процессов
- •10.3. Выделение металлов из растворов в виде труднорастворимых соединений
- •10.4. Выделение металлов из водных растворов водородом.
- •10.5. Выделение металлов цементацией
- •10.6. Основы процессов кристаллизации из растворов
- •11. Электролиз водных растворов
- •Рекомендательный библиографический список
- •Содержание
2.2. Горение оксида углерода(II) и водорода
Большое практическое значение реакций горения СО и Н2 обусловлено тем, что обе эти реакции имеют место в различных восстановительных процессах.
Уравнения реакций горения СО и Н2*:
2СО(г) + О2(г) 2СО2(г) +566,3 кДж (1)
2Н2(г) + О2(г) 2Н2О(г) + 484 кДж (2)
Как видно, обе реакции характеризуются большим положительным тепловым эффектом. Любое термодинамическое состояние каждой из рассматриваемых систем можно охарактеризовать заданием пяти величин: температуры (Т), общего давления (Р) и парциального давления ее составляющих; соответственно РСО, РСО2, РО2 для реакции (1) и РН2, РН2О, РО2 для реакции (2).
Рассматривая влияние температуры и давления на равновесие реакций (1) и (2), обратимся только к реакции (1), поскольку реакция (2) аналогична первой.
Поскольку Р = РСО + РСО2 + РО2 (3), то только 4 из 5 величин являются независимыми. В состоянии химического равновесия их число в соответствии с правилом фаз Гиббса уменьшается до трех: (С = К – Ф + 2;С = 2 – 1 + 2 = 3). Вторым уравнением (помимо (3)), связывающим независимые переменные, является закон действующих масс, согласно которому константу равновесия реакции (1) можно записать в следующей форме:
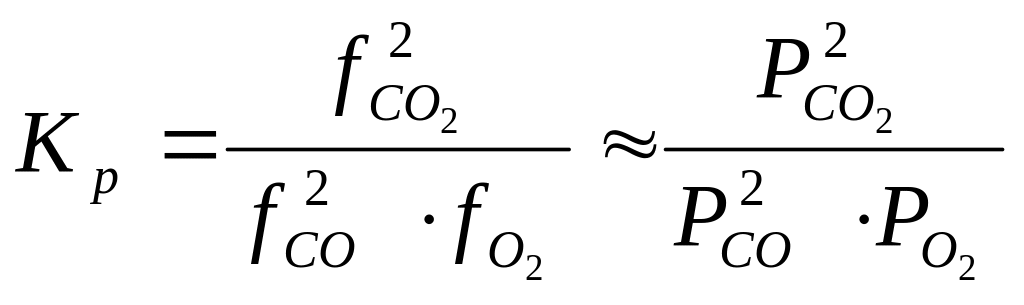 (5)
(5)
где f – фугитивности (или летучести) веществ, а Р – их парциальные давления. Отношение f/P = называется коэффициентом активности или коэффициентом летучести газа.
Для не слишком больших давлений и высоких температур fP, поэтому в дальнейшем будем пользоваться только зависимостью Кр от парциальных давлений веществ. Отметим, что Кр является только функцией температуры и природы рассматриваемых веществ Кр = f(Т).
Качественно влияние температуры и давления на равновесие реакций (1) и (2) можно установить, пользуясь принципом Ле-Шателье. Обе реакции экзотермичны, а значит, с повышением температуры их равновесие будет смещаться в левую сторону. Это же вытекает и из уравнения изобары реакции, согласно которому
![]() .
.
Так
как Н
0, то и
![]()
0, т.е. Кр
является убывающей функцией с повышением
температуры.
0, т.е. Кр
является убывающей функцией с повышением
температуры.
Для количественной оценки влияния температуры на равновесие реакций (1) и (2) воспользуемся уравнением, связывающим Кр с энергией Гиббса (Gт o):
Goт = -RTlnKp (6)
Приближенно Goт реакций можно рассчитать, используя справочные величины Нo298 и So298 для участников реакций, по уравнению:
Goт = Нo298 - ТSo298 (7)
В таблице 1 приведены результаты расчетов Goт реакций (1) и (2) для 300-1500оС, из которых видно, что равновесие обеих реакций сильно смещено в правую сторону. При температурах выше 700оС водород является более сильным восстановителем, чем СО [Goт реакции (2) меньше, чем реакции (1)].
Таблица 1
Энергия Гиббса (GоТ) некоторых реакций при различных температурах
№ п.п |
Реакция |
GоТ, кДж/моль при t,оС |
||||||
300 |
500 |
700 |
900 |
1100 |
1300 |
1500 |
||
1 |
2СО(г) + О2(г) 2СО(г) |
-467,3 |
-432,7 |
-398,1 |
-363,5 |
-328,9 |
-294,4 |
-259.8 |
2 |
2Н2 (г) + О2(г) 2Н2О(г) |
-433,1 |
-415,3 |
-397,6 |
-379,8 |
-362,0 |
-344,3 |
-326,5 |
3 |
½ S2(г) + О2(г) 2SО2 (г) |
- |
-306,0 |
-291,8 |
-277,6 |
-263,4 |
-249,2 |
-235,0 |
4 |
1/3 S2(г) + О2(г) 2/3SО3 (г) |
- |
221,6 |
-199,6 |
-177,6 |
-155,6 |
-133,6 |
-111,6 |
5 |
2 SО2(г) + О2(г) 2SО3 (г) |
-90,4 |
-52,9 |
-15,5 |
+22,0 |
+59,4 |
+96,9 |
+134,3 |
6 |
С(т) + О2(г) СО2(г) |
-395,4 |
-396,0 |
-396,6 |
-397,2 |
-397,8 |
-398,3 |
-398,9 |
7 |
2С(т) + О2(г) 2СО2(г) |
-323,6 |
-359,4 |
-395,1 |
-430,8 |
-466,6 |
-502,3 |
-538,1 |
8 |
2СО2(г) + С(т) 2СО(г) |
+72,1 |
+37,0 |
+1,9 |
-33,2 |
-68,3 |
-103,4 |
-138,5 |
После расчета константы равновесия реакции (1) при какой-то температуре можно сделать расчет равновесного состава газовой смеси для заданного исходного состава и общего давления (Р). Пусть исходная газовая смесь содержит соответственно а, в и с молей СО2, СО и О2. Положим далее, что в состоянии равновесия число молей СО2 уменьшилось на х. Дальнейшие расчеты проведем, используя таблицу.
|
СО2 |
СО |
О2 |
Исходное число молей |
а |
в |
с |
Равновесное число молей |
а-х |
в+х |
с+0,5 х |
Общее число молей в состоянии равновесия |
а-х+в+х+с+0,5х = (а+в+с+0,5х) |
||
Парциальное давление, ат |
|
|
|
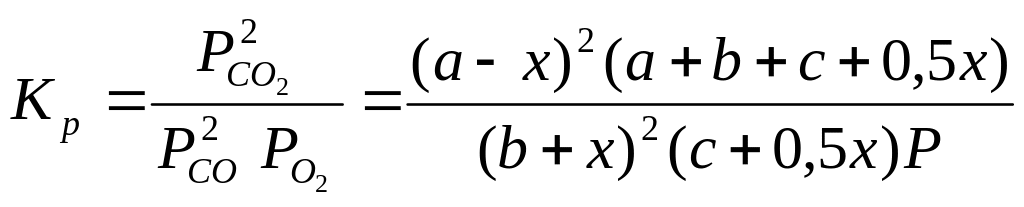
Рассмотреть влияние температуры на степень диссоциации СО2 и Н2О. Как это нужно учитывать при расчетах горения топлива и в технологических процессах.
2.3. Рассмотреть подобным же образом равновесие газовых реакций в системе сера-кислород при температурах 500-1500оС (температура кипения серы 445оС). Энергии Гиббса реакций этой системы приведены в таблице 1.
