
- •Конспект лекций для подготовки по направлению
- •220700 Автоматизация технологических процессов и производств
- •1. Введение
- •2.2. Горение оксида углерода(II) и водорода
- •2.4. Горение твердого углерода
- •3. Диссоциация и образование химических соединений
- •Рассмотрим вопрос на примере диссоциации оксида Ме(II) по реакции
- •В качестве примера рассмотрим влияние плавления Ме и МеО на упругость диссоциации МеО.
- •3.3. Диссоциация оксидов и сульфидов, образующих растворы
- •Из выражения (18) находим , проводим преобразования полученной зависимости с учетом закона Генри и ее анализ.
- •3.4. Механизм и кинетика диссоциации соединений
- •4.1. Окисление твердых сульфидов Термодинамика процесса
- •Кинетика окисления твердых сульфидов
- •4.2. Взаимодействие сульфидов с оксидами
- •5. Процессы восстановления оксидов металлов
- •5.1. Газовое восстановление свободных оксидов нелетучих металлов
- •5.2. Газовое восстановление оксида летучего металла
- •5.3. Газовое восстановление оксида металла из расплава
- •6. Металлургические расплавы
- •7. Потери цветных металлов со шлаками
- •7.1. Электрохимические потери
- •7.2. Механические потери цветных металлов со шлаками
- •8. Процессы, основанные на ликвации, испарении и конденсации
- •8.1. Ликвационные процессы
- •8.2. Процессы, основанные на испарении и конденсации
- •9. Выщелачивание
- •10.1. Основы экстракционных процессов
- •10.2. Основы ионообменных процессов
- •10.3. Выделение металлов из растворов в виде труднорастворимых соединений
- •10.4. Выделение металлов из водных растворов водородом.
- •10.5. Выделение металлов цементацией
- •10.6. Основы процессов кристаллизации из растворов
- •11. Электролиз водных растворов
- •Рекомендательный библиографический список
- •Содержание
В качестве примера рассмотрим влияние плавления Ме и МеО на упругость диссоциации МеО.
Напишем три реакции:
2МеО(т) 2Ме(г) + О2(г) (14)
2МеО(т) 2Ме(ж) + О2(г) (15)
2МеО(ж) 2Ме(т) + О2(г) (16)
Все реакции эндотермические, но на их тепловой эффект влияет плавление Ме или МеО. Влияние фазовых превращений на диссоциации МеО проанализируем, используя уравнение изобары реакции:
![]() .
.
Графически это влияние иллюстрируется рис.2.
3.3. Диссоциация оксидов и сульфидов, образующих растворы
Если соединение и металл образуют друг с другом или с посторонним инертным веществом растворы, то упругость диссоциации соединения будет уже функцией не только температуры, но и состава конденсированной фаза (она будет одна)
= f(T, N), где NMeO + NMe = 1.
Уравнение реакции диссоциации оксида Ме(II) в системе двух несмешивающихся фаз: 2(МеО) 2[Me] + O2 (17)
Константа равновесия реакции (17)
К = {[PMe] 2. }/(PMeO)2, (18)
где PMe и PMeO – равновесные парциальные давления Ме и МеО в системе при температуре Т.
Из выражения (18) находим , проводим преобразования полученной зависимости с учетом закона Генри и ее анализ.
3.4. Механизм и кинетика диссоциации соединений
Реакции диссоциации соединений в твердом состоянии принадлежат к классу топохимических реакций, сопровождающихся кристаллохимическими превращениями в твердом теле по схеме:
твердое тело I твердое тело II + газ.
При прямом течении, т.е. вправо, процесс диссоциации проходит как минимум через следующие стадии: собственно диссоциацию, сопровождающуюся появлением в поверхностном слое адсорбированных молекул газа и образованием твердых растворов Ме-МеХ в соединениях; зарождение новой фазы и кристаллохимическое превращение на границе раздела; десорбцию и диффузию газовых молекул.
В исследовательских работах кинетические закономерности топохимических реакций нередко принято выражать графически в системе координат степень превращения вещества (или скорость превращения) – время. При этом возможны два вида кинетических кривых в зависимости от наличия или отсутствия индукционного периода.
4. ОКИСЛЕНИЕ СУЛЬФИДОВ.
ВЗАИМОДЕЙСТВИЕ СУЛЬФИДОВ С ОКСИДАМИ
В производстве меди, никеля, свинца и цинка одним из основных видов сырья являются сульфидные руды и получаемые при их обогащении концентраты. В ходе металлургической переработки такого сырья на металл из него удаляется вся сера и др. примеси. Удаление серы осуществляется главным образом путем окисления сульфидов кислородом воздуха при обжиге и плавках. Окисление сульфидов металлов идет как при нахождении их в твердом, так и в жидком состоянии.
4.1. Окисление твердых сульфидов Термодинамика процесса
В общем виде взаимодействие сульфида двухвалентного металла может проходить по следующим схемам:
MeS + 2O2 = MeSO4 + Q (19)
MeS + 1½ O2 = MeO + SO2 + Q (20)
MeS + O2 = Me + SO2 + Q (21)
Эти реакции можно рассматривать и как первичные реакции взаимодействия MeS с О2, так и как реакции, определяющие конечный результат этого процесса. Помимо реакций (19-21) в газовой фазе возможна реакция
2SO2 + O2 2SO3 + Q (22)
а образующийся SO3 может взаимодействовать с МеО с получением вторичных сульфатов по реакции
МеО + SO3 MeSO4 (23)
Дл суждения о возможном порядке протекания реакций (19-21) можно использовать данные о величинах Gо реакций окисления некоторых сульфидов (табл.2).
Таблица 2
Энергия Гиббса реакций окисления ряда сульфидов металлов
№ п.п |
Реакция |
GоТ, кДж/моль при t,оС |
|||
500 |
700 |
900 |
1100 |
||
1 |
½ ZnS + O2 = ½ ZnSO4 |
-250,5 |
-214,7 |
-179 |
-161,1 |
2 |
2/3 ZnS + O2 = 2/3 ZnO + 2/3 SO2 |
-256,6 |
-246,8 |
-237 |
-232,1 |
3 |
ZnS + O2 = Zn + SO2 |
-110,5 |
-117,5 |
-124,4 |
-137 |
4 |
½ PbS + O2 = ½ PbSO4 |
-273,9 |
-238,6 |
-209,3 |
- |
5 |
2/3 PbS + O2 = 2/3 PbO + 2/3 SO2 |
-234 |
-223 |
-213 |
- |
6 |
PbS + O2 = Pb + SO2 |
-210,8 |
-215,7 |
-220,6 |
-223,1 |
7 |
2/3 Cu2S + O2 = 2/3 Cu2О + 2/3 SO2 |
-208 |
-192 |
- |
- |
8 |
2/3 FeS + O2 = 2/3 FeO + 2/3 SO2 |
-244 |
-231 |
- |
- |
О
влиянии температуры на реакции (22) и
(23) и возможности разложения или
образования MeSO4
по реакции (23) можно судить по соотношению
![]() в газовой фазе (
в газовой фазе (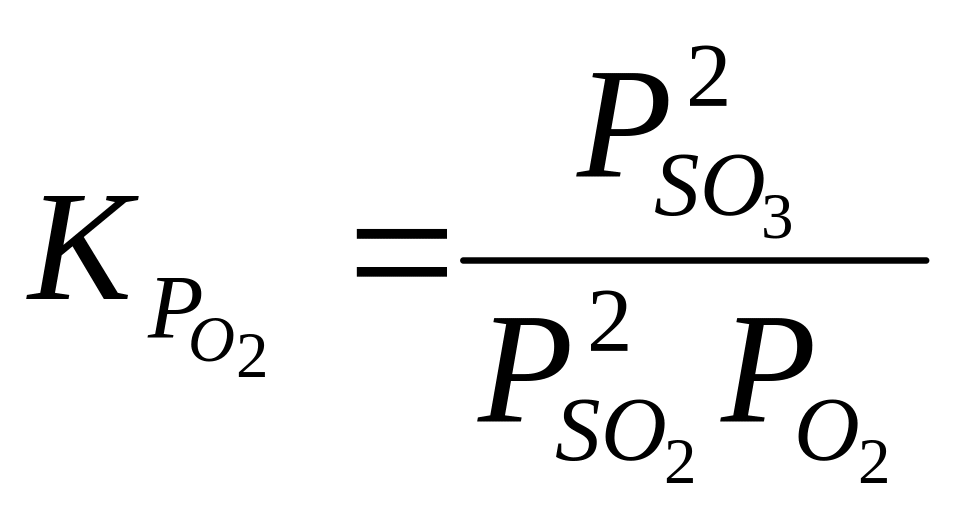 ,
откуда
,
откуда
![]() )
и упругости диссоциации сульфата
)
и упругости диссоциации сульфата
![]()
![]() .
.
Если
![]()
![]() ,
то реакция (23) может протекать в правую
сторону, и наоборот, при
.
Условия равновесия в системе Me-S-O
можно рассмотреть также с использованием
потенциальных диаграмм фазовых
равновесий.
,
то реакция (23) может протекать в правую
сторону, и наоборот, при
.
Условия равновесия в системе Me-S-O
можно рассмотреть также с использованием
потенциальных диаграмм фазовых
равновесий.
