
- •Конспект лекций для подготовки по направлению
- •220700 Автоматизация технологических процессов и производств
- •1. Введение
- •2.2. Горение оксида углерода(II) и водорода
- •2.4. Горение твердого углерода
- •3. Диссоциация и образование химических соединений
- •Рассмотрим вопрос на примере диссоциации оксида Ме(II) по реакции
- •В качестве примера рассмотрим влияние плавления Ме и МеО на упругость диссоциации МеО.
- •3.3. Диссоциация оксидов и сульфидов, образующих растворы
- •Из выражения (18) находим , проводим преобразования полученной зависимости с учетом закона Генри и ее анализ.
- •3.4. Механизм и кинетика диссоциации соединений
- •4.1. Окисление твердых сульфидов Термодинамика процесса
- •Кинетика окисления твердых сульфидов
- •4.2. Взаимодействие сульфидов с оксидами
- •5. Процессы восстановления оксидов металлов
- •5.1. Газовое восстановление свободных оксидов нелетучих металлов
- •5.2. Газовое восстановление оксида летучего металла
- •5.3. Газовое восстановление оксида металла из расплава
- •6. Металлургические расплавы
- •7. Потери цветных металлов со шлаками
- •7.1. Электрохимические потери
- •7.2. Механические потери цветных металлов со шлаками
- •8. Процессы, основанные на ликвации, испарении и конденсации
- •8.1. Ликвационные процессы
- •8.2. Процессы, основанные на испарении и конденсации
- •9. Выщелачивание
- •10.1. Основы экстракционных процессов
- •10.2. Основы ионообменных процессов
- •10.3. Выделение металлов из растворов в виде труднорастворимых соединений
- •10.4. Выделение металлов из водных растворов водородом.
- •10.5. Выделение металлов цементацией
- •10.6. Основы процессов кристаллизации из растворов
- •11. Электролиз водных растворов
- •Рекомендательный библиографический список
- •Содержание
2.4. Горение твердого углерода
Твердый углерод является основной составляющей твердых видов топлива (каменного угля, кокса и др.), используемых в практике металлургического производства и как источник энергии, и как восстановитель. Принципиально в системе углерод-кислород возможно протекание четырех реакций:
С(т) + О2(г) СО2(г) + 393,8 кДж (8)
2С(т) + О2(г) 2СО(г) + 221,2 кДж (9)
2СО(г) + О2(г) 2СО2(г) +566,3 кДж (10)
СО2(г) + С(т) 2СО(г) – 172,6 кДж (11)
Поскольку активность твердого С можно считать = 1, то константы равновесия этих реакций можно записать через парциальные давления газообразных участников реакций, т.е. для реакции (8)
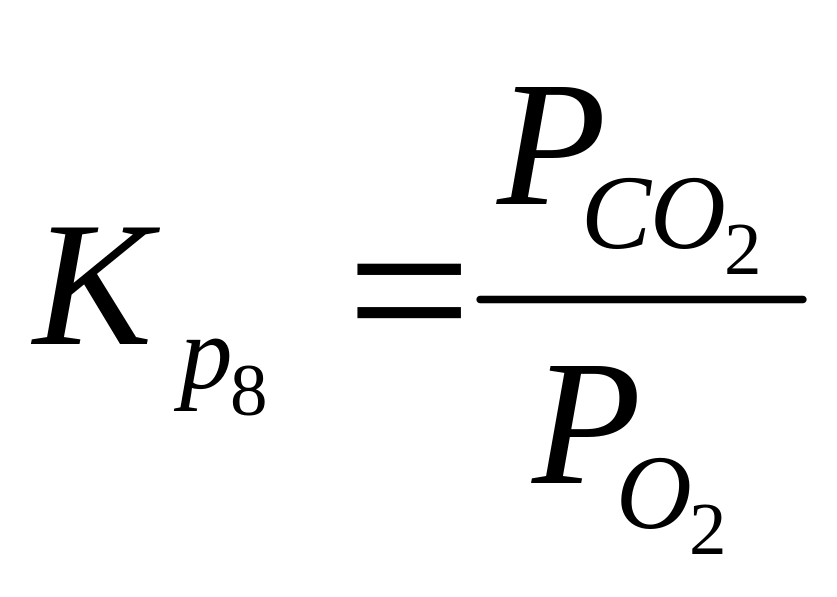 и
т.д.
и
т.д.
Значения энергии Гиббса этих реакций приведены в таблице 1. На основании тепловых эффектов данных реакций и величин Gо рассмотреть влияние температуры на их равновесие для двух случаев:
горение углерода в газообразном кислороде – можно рассматривать только реакции (8) и (9);
взаимодействие углерода с СО2 – реакция (11).
Равновесный состав газовой смеси для реакции (11) в зависимости от температуры:
t, оС
|
327 |
427 |
527 |
627 |
727 |
828 |
927 |
Содержание СО, % по объему от СО, СО2 |
~ 0,0 |
2,3 |
12,1 |
38,4 |
73,2 |
91,6 |
98,0 |
Построить по этим данным графическую зависимость и дать анализ влияния давления на равновесие реакций (8-11).
3. Диссоциация и образование химических соединений
Как уже отмечалось, исходным сырьем для производства металлов являются руды, концентраты и др. материалы, в которых металлы обычно находятся в виде химических соединений: оксидов, сульфидов, карбонатов и др. Простейшей химической реакцией для извлечения металлов из этих соединений может быть реакция их термической диссоциации (обратная ей реакция образования соединений):
МеХ Ме + Х,
где Ме – металл; Х – анион.
При
внешнем давлении Р = 105
Па в условиях изолированной системы
Ме-Х константу равновесия этой реакции
можно записать в виде Кр
=
![]() .
.
Так как реакция эндотермична, то повышение температуры будет смещать ее равновесие в правую сторону.
3.1. Диссоциация соединений с образованием конденсированных фаз
постоянного состава
Рассмотрим вопрос на примере диссоциации оксида Ме(II) по реакции
2МеО 2Ме + О2 (12)
В соответствии с правилом фаз число степеней свободы такой системы
С = К-Ф+ 2 = 2-3+2 = 1, т.е. мы имеем только один независимый параметр. В термодинамике состояние системы описывается, как правило, параметрами Р и Т. Из них в нашем случае независим только один. Чаще всего независимой принимают температуру.
В общем виде константа равновесия реакции (12)
Кр
=
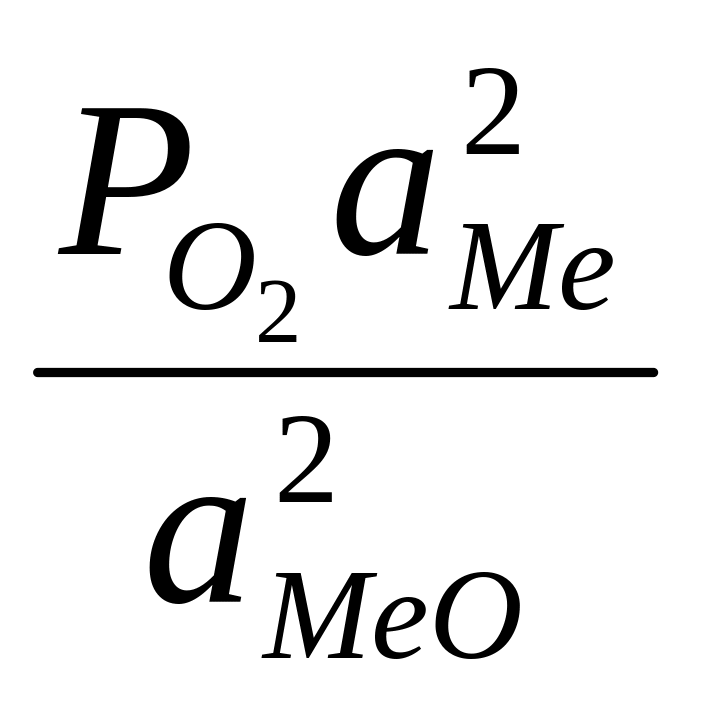 (13)
(13)
Если
Ме и МеО находятся в конденсированном
состоянии, то аМе
и аМеО
можно считать постоянным и тогда Кр
=
![]() и Робщ
=
= f(Т).
Графически зависимость
= f(Т)
выражается логарифмической кривой,
делящей плоскость диаграммы на две
области.
и Робщ
=
= f(Т).
Графически зависимость
= f(Т)
выражается логарифмической кривой,
делящей плоскость диаграммы на две
области.
Равновесное давление диссоциации оксидов при заданной температуре принято называть их упругостью диссоциации. Это же относится к сульфидам, хлоридам и др. веществам. Упругость диссоциации вещества служит важной мерой оценки его прочности. На рис.1 приведена зависимость давлений диссоциации некоторых оксидов от температуры.
Для оценки прочности соединения используют также диаграммы зависимости lgP = f(T) и G = f(T).
3.2. Влияние агрегатных превращений на процесс диссоциации
соединений металлов
