
- •Конспект лекций для подготовки по направлению
- •220700 Автоматизация технологических процессов и производств
- •1. Введение
- •2.2. Горение оксида углерода(II) и водорода
- •2.4. Горение твердого углерода
- •3. Диссоциация и образование химических соединений
- •Рассмотрим вопрос на примере диссоциации оксида Ме(II) по реакции
- •В качестве примера рассмотрим влияние плавления Ме и МеО на упругость диссоциации МеО.
- •3.3. Диссоциация оксидов и сульфидов, образующих растворы
- •Из выражения (18) находим , проводим преобразования полученной зависимости с учетом закона Генри и ее анализ.
- •3.4. Механизм и кинетика диссоциации соединений
- •4.1. Окисление твердых сульфидов Термодинамика процесса
- •Кинетика окисления твердых сульфидов
- •4.2. Взаимодействие сульфидов с оксидами
- •5. Процессы восстановления оксидов металлов
- •5.1. Газовое восстановление свободных оксидов нелетучих металлов
- •5.2. Газовое восстановление оксида летучего металла
- •5.3. Газовое восстановление оксида металла из расплава
- •6. Металлургические расплавы
- •7. Потери цветных металлов со шлаками
- •7.1. Электрохимические потери
- •7.2. Механические потери цветных металлов со шлаками
- •8. Процессы, основанные на ликвации, испарении и конденсации
- •8.1. Ликвационные процессы
- •8.2. Процессы, основанные на испарении и конденсации
- •9. Выщелачивание
- •10.1. Основы экстракционных процессов
- •10.2. Основы ионообменных процессов
- •10.3. Выделение металлов из растворов в виде труднорастворимых соединений
- •10.4. Выделение металлов из водных растворов водородом.
- •10.5. Выделение металлов цементацией
- •10.6. Основы процессов кристаллизации из растворов
- •11. Электролиз водных растворов
- •Рекомендательный библиографический список
- •Содержание
5.1. Газовое восстановление свободных оксидов нелетучих металлов
Рассмотрим термодинамику реакций восстановления МеО с использованием СО и Н2:
МеО + СО(г) Ме + СО2 (30)
МеО + Н2 (г) Ме + Н2О (31)
Константа равновесия реакций
![]() и
и
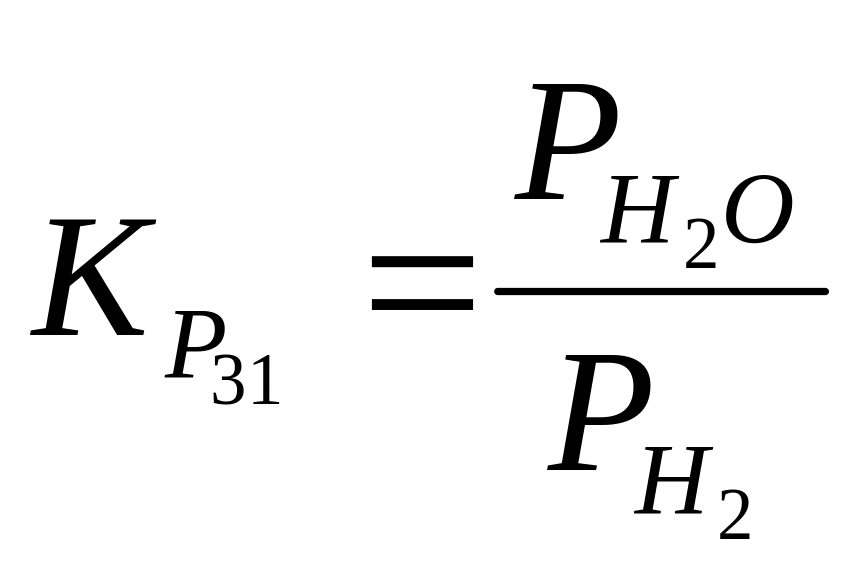 (32)
(32)
Поскольку реакции аналогичны, то более детально рассмотрим лишь реакцию (30).
Согласно правилу фаз число степеней свободы в данной трехкомпонентной и трехфазной системе С = 3-3+2 = 2. Так как обычно процессы восстановления протекают с давлением, близким к атмосферному, да к тому же реакции (30) и (31) протекают без изменения давления. то Р можно считать постоянным и равным 1. Тогда остается одна степень свободы. Удобнее всего принять в качестве независимой переменной температуру, а две другие переменные величины (РСО и РСО2) рассчитать, используя в качестве еще одного уравнения РСО + РСО2=1.
Сравнение восстановимости различных оксидов по реакции (30) удобнее пояснить с использованием рис.3.
5.2. Газовое восстановление оксида летучего металла
Реакция восстановления МеО оксидом углерода (II) для этого случая:
МеО + СОг Мег + СО2 г (33)
Константа равновесия реакции
![]() (34)
(34)
Общее давление в системе Робщ =
РМе +
![]() +
РСО (35).
+
РСО (35).
Для расчета величин парциальных давлений кроме двух уравнений (34) и (35) нужно еще одно уравнение, и оно вытекает из уравнения реакции (33) РМе =
В качестве примера реакций типа (33) на рис.4 нанесена равновесная кривая восстановимости ZnO. Температура кипения цинка 906оС. При снижении общего давления и разбавлении газовой фазы инертным газом равновесие реакции (33) будет смещаться вправо.
5.3. Газовое восстановление оксида металла из расплава
Рассмотрим случай, когда оксид металла находится в расплаве других оксидов (шлаке) и образующийся металл тоже находится в виде раствора в другом металле или сульфиде. Реакция восстановления:
( Ме0) + СО Ме + СО2 (36)
Константа равновесия реакции:
Кр
=
![]() ,
откуда
,
откуда
![]() =
=
![]() (37)
(37)
Из выражения (37) видно, что равновесный состав газовой фазы для реакции (36), будет зависеть не только от температуры, но и активности (содержания) Ме в МеО в своих фазах. Пояснить это на примере восстановления некоторых оксидов Ме по рис.4.
5.4. Восстановление оксидов металлов твердым углеродом.
Восстановление оксидов металлов твердым углеродом можно рассматривать как двухстадийный процесс, состоящий из следующих реакций:
МеО + СО Ме + СО2 (38)
+
СО2 + С 2СО (39)
МеО + С Ме + СО (40)
При таком рассмотрении мы имеем дело с совмещением равновесия двух реакций (38 ) и (39). Рассматриваемая система 3-х компанентная и 4-х фазная и согласно правилу фаз имеет одну степень свободы (С=3-4+2=1). Заданная температура будет однозначно определять общее давление и содержание СО и СО2 в системе. Аналитическое решение данной задачи сводится к решению системы из 3-х уравнений:
К38
=
![]() =
(т);
К39 =
=
(т);
К39 =
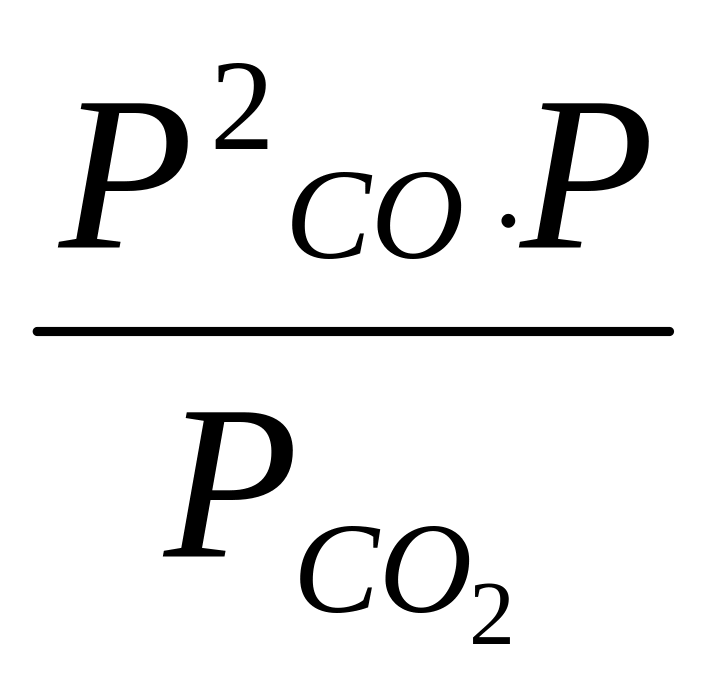 =
(т);
РСО
+
=
(т);
РСО
+![]() =Р
=Р
Если
РСО +
![]() =
Р=1, то
=
Р=1, то
![]() =
=
![]()
Для рассмотрения термодинамики взаимодействия МеО с С удобно использовать графический метод, для чего на рис.4 нанести кривые, соответствующие реакциям (38) и (39). Отметить, что реакция (40) реагирует на изменение давления в системе.
