
Біологічна та біоорганічна хімія_Мардашко О.О._ изд. 2008-342 с._ОНМедУ-2012
.pdf
CH3 |
δ + δ - |
CH3 |
|
CH3 |
CH3 |
|||||||
|
|
|
|
|
|
|
|
|
|
|||
H |
C |
|
O |
|
C O |
|
C |
|
O |
C |
|
O |
|
|
|
|
|
||||||||
|
|
|
H3C |
|
|
|
|
|
H3C |
|||
|
|
|
|
H3C |
|
CH2 |
CH |
|||||
|
|
|
|
|
||||||||
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
H3C |
||
Іонний механізм спостерігається, як правило, при розриві полярного ковалентного зв’язку (Карбон-Хлор, Карбон-Оксиген).
Характеристика нуклеофілів і електрофілів
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Органічні іони вступають у подальші пере- |
|||||||||||||
|
зменшення реактивної здатності |
||||||||||||||||||||||||||||
|
творення. При цьому катіони взаємодіють із нук- |
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
леофільними («що люблять ядра») частинками |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(Н2О, NН3, Cl-, Br-, I-, інші аніони кислот тощо), |
|||||||||||||
Класифікація реакцій за спрямованістю |
а органічні аніони — з електрофільними («що |
||||||||||||||||||||||||||||
та результатом. Класифікація реакцій |
люблять електрони») частинками (Н+, катіони |
||||||||||||||||||||||||||||
за механізмом |
|
|
|
|
|
|
|
металів, галогени та ін.). |
|
||||||||||||||||||||
Реакцію можна класифікувати залежно від |
Нуклеофільна частинка (нуклеофіл, N) — це |
||||||||||||||||||||||||||||
частинка, яка має пару електронів на зовніш- |
|||||||||||||||||||||||||||||
того, у скількох молекулах змінюється стан кова- |
ньому електронному рівні. За рахунок цієї пари |
||||||||||||||||||||||||||||
лентних зв’язків під час визначальної кінетики, |
електронів нуклеофіл здатний утворювати новий |
||||||||||||||||||||||||||||
тобто найповільнішої стадії реакції. При такому |
ковалентний зв’язок. |
|
|
|
|
|
|
|
|
||||||||||||||||||||
підході розрізняють реакції мономолекулярні, |
Електрофільна частинка (електрофіл, Е) — це |
||||||||||||||||||||||||||||
бімолекулярні, тримолекулярні, полімолекулярні. |
частинка, яка має незаповнений валентний елек- |
||||||||||||||||||||||||||||
До мономолекулярних реакцій належать ре- |
тронний рівень. Електрофіл надає заповнені ва- |
||||||||||||||||||||||||||||
акції дециклізації, дисоціації, внутрішньомолеку- |
кантні орбіталі для утворення ковалентного |
||||||||||||||||||||||||||||
лярні перегрупування. |
|
|
|
|
|
|
|
зв’язку за рахунок електронів тієї частинки, з |
|||||||||||||||||||||
Бімолекулярні реакції є найхарактернішими |
якою він взаємодіє. |
|
|
|
|
|
|
|
|
||||||||||||||||||||
для органічних сполук, перебігають у розчинах, |
За кінцевим результатом органічні реакції |
||||||||||||||||||||||||||||
допускають наявність двох компонентів у орга- |
поділяються таким чином: |
|
|||||||||||||||||||||||||||
нічній суміші: |
|
|
|
|
|
|
|
|
|
1. Реакції заміщення, S ( від англ. substitution). |
|||||||||||||||||||
|
СН3J + NaOH → |
CH3OH + NaJ |
2. Реакції приєднання, А (від англ. аddition). |
||||||||||||||||||||||||||
|
3. Реакції елімінування, Е (від англ. еlimi- |
||||||||||||||||||||||||||||
Речовину, що зазнала перетворення під час |
nation — відщеплення). |
|
|
|
|
|
|
|
|||||||||||||||||||||
перебігу хімічної реакції, називають субстратом. |
4. |
Реакції перегрупування. |
|
||||||||||||||||||||||||||
5. Окисно-відновні реакції. |
|
||||||||||||||||||||||||||||
Речовину, під дією якої відбувалася зміна в суб- |
|
||||||||||||||||||||||||||||
Враховуючи природу атакуючого реагенту, |
|||||||||||||||||||||||||||||
страті, називають реагентом. Перебіг реакції за- |
|||||||||||||||||||||||||||||
механізми реакції можуть бути такими: SR, SE, SN, |
|||||||||||||||||||||||||||||
лежить від природи субстрату і від природи реа- |
A , A . |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
генту. |
|
|
|
|
|
|
|
|
|
|
|
|
|
E |
N |
|
|
|
|
|
|
|
|
|
|
|
|||
Органічні реакції можна класифікувати і за |
Перебіг реакції залежить від типу ковалент- |
||||||||||||||||||||||||||||
них зв’язків, електронних ефектів у субстраті, |
|||||||||||||||||||||||||||||
механізмом розриву ковалентних зв’язків у реа- |
|||||||||||||||||||||||||||||
гуючих молекулах. Залежно від способів його |
природи атакуючої частинки, зовнішніх фак- |
||||||||||||||||||||||||||||
торів (hν , Р, Т). |
|
|
|
|
|
|
|
|
|||||||||||||||||||||
розриву і будується ця класифікація. |
У живих клітинах перебігає безліч фермента- |
||||||||||||||||||||||||||||
1. Якщо спільна електронна пара ділиться між |
|||||||||||||||||||||||||||||
тивних реакцій, об’єднаних загальним поняттям |
|||||||||||||||||||||||||||||
атомами, то утворюються радикали — частинки, |
|||||||||||||||||||||||||||||
що мають непарні електрони. Такий розрив |
метаболізм. В основі метаболічних шляхів лежить |
||||||||||||||||||||||||||||
зв’язку називається радикальним, |
або гомолітич- |
досить невелике коло хімічних реакцій, знання |
|||||||||||||||||||||||||||
ним: |
|
|
|
|
|
|
|
|
|
|
|
|
|
суті яких створює основу для раціонального при- |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
значення лікарських препаратів. Винятково важ- |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
А |
|
• |
|
Б |
→ |
А• + Б• |
|
А•, Б • — радикали (R) |
ливим є з’ясування молекулярних механізмів де- |
|||||||||||||||||||
|
|
• |
|
|
|
яких захворювань і значної кількості вроджених |
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
H |
|
|
|
|
|
H |
|
|
|
|
|
|
|
порушень метаболізму. |
|
|
|
|
|
|
|
|||||||
|
•• • |
• |
|
|
→ |
•• • |
H• |
H• |
— радикал Гідрогену |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
H • •C• |
• |
H |
H ••C•• + |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
H |
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
Електрофільне приєднання |
|
|||||||||||
|
Метан |
|
|
Радикал |
|
|
|
|
|
|
|
|
|
до ненасичених сполук (А ) |
|
||||||||||||||
|
|
|
|
|
|
|
метил |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Е |
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
2. Якщо при розриві зв’язку спільна електрон- |
Електронна хмара π -зв’язку алкену піддаєть- |
||||||||||||||||||||||||||||
ся атаці електрофільними реагентами. Тому вели- |
|||||||||||||||||||||||||||||
на пара залишається біля одного атома, то ут- |
ка кількість реакцій алкенів відбувається за ме- |
||||||||||||||||||||||||||||
ворюються іони — катіон та аніон. Такий ме- |
ханізмом електрофільного приєднання, який по- |
||||||||||||||||||||||||||||
ханізм розриву називається іонним, або гетеро- |
значається символом АЕ (від англ. |
аddition |
|||||||||||||||||||||||||||
літичним. |
|
|
|
|
|
→ |
|
|
|
|
|
|
|
electrophіlіc). Реакції електрофільного приєднан- |
|||||||||||||||
|
|
|
|
|
А |
• |
|
• - |
+ |
[Б] |
+ |
|
|
ня — це іонні процеси, які перебігають у кілька |
|||||||||||||||
|
|
|
|
|
• Б |
[А]• |
|
|
|
||||||||||||||||||||
|
Гетеролітичний |
аніон |
катіон |
стадій: |
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
розрив |
|
|
|
|
|
|
|
|
|
|
|
повільно |
|
H+ |
|
|||||||||||||
|
|
|
|
|
|
|
|
→ |
|
+ |
+ |
• |
|
- |
|
|
C C |
+ H+ |
|
|
|
C |
|
C |
|
|
|
C C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
CH3Cl |
CH3 |
•Cl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
хлористий |
метил- |
хлорид |
алкен |
(Е) |
π |
-комплекс карбкатіон |
||||||||||||||||||||||
|
|
метил |
|
катіон |
|
аніон |
|||||||||||||||||||||||
19
На першій стадії відбувається взаємодія елек- |
У вторинному карбкатіоні відбувається більш |
|||||||||||
трофільної частинки з електронною хмарою π - |
ефективне зниження позитивного заряду за ра- |
|||||||||||
зв’язку. Позитивно заряджена електрофільна час- |
хунок +І-ефекту двох алкільних груп. |
|||||||||||
тинка за рахунок електростатичного притягнен- |
Електрофільне заміщення |
|||||||||||
ня утворює з молекулою алкену π -комплекс. В |
||||||||||||
якості електрофіла найчастіше виступає протон |
в ароматичних сполуках (SЕ) |
|||||||||||
(Н+), джерелом якого є протонвмісні кислоти |
Арени вступають в іонні реакції, які перебіга- |
|||||||||||
НСl, НВr, H2SO4. Потім утворюється ковалент- |
||||||||||||
ють за механізмом електрофільного заміщення, |
||||||||||||
ний зв’язок між протоном та одним із атомів Кар- |
яке позначається символом SЕ (від англ. substi- |
|||||||||||
бону подвійного зв’язку, який отримує позитив- |
tution electrophіlіc). Реакція починається з виник- |
|||||||||||
ний заряд, і вся частинка стає карбкатіоном. |
нення π -комплексу, з якого потім утворюється σ - |
|||||||||||
Карбкатіон — це частинка з позитивним за- |
комплекс, та завершується стабілізацією σ -ком- |
|||||||||||
рядом на атомі Карбону. |
|
|
|
|
|
|
|
плексу за рахунок відщеплення протона. |
||||
На другій стадії процесу карбкатіон взає- |
||||||||||||
Утворення π -комплексу. На першій стадії елек- |
||||||||||||
модіє з аніоном Х- і утворює з ним σ -зв’язок за |
трофільна частинка притягується до π -електрон- |
|||||||||||
рахунок пари електронів аніона. |
|
|
|
|
|
|
|
ної хмари арену й утворює з ним комплекс. Аро- |
||||
|
|
|
|
|
|
|
|
|
|
|
||
|
швидко |
|
|
Н |
|
Х |
матична система при цьому не порушується. Ця |
|||||
|
|
|
|
стадія перебігає швидко. |
||||||||
C C + Х– |
|
|
|
|
|
|
|
|
|
|||
|
|
C |
|
C |
|
|
||||||
|
|
|
|
|
||||||||
(N)
Якщо початковий алкен несиметричний, тобто атоми Карбону при подвійному зв’язку відрізняються ступенем заміщення (наприклад, пропен СН3–СН=СН2), то із двох можливих продуктів реакції переважно утворюється тільки
один:
2-Бромпропан
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
CH |
|
|
CH2 |
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
HСНC |
|
|
CH |
|
CH + HBr |
|
|
|
|
|
Br |
H |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||
3 |
3 |
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
Пропен |
|
CH3 |
|
|
CH |
|
CH2 |
|
|
|
|
||||
|
|
|
|
||||
|
|
|
|
H |
|
Br |
|
1-Бромпропан (не утворюється)
Уцьому випадку напрямок реакції визначається закономірністю, встановленою російським хіміком В. В. Марковніковим (1869).
Правило Марковнікова: при приєднанні моле-
кул типу НХ (HCl, HBr, HOH) до несиметричних алкенів атом Гідрогену приєднується до більш гідрогенізованого атома Карбону подвійного зв’язку.
Такий напрямок реакції пояснюється двома факторами.
Устатичному, тобто нереагуючому, стані в несиметричному алкені під впливом замісника електронна щільність зміщується до одного з атомів Карбону:
|
|
δ + |
δ - |
|
|
δ - |
|
δ + |
|
CH3 |
|
CH |
|
CH2 |
Cl |
|
CH |
|
CH2 |
|
|
|
|
||||||
+І-ефект (–СН3)-група |
–І-ефект (СІ) |
||||||||
|
Пропен |
|
|
Хлоретен |
|||||
Упропені місцем атаки буде атом С-1 із частково негативним зарядом, який виникає під дією +І-ефекту метильної групи.
Удинамічному стані, тобто у процесі реакції, із двох можливих карбкатіонів буде утворювати-
ся більш стійкий вторинний карбкатіон.
|
|
|
|
Вторинний+карбкатіон |
||||||||||
|
δ + δ - |
|
|
CH3 |
|
CH |
|
|
CH3 |
|||||
|
+ |
|
|
|
|
|||||||||
|
Н+ |
|
|
|
|
|
|
|
|
|
|
|||
CH3 |
CH |
|
CH2 |
|
CH3 |
|
|
|
|
|
+ |
|||
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
CH2 |
|
|
|
CH2 |
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
Первинний карбкатіон |
||||||||||
H |
|
H |
δ + |
δ - |
|
+ CI2 |
AlCI3 |
Cl |
CI |
AlCI3 |
|
|
|
||||
Бензен (Арен) π -комплекс
Роль каталізатора (АlCl3, FeCl3) полягає в поляризації нейтральної молекули галогену з утворенням із неї електрофільної частинки:
Cl–Cl + AlCl3 |
|
|
|
|
ClCl3+[AlCl4]– |
|||||
|
|
|
|
|||||||
|
|
|
||||||||
|
H |
δ + |
δ - |
|
|
|
|
H |
||
|
|
|
|
|
|
+ CI + |
||||
|
|
Cl |
|
CI |
AlCI3 |
|
|
|||
|
|
|
|
|
||||||
π -комплекс |
Карбкатіон (σ -комплекс) |
||||||
|
|
|
|
|
|
||
+ |
|
|
- |
|
|
ClHI |
|
AlCI |
4 |
|
|
+HCI + AlCI |
|||
|
|
||||||
|
|
|
|
3 |
|||
Комплекс- |
Хлор- |
||||||
ний аніон |
бензен |
||||||
Утворення σ -комплексу. На цій повільній ста-
дії відбувається утворення ковалентного зв’язку між електрофільною частинкою (Сl-) та одним з атомів Карбону бензенового кільця. Зв’язок утворюється за рахунок двох електронів кільця, при цьому атом Карбону з sр2-гібридизованого стану переходить в sр3. Ароматична система при цьому порушується, молекула бензену перетворюється на карбкатіон.
Відщеплення протона. Порушення ароматич-
ності енергетично невигідне, тому структура σ -комплексу менш стійка, ніж ароматична. Для відновлення ароматичності відбувається відщеплення протона від атома Карбону, зв’язаного з електрофілом. При цьому два електрони повертаються в π -систему, тим самим відновлюється ароматичність.
Вплив замісників на реакційну здатність аренів (SЕ)
Якщо в бензеновому кільці є замісник, то він порушує рівномірний розподіл електронної щільності в кільці, і виникає положення з підвищеною та зниженою електронною щільністю. Наступні замісники прагнуть вступити в положення з підвищеною щільністю. Таким чином, замісники в бензеновому кільці визначають напрямок реакцій заміщення.
20

Усі замісники поділяються на два типи. Замісники І роду (електронодонорні) збільшу-
ють електронну щільність і спрямовують реакції заміщення переважно в орто- та пара-положен- ня. До них належать такі групи (знизу вказані електронні ефекти, які спостерігаються під впливом цієї групи):
–СН3 |
–ОН –NН2 |
Сl |
Вr |
+I |
+M, –I +M, –I |
+M, –I |
+M, –I |
Неподілена пара гетероатомів (О, N, S) цих груп вступає в спряження із π -електронною системою бензенового кільця. Такий тип спряження називається ρ ,π -спряженням (мезомерний ефект). Під впливом електронодонорних замісників (+Мефект) відбувається перерозподіл електронної щільності в бензеновому кільці з деяким її зосередженням в орто- і пара-положеннях.
H
 O
O
δ - |
|
δ - |
–ОН-група справляє |
|
|||
|
|||
|
+Мефект та –І-ефект, але |
||
|
|
||
|
|
|
+Мефект превалює
δ -
Фенол
Замісники II роду (електроноакцепторні) спрямовують наступне заміщення переважно в мета- положення. До них належать такі групи:
–NО2 |
–СООН |
–ССl3 |
–М, –I |
–М, –I |
–I |
Електроноакцепторні замісники справляють Мефект і знижують електронну щільність у спряженій системі. Електронна щільність бензенового кільця в цілому знижується, однак у мета-поло- женні — в меншому ступені, тому наступне заміщення спрямовується в це положення.
H O
C
δ - δ -
Бензальдегід
Нуклеофільне заміщення насиченого атома Карбону (SN)
Взаємодія спиртів із карбоновими кислотами відбувається за механізмом нуклеофільного заміщення (SN). В якості нуклеофіла виступає молекула спирту, котра атакує атом Карбону карбоксильної групи кислоти, яка, у свою чергу, несе частковий позитивний заряд.
|
|
|
δ - |
|
|
|
|
|
|
|
|||
|
δ + O |
|
|
|
|
|
|
|
|||||
CH3OH + CH3 |
|
C |
|
|
|
|
|
CH3O |
|
C |
|
CH3 + H2O |
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|||||||||
|
|
|
HОН |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
O |
||||||||
Метан Оцтова Метилaцетат кислота
Гідроксигрупа має:
+М(ОН) — позитивний мезомерний ефект
 δ - –І(ОН) — негативний індуктивний ефект
δ - –І(ОН) — негативний індуктивний ефект
δ + O R C
OН
Електрофільний центр
Карбонова
кислота
У нуклеофільних реакціях похідних карбонових кислот необхідний кислотний аналіз, що веде до появи більш повного позитивного заряду на атомі Карбону, що полегшує атаку нуклеофілам.
|
|
O |
+ |
OH |
|||
R |
|
C + H+ |
|
R |
|
C |
|
|
|
|
|||||
|
|
X |
|
|
|
|
X |
|
|
|
Похідне |
|
|
Активована |
|
||||||||
|
|
карбонової |
молекула похідної |
||||||||||||
|
|
|
кислоти |
карбонової кислоти |
|||||||||||
+ |
OH |
|
|
OH |
|
|
|
|
O |
||||||
|
|
|
|
|
|
|
|
|
|
||||||
R |
|
C |
+ Y- |
|
R |
|
C |
|
Y |
- |
R |
|
C |
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
||||||||||
|
|
|
X |
|
|
|
|
|
|
- X |
Y |
||||
|
|
|
|
|
X |
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||
Нуклеофіл
Радикальне заміщення насиченого атома Карбону (SR)
При взаємодії алканів із галогенами (хлором, бромом) під впливом УФ-випромінювання або високої температури утворюється суміш продуктів від монодо полігалогензамісних алканів.
CH4 + 5Cl2 hυ  CH3Cl + CH2Cl2 + CHCl3 + CCl4
CH3Cl + CH2Cl2 + CHCl3 + CCl4
Ініціювання. На цій стадії відбувається розпад молекули хлору на два вільних радикали:
• |
hυ |
|
|
|
|
Cl • Cl |
|
2Cl• |
Ріст ланцюга. Радикал хлору атакує зв’язок С–Н у молекулі метану, зв’язок при цьому розривається гомолітично, утворюються радикал Гідрогену та нейтральна молекула НСl:
Cl• + |
|
|
hυ |
|
|
• |
|
|
• |
||
H • |
CH3 |
|
H • Cl + H3C• |
||
Радикал Метан |
|
Метил- |
|||
хлору |
|
|
|
|
радикал |
У метильному радикалі атом Карбону знаходиться в стані sр2-гібридизації, тобто має плоску будову. На вільній р-орбіталі знаходиться один електрон. Висока реакційна здатність метильного радикалу пояснюється прагненням до утворення ковалентного зв’язку за участю цього електрона й доступністю для взаємодії р-орбіталі.
Н3С• + |
• |
→ |
• |
+ Cl• |
Сl • Cl |
H3C • Cl |
Хлорметан
Радикал хлору знову атакує молекулу метану, далі повторюються описані вище реакції. У результаті одержують суміш продуктів різного ступеня хлорування — хлорметан СН3Сl, ди-
21
хлорметан СН2Сl2, трихлорметан СНСl3 та тетрахлорметан. Процеси такого типу називаються ланцюговими, оскільки один вільний радикал хлору міг би ініціювати хлорування всіх молекул метану, які знаходяться у реакційному середовищі.
Обрив ланцюга. Послідовні реакції росту ланцюга можуть перерватися, якщо відбудеться зникнення вільного радикала.
Cl• + Cl• → |
• |
Cl |
Cl • |
1.3. БУДОВА ТА ВЛАСТИВОСТІ АЛЬДЕГІДІВ І КЕТОНІВ
Органічні сполуки, у молекулі яких є карбонільна група 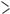 C=O, називають карбонільними
C=O, називають карбонільними
сполуками, або оксосполуками. Карбонільні спо-
луки діляться на дві великі групи — альдегіди і кетони.
Альдегіди містять у молекулі карбонільну групу, обов’язково зв’язану з атомом Гідрогену, тобто альдегідну групу –СН=О.
Кетони містять карбонільну групу, зв’язану з двома вуглеводневими радикалами, тобто кетонну групу.
Залежно від будови вуглеводневих радикалів альдегіди і кетони бувають аліфатичними, аліциклічними й ароматичними. У молекулі кетону радикали можуть бути однаковими або різними. Тому кетони, як і прості ефіри, діляться на симетричні й несиметричні. Приклад змішаного кетону
— метилфенілкетон (оцетфенон) С6Н5СОСН3.
ОКСОСПОЛУКИ
Альдегіди Кетони
|
|
|
|
O |
|
|
|
|
O |
||||
R |
|
|
C |
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
H |
|
R |
|
C |
|
R |
|||
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
CH3 |
|
|
|
C CH3 |
|||
CH3 |
|
|
C |
Аліфатичні |
|
||||||||
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
H |
|
|
|
|
|
O |
|||
Ацетальдегід Ацетон
O |
|
|
C |
Аліциклічні |
O |
H |
|
Циклогексанкарбальдегід Циклогексанон
O |
|
O |
C |
Ароматичні |
C |
H |
|
|
Бензальдегід |
|
Бензофенол |
Номенклатура та ізомерія
У назвах аліфатичних альдегідів за замісною номенклатурою наявність альдегідної групи (за умови, що вона є старшою) відображається суфіксом -аль. Основою служить назва родона-
чального вуглеводню (головного вуглецевого ланцюга). Нумерація головного ланцюга починається з атома Карбону альдегідної групи. У деяких альдегідів зберігаються й тривіальні назви, утворені від назв кислот, на які альдегіди перетворюються при окисненні, з додаванням слова «альдегід».
Назви аліциклічних альдегідів походять від назви відповідного карбоциклу (при цьому атом Карбону альдегідної групи не нумерується) з додаванням закінчення -карбальдегід, а ароматичних альдегідів — від родоначальної структури ряду — бензальдегіду.
|
|
O |
|
|
O |
|
|
|
|
O |
H |
|
C |
CH3 |
|
C |
CH3 |
|
CH2 |
|
C |
|
|
|
|
|||||||
|
|
H |
|
|
H |
|
|
|
|
H |
Метаналь |
Етаналь |
Пропаналь (пропіо- |
||||
(формальдегід) (оцетальдегід) |
новий альдегід) |
|||||
|
O |
O |
|
O |
||
|
|
|
|
|
|
|
|
C H |
|
C H |
Br |
|
C H |
CI |
|
|
|
|
|
|
2-Хлорциклогексан- |
Бенз- |
3-Бромбенз- |
||||
карбальдегід |
альдегід |
|
альдегід |
|||
Назви аліфатичних кетонів дають, взявши за основу головний вуглецевий ланцюг, до складу якого входить атом Карбону кетонної групи, з додаванням суфікса -он. Нумерацію головного ланцюга починають із того кінця, ближче до якого перебуває кетонна група.
Для назви кетонів, особливо ароматичних, використовується радикально-функціональна номенклатура. У цьому випадку в назві перераховуються за алфавітом радикали, зв’язані з карбонільною групою, з додаванням слова «кетон». Деякі кетони мають також тривіальні назви (ацетон, бензофенон та ін.).
CH3 |
|
C |
|
CH3 |
CH3 |
|
C |
|
CH2 |
|
CH3 |
||
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
O |
|
|
|
|
||||
Пропанон |
|
Бутанон |
|||||||||
(диметилкетон) |
(метилетилкетон) |
||||||||||
(Ацетон) |
|
|
|
|
|
|
|||||
C6H5 |
|
C |
|
C6H5 |
C6H5 |
|
C |
|
CH2CH2CH3 |
||
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|||
|
|
O |
|
|
O |
||||||
Дифенілкетон |
Пропілфеніл- |
||||||||||
(бензофенон) |
|
|
|
кетон |
|||||||
Реакції нуклеофільного приєднання (АN)
Альдегіди та кетони, завдяки електрофільному центру, здатні вступати у взаємодію з нуклеофільними реагентами. Для оксосполук найбільш характерні реакції, що перебігають за механізмом нуклеофільного приєднання, їх позначають сим-
волом AN (від англ. addition nucleophilic). Залеж-
но від характеру нуклеофільного реагенту, що приєднується по подвійному зв’язку С=О, альдегіди і кетони перетворюються на різноманітні сполуки.
22

Нуклеофіл N атакує електрофільний центр молекули оксосполуки — атом Карбону карбонільної групи — і приєднується до нього за рахунок своєї пари електронів. Водночас відбувається гетеролітичний розрив π -зв’язку С=О, і пара електронів, що утворювала цей зв’язок, переходить до атома Оксигену, створюючи на ньому негативний заряд. Таким чином, у результаті приєднання нуклеофільного реагенту оксосполука перетворюється на алкоксидіон. Ця стадія реакції перебігає повільно.
Алкоксидіон є сильною основою. Тому він легко взаємодіє з будь-якою, навіть слабкою, кислотою (наприклад з молекулою води). Друга стадія реакції, що перебігає швидко, полягає в стабілізації алкоксидіона шляхом приєднання протона із середовища. У результаті реакції атом Карбону оксогрупи переходить із sp2- в sp3-гіб- ридний стан.
Реакцію нуклеофільного приєднання можна представити в загальному вигляді такою схемою:
δ + δ - |
|
|
|
|
|
|
|
|
|
|
|
|
OH |
Реакція нуклеофільного |
|||||
C |
|
|
O + H+X - |
|
|
|
|
|
|
|
C |
||||||||
|
|
|
|
|
|
|
|
|
приєднання |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
X |
|
δ + δ - |
повільно |
|
|
|
|
|
O- |
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
C |
|
|
O + X- |
|
|
|
|
|
|
C |
|
|
X- — нуклеофіл |
||||||
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
X |
|
|
|
|
|||
|
|
|
|
|
|
|
швидко |
|
|
|
|
|
|
|
|
||||
C |
|
|
O- + H+ |
|
|
|
C |
|
|
OH |
Продукт приєднання |
||||||||
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
X |
|
|
|
|
|
|
|
|
|
|
X |
|
|
|
|
||||
Атака нуклеофіла перебігає тим легше, чим більша величина часткового позитивного заряду на атомі Карбону. Істотний вплив на величину δ + чинять вуглеводні радикали і замісники в них. Оскільки алкільні радикали виявляють +І- ефект, тобто є електронодонорами, то аліфатичні альдегіди практично завжди більш активні в реакціях нуклеофільного приєднання, ніж аліфатичні кетони, які мають два вуглеводневих радикали. Електроноакцепторні замісники підсилюють електрофільність атома Карбону, отже, підвищують реакційну здатність оксосполуки. Електронодонорні замісники, навпаки, знижують її:
АЛЬДЕГІДИ
|
|||||||||||||||||||
|
|
CI |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
δ + O |
|
|
|
|
δ '+ O |
|
|
δ ''+ O |
||||||
|
|
|
|
|
|
|
|
|
|
||||||||||
CI |
|
C |
|
C |
|
|
H |
|
C |
CH3 |
|
C |
|||||||
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
H |
|
|
|
|
|
H |
|
|
|
|
H |
||
|
|
CI |
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Трихлоретаналь |
|
|
Метаналь |
|
|
Етаналь |
|||||||||||||
|
|
|
|
|
|
|
|
|
КЕТОНИ |
|
|
|
|
|
|||||
|
|
||||||||||||||||||
|
|
|
CH3 |
δ '''+ |
|
|
CH3 |
|
|
CH2 |
δ ''''+ |
||||||||
|
|
|
|
|
|
||||||||||||||
|
|
|
|
||||||||||||||||
|
C |
|
O |
|
C |
|
O |
||||||||||||
|
|
|
|
||||||||||||||||
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
Пропанон |
|
|
|
|
|
Бутанон |
||||||||||
|
|
|
δ + |
δ′ + |
δ′′ + δ′′′ + δ′′′′ + |
||||||||||||||
Зменшення реакційної здатності оксосполук
В ароматичних альдегідах і кетонах карбонільна група перебуває в сполученні з бензеновим кільцем, виявляючи –I- і –Мефекти. Вона відтягує на себе електронну щільність бензенового кільця, що приводить до зниження величини δ + на атомі Карбону карбонільної групи. Цим пояснюється нижча реакційна здатність ароматичних оксосполук порівняно з аліфатичними. Ароматичні альдегіди, як правило, більш реакційноздатні, ніж змішані й тим більше ароматичні кетони.
Oδ + |
Oδ '+ |
Oδ ''+ |
C H |
C CH3 |
C |
Бензальдегід |
Оцетфенон |
Бензофенон |
|
δ + δ′ + δ′′ + |
|
Зменшення реакційної здатності оксосполук
До найважливіших реакцій нуклеофільного приєднання належать реакції оксосполук із ціанідами, водою та спиртами, аміаком і амінами,
атакож із деякими іншими реагентами.
1.Взаємодія з ціанідами металів. При взає-
модії оксосполук із солями ціановодневої кислоти (ціанідами) утворюються гідроксинітрили.
Гідроксинітрили — це сполуки, які містять у молекулі гідроксильну групу та ціаногрупу.
Сама ціановоднева кислота HCN мало дисоційована. Тому реакцію проводять у лужному середовищі, де утворюється ціанідіон, що є активною нуклеофільною частинкою.
Нуклеофіл
|
|
|
|
|
|
|
|
|
|
CN |
|
|
|
|
|
|
|
|
|||
|
|
|
|
O |
|
|
|
H2O |
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
- |
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
CH3 |
|
C |
+ -CN |
|
|
CH3 |
|
C |
|
O |
|
- OH - |
|
CH3 |
|
|
|
CHCN |
|||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
H |
|
|
|
|
|
|
H |
|
|
|
|
|
OH |
||||||
Ацет |
Ціанід |
|
|
|
|
|
|
|
|
|
2-Гідрокси- |
||||||||||
альдегід |
-іон |
|
|
|
|
|
|
|
|
пропанонітрил |
|||||||||||
За допомогою цієї реакції можна подовжити вуглецевий ланцюг вихідної сполуки на один атом Карбону; продукти реакції — гідроксинітрили — служать вихідними сполуками для синтезу гідроксикарбонових кислот.
2. Взаємодія з водою. Альдегіди й у значно меншому ступені кетони оборотно приєднують воду, утворюючи гідрати:
|
O |
|
|
|
|
|
|
OH |
|||
|
|
|
|
|
|
|
|
|
|
|
|
CH C |
+ H O |
|
|
|
CH |
|
|
C |
|
OH |
|
|
|
|
|
|
|
||||||
3 |
2 |
|
|
|
|
3 |
|
|
|
|
|
|
H |
|
|
|
|
|
|
H |
|||
|
|
|
|
|
|
|
|
||||
Ацетальдегід |
|
|
Гідрат ацетальдегіду |
||||||||
Стан рівноваги у цій реакції залежить від реакційної здатності карбонільної сполуки. Формальдегід у водному розчині гідратований на 100 %, ацетальдегід — на 51 %, у водному розчині ацетону гідратна форма практично відсутня. Галогеновані в α -положенні альдегіди і кетони, у яких більший частковий позитивний заряд
23
на атомі Карбону, мають високий вміст гідрат- |
4. Взаємодія з амінами. Взаємодія оксосполук із |
||||||||||||||||||||||||||
них форм у водних розчинах. Наприклад, три- |
первинними амінами перебігє за механізмом при- |
||||||||||||||||||||||||||
хлорацетальдегід (хлораль) утворює дуже стійку |
єднання–відщеплення. На першій стадії реакції |
||||||||||||||||||||||||||
гідратну форму — хлоральгідрат, відщепити |
відбувається нуклеофільне приєднання аміну по |
||||||||||||||||||||||||||
воду від якого можна тільки при дії концентро- |
подвійному зв’язку |
С=О карбонільної групи. |
|||||||||||||||||||||||||
ваної сульфатної кислоти. |
Аміни є сильними нуклеофілами, у цьому випад- |
||||||||||||||||||||||||||
3. Взаємодія зі спиртами. Спирти, як і вода, |
ку немає необхідності активувати електрофіль- |
||||||||||||||||||||||||||
оборотно приєднуються до оксосполук, переваж- |
ний центр оксосполук. Первинним продуктом |
||||||||||||||||||||||||||
но альдегідів, з утворенням напівацеталей. У |
приєднання є біполярний іон, що стабілізується |
||||||||||||||||||||||||||
спиртових розчинах альдегідів напівацеталі пе- |
в результаті внутрішньомолекулярного переносу |
||||||||||||||||||||||||||
ребувають у рівновазі з карбонільними сполука- |
протона від атома Нітрогену до атома Оксиге- |
||||||||||||||||||||||||||
ми. Так, в етанольному розчині ацетальдегіду |
ну, перетворюючись на аміноспирт. Однак реак- |
||||||||||||||||||||||||||
утримується близько 30 % напівацеталю (у роз- |
ція не зупиняється на цій стадії. Вже підкреслю- |
||||||||||||||||||||||||||
рахунку на альдегід). |
|
|
|
|
|
|
|
|
|
валося, що сполуки, які містять дві електроноак- |
|||||||||||||||||
|
|
O |
|
|
|
|
|
OC2H5 |
цепторні групи при одному атомі Карбону, |
||||||||||||||||||
|
|
|
|
|
|
|
нестійкі, вони прагнуть до стабілізації шляхом |
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
CH3 |
|
C + C2H5OH |
|
|
|
CH3 |
|
C |
|
OH |
|||||||||||||||||
|
|
|
|
|
|
відщеплення однієї з груп у вигляді нейтральної |
|||||||||||||||||||||
|
|
|
|
||||||||||||||||||||||||
|
|
H |
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
H |
||||||||||||||||||||
|
|
|
|
|
|
|
|
термодинамічно стабільної молекули. У цьому |
|||||||||||||||||||
Ацетальдегід |
1-Етоксіетанол |
||||||||||||||||||||||||||
випадку відбувається відщеплення молекули |
|||||||||||||||||||||||||||
|
|
|
(напівацеталь) |
||||||||||||||||||||||||
|
|
|
води від молекули аміноспирту (друга стадія ре- |
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
При взаємодії з другою молекулою спирту в |
акції — елімінування) і утворюється амін (осно- |
||||||||||||||||||||||||||
умовах кислотного каталізу напівацеталі пере- |
ва Шиффа). |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
творюються на ацеталі. Багато які з кетонів у цю |
δ |
+ |
δ - |
|
AN |
|
|
|
|
E |
|
|
|
|
|
||||||||||||
реакцію не вступають, їхні ацеталі одержують |
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
C |
|
O |
+ NH2R |
|
C |
|
NH R |
-H O |
C |
|
N |
|
R |
||||||||||||||
іншими методами. Напівацеталі зазвичай не ви- |
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
||||||||||||
|
|
|
|
|
OH |
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
діляють через їхню нестійкість: |
|
|
|
Амін |
|
|
|
|
|
Основа Шиффа |
|||||||||||||||||
|
OC2H5 |
|
|
|
|
|
OC2H5 |
|
|
АN |
— нуклеофільне приєднання |
||||
|
|
|
Н+ |
|
|
|
|
Е — відщеплення (елімінування) |
|||||||
CH C OH + C H OH |
CH |
3 |
C OC H |
5 |
+ H O |
|
|
|
|
||||||
|
3 |
|
2 |
5 |
|
|
2 |
2 |
|
|
|
|
|||
|
H |
|
|
|
|
|
|
H |
|
|
|
Реакції нуклеофільного |
|||
1-Етоксіетанол |
|
|
|
1,1-Діетоксіетан |
приєднання–відщеплення |
||||||||||
(напівацеталь) |
|
|
|
|
(ацеталь) |
|
R |
|
|
R |
|||||
|
|
|
|
|
|
|
|
|
|
|
O + NH2OH |
|
|||
|
|
|
|
|
|
|
|
|
|
|
C |
-H2O |
C N OH |
||
Таким чином, загальна схема утворення на- |
R' |
|
R' |
||||||||||||
Гідроксил- |
|||||||||||||||
півацеталей і ацеталей з відкритим ланцюгом |
|
Оксим |
|||||||||||||
|
амін |
|
|
||||||||||||
така: |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
OH |
|
|
R |
|
|
R |
|
|
|
|
|
|
|
|
C |
|
|
C |
O + NH2NH2 |
|
C N NH2 |
||
|
|
C |
O + ROH |
|
|
|
|
-H2O |
|||||||
|
|
|
|
|
|
|
|
OR |
|
|
R' |
|
|
R' |
|
|
|
|
|
|
|
|
|
|
|
|
Гідразин |
|
Гідразон |
||
|
|
|
|
|
напівацеталь |
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
OH |
|
|
|
OR |
|
|
|
|
|
|
||
|
|
C |
|
+ ROH |
|
C |
|
|
|
R |
|
|
R |
||
|
|
|
OR |
|
|
|
OR |
|
|
|
|
||||
|
|
|
|
|
|
|
|
C O + NH2NHC6H5 |
|
C N NH C6H5 |
|||||
|
|
|
|
|
|
|
|
|
|
|
-H O |
||||
|
|
|
|
|
|
ацеталь |
|
|
R' |
|
2 |
R' |
|||
|
|
|
|
|
|
|
|
|
|
||||||
Утворення циклічних напівацеталей: |
Фенілгідразин |
Фенілгідразон |
|||||||||||||
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
Альдегід R′ = H |
|
|
||
|
|
|
|
H |
|
|
|
H |
|
|
Кетон R′ ≠ H |
|
|
||
|
|
|
C |
|
|
|
|
C |
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
OH |
|
|
Подібно взаємодії з первинними амінами пе- |
||||
|
|
OH |
|
|
|
|
O |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
ребігають реакції оксосполук із такими похідни- |
||||
Прикладом утворення циклічних напівацета- |
ми аміаку, як гідроксиламін NH2OH, гідразин |
||||||||||||||
лей є молекула глюкози (формула Коллі — То- |
H2N–NH2, фенілгідразин C6H5NHNH2 та інші |
||||||||||||||
похідні оксосполуки, що утворюються, — окси- |
|||||||||||||||
ленса і Хеуорса). |
|
|
|
|
|
|
|
|
ми, гідразони, фенілгідразони; зазвичай це стійкі |
||||||
|
|
|
|
|
|
|
|
|
|
|
|||||
H |
O |
|
|
H |
OH |
|
|
|
|
|
кристалічні речовини з чіткими температурами |
||||
|
C |
|
|
Н–С–ОН |
|
CH OH |
плавлення, використовуються для ідентифікації |
||||||||
H |
OH |
|
|
C |
OH |
|
|
2 |
|
||||||
|
|
H |
|
|
|
O |
вихідних оксосполук. |
|
|
||||||
HO |
H |
|
|
HO |
H |
O |
|
OH |
|
|
|
|
|||
|
|
|
|
OH |
5. Відновлення оксосполук. Альдегіди віднов- |
||||||||||
H |
OH |
|
|
H |
OH |
|
|
OH |
|
||||||
H |
OH |
|
|
H |
|
|
|
|
OH |
люються в первинні спирти, а кетони — у вто- |
|||||
|
CH2OH |
|
|
CH2OH |
|
|
|
|
ринні. Одним з ефективних відновників оксоспо- |
||||||
|
|
|
|
|
|
|
|
|
|
|
|||||
D-глюкоза |
D-глюкопіраноза |
D-глюкопіраноза |
лук є алюмогідрид літію LiAIH4. Він є постачаль- |
||||||||||||
(формула |
|
(формула |
|
(формула |
ником гідридіонів Н-, які є нуклеофільними час- |
||||||||||
Фішера) |
Коллі — Толенса) |
Хеуорса) |
тинками і приєднуються по подвійному зв’язку |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
24 |
|
|
|
|

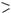 С=О. Для перетворення спочатку утворюється алкоксидіон із спирту, після закінчення відновлення в реакційну суміш додають воду.
С=О. Для перетворення спочатку утворюється алкоксидіон із спирту, після закінчення відновлення в реакційну суміш додають воду.
Альдольна конденсація
Реакції альдольно-кротонової конденсації пере-
бігають з альдегідами та кетонами, у яких атом Карбону, безпосередньо зв’язаний з карбонільною групою, має хоча б один атом Гідрогену. Для розуміння механізму реакції необхідно розглянути вплив карбонільної групи на аліфатичний радикал. Електроноакцепторна карбонільна група викликає поляризацію зв’язків із сусідніми атомами, зокрема зв’язку С-Н в α -атомі Карбону. Атом Гідрогену стає рухливим, виникає СН-кислотний центр. За рахунок цього кислотного центру оксосполука може під дією сильних основ відщепити протон і перетворитися на карбаніон. Негативний заряд у карбаніоні, що утворився, делокалізований за участю альдегідної або кетонної групи:
|
|
|
|
|
|
δ - |
|
|
|
|
|
O |
|
|
|
|
|
δ + O |
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|||
R |
|
CH |
|
|
C |
|
R CH |
|
|
|
C + H+ |
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|||||||
|
|
|
|
2 |
|
|||||||
|
|
|
|
|
|
H |
|
|
|
|
|
H |
|
|
H |
|
|
||||||||
Альдегід Карбаніон
Аніон — це сильний нуклеофіл, він реагує з другою молекулою карбонільної сполуки за механізмом нуклеофільного приєднання з утворенням альдолю (альдоль: альд — альдегід; -ол — спирт):
|
|
|
|
O |
|
|
|
|
|
O |
|
|
|
|
|
|
|
O |
O |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
R |
|
CH2 |
|
C + R CH |
|
C |
|
|
|
|
|
R CH2 |
CH CH C + |
|||||||||
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
H |
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
R |
H |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Альдегід |
Карбаніон |
|
|
|
|
Алкоксидіон |
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
O |
|
|||
|
|
|
|
+ H2O |
|
|
|
|
R |
|
CH2 |
|
|
|
|
|
|
CH C |
|
|||
|
|
|
|
|
|
|
|
|
|
|
CH |
|
|
|
H |
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R |
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Альдоль
В умовах організму здійснюється альдольна конденсація, наприклад, оксалоацетату (щавлевооцтової кислоти) та ацетилкоензиму А в циклі Кребса, що приводить до утворення цитрату (лимонної кислоти).
COOH |
|
|
|
Цитрат |
|
|
COOH |
|
|
||||||||||
|
|
CHOH |
|
|
O |
синтаза |
|
|
|
|
|
|
|
||||||
|
|
|
CH |
|
|
||||||||||||||
|
|
2 |
+ CH |
|
C |
|
|
|
|
|
|
|
2 |
|
O + HSKoA |
||||
C |
|
O |
3 |
|
|
SKoA |
HO |
|
C |
|
CH2 |
|
C |
||||||
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H КоензимА |
COOH |
|
|
|
|
|
|
|
|
COOH |
||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||
Оксалоацетат Ацетил-КоА Цитрат
OH |
O |
|
|
OH |
|
|
|
OH |
H |
||
O P CH2 |
|
CH2 |
P O |
|
|
CH2 |
O P O |
C O |
|||
|
|
|
|
||||||||
OH |
|
OH |
OH |
|
|
|
C O |
OH + H C OH OH |
|||
|
|
|
|||||||||
|
|
|
|
||||||||
|
|
|
|
OH |
|
|
|
|
CH2 |
OH |
CH2 O P O |
|
|
|
|
|
|
|
|
|
|||
OH |
|
|
|
|
|
|
|
|
|
OH |
|
Фруктозо- |
|
|
Діоксіацетон- |
Гліцеральде- |
|||||||
1,6-бісфосфат |
|
|
|
|
фосфат |
гід3-фосфат |
|||||
Окиснення альдегідів і кетонів. Якісні реакції на виявлення альдегідної групи
Альдегіди і кетони по-різному реагують на дію окисників. Альдегіди легко (значно легше, ніж спирти) окиснюються у відповідні карбонові кислоти. Для їхнього окиснення можна використовувати такі м’які окисники, як оксид срібла та гідроксид міді (ІІ).
Кетони до дії цих окисників інертні. Не окиснюються вони й киснем повітря. Тільки під дією більш сильних окисників кетони вдається окиснити. При цьому відбувається розрив вуглецьвуглецевих зв’язків у вихідній молекулі й утворюється суміш різних продуктів окиснення (кислот і кетонів) з меншою кількістю атомів Карбону, ніж у молекулі вихідного кетону.
Однією з якісних реакцій для виявлення альдегідної групи є реакція «срібного дзеркала» — окиснення альдегіду оксидом срібла. Оксид срібла завжди готують безпосередньо перед дослідом, додаючи до розчину нітрату срібла розчин гідроксиду лужного металу.
AgNO3 + KOH → |
KNO3 + AgOH |
|
2AgOH |
→ |
Ag2O + H2O |
2Ag2O + NH3 |
→ |
[Ag(NH3)2]+OH- |
У розчині аміаку оксид срібла утворює комплексну сполуку — гідроксид діамінсрібла, відому також під назвою реактиву Толенса. Під дією гідроксиду діамінсрібла на альдегід відбувається окисно-відновна реакція. Альдегід окиснюється у відповідну кислоту, а катіон срібла відновлюється в металеве срібло, що дає блискучий наліт на стінках пробірки — «срібне дзеркало».
|
|
O |
|
+OH- |
|
|
|
O |
CH3 |
|
C + |
Ag(NH3)2 |
|
CH3 |
|
C + 2Ag + 4NH3 + 2H2O |
|
|
|
|
||||||
|
|
H |
|
|
|
|
|
OH |
Ацетальдегід |
|
Оцтова кислота |
||||||
Інша якісна реакція на альдегіди полягає в окисненні їх гідроксидом міді (II) (реактив Фелінга). При окисненні альдегіду гідроксид міді (ІІ),
Урослинних клітинах здійснюється біосинтез що має світло-блакитний колір, відновлюється в фруктози за механізмом альдольної конденсації. гідроксид міді (І) жовтого кольору. Цей процес
Упроцесі гліколізу спостерігається альдольне перебігає при кімнатній температурі. Якщо
розщеплення фруктозо-1,6-бісфосфату на дві фосфотріози: гліцеральдегід3-фосфат і діоксіацетонфосфат у присутності альдолази:
підігріти випробуваний розчин, то гідроксид міді (І) жовтого кольору перетворюється на оксид міді (І) червоного кольору.
25

O |
|
O |
CH3 C + 2Cu(OH)2 |
|
CH3 C + |
|
||
H |
|
OH |
Оцеталь- |
Гідроксид |
Оцтова |
|||||
дегід |
міді (ІІ) |
кислота |
|||||
+ H2O + 2CuOH |
|
|
|
CuO |
|
+ H2O |
|
|
|
||||||
|
|
|
|
||||
|
Гідроксид |
Оксид |
|||||
|
міді (І) |
міді (І) |
|||||
Аналітичні реакції для виявлення наявності глюкози в біологічних рідинах використовують здатність глюкози відновлювати в лужному середовищі при нагріванні оксиди срібла та міді. З цією метою застосовують:
1.Реактив Фелінга — іон Cu2+, стабілізований тартратаніоном.
2.Реактив Толенса — аміачний розчин Ag2О.
3.Реактив Троммера — Cu(ОН)2.
Реакція диспропорціонування (дисмутації)
З альдегідами, які не мають α -водневого атома (наприклад, формальдегід, бензальдегід, фурфурол) і тому не здатні зазнавати альдольного ущільнення, під дією лугу відбувається інше перетворення — окисно-відновне диспропорціонування до відповідних спирту та карбонової кислоти (у вигляді солі).
|
CH O |
|
COOK |
CH2OH |
2 |
KOH |
+ |
|
|
|
|
|
||
|
Бенз- |
Бензоат |
Бензиловий |
|
альдегід |
|
калію |
спирт |
|
Реакцію вперше спостерігав Канніццаро (1853). Для альдегідів, які мають α -водневий атом, аналогічний процес здійснив В. Є. Тищенко (1906) під дією алкоголяту алюмінію. У результаті утворюється не суміш спирту з кислотою, а продукт їхньої взаємодії — складний ефір:
CH3 |
|
|
|
AI(OR) |
|
|
|
|
|
|
CH3 |
2 |
C |
|
O |
3 |
CH3 |
|
CH2 |
|
O |
|
C |
|
|
|
|
|
|||||||
H |
|
|
|
|
|
|
|
|
|
|
O |
Етиловий ефір оцтової кислоти
Це перетворення названо реакцією Канніццаро — Тищенко, або складноефірною конденсацією. Воно є наслідком того, що альдегіди за ступенем окиснення займають проміжне положення між спиртами і кислотами, з якими їх пов’язують окисно-відновні переходи, які відіграють важливу роль у процесах метаболізму органічних сполук.
Галоформні реакції
Тригалогенопохідні метану СННаl3 (хлороформ, йодоформ і бромоформ), які мають загальну назву галоформи, одержують дією вільних галогенів на етанол у лужному середовищі. Розглянемо цю реакцію на прикладі одержання йодоформу, оскільки вона застосовується у фарма-
цевтичній практиці для визначення наявності етанолу (йодоформна проба).
CH3 CH2OH + I2 + KOH → |
CHI3 |
+ HCOOK |
Етанол |
Йодо- |
Форміат |
|
форм |
калію |
Реакція перебігає в кілька стадій. Йодноватиста кислота НОІ, що утворюється при розчиненні йоду в лузі, перебуває в рівновазі зі своєю калієвою сіллю КОІ.
I2 + KOH → KI + HOI
Йодноватиста
кислота
HOI + KOH 
 KOI + H2O
KOI + H2O
Гіпойодит
калію
Солі йодноватистої кислоти (гіпойодити) є сильними окисниками і окиснюють етанол в ацетальдегід.
O
CH3CH2OH + KOI |
|
CH3 |
|
C + H2O + KI |
|
|
H
Етанол Ацетальдегід
У молекулі ацетальдегіду атоми Гідрогену метильної групи стають більш реакційноздатними, ніж у молекулі етанолу, і легко заміщаються на йод з утворенням трийодацетальдегіду (йодалю). Під дією лугу йодаль легко перетворюється на йодоформ і сіль мурашиної кислоти (форміат). Йодоформ випадає в осад у вигляді яскраво-жов- тих кристалів і виявляється за характерним запахом.
|
|
O |
3HOI |
O |
KOH |
CHI3 + H |
|
O |
|
CH3 |
|
C |
- 3H2O |
I3C C |
|
|
C |
||
|
|
H |
H |
|
|
|
|
OK |
|
|
|
|
|
|
|
|
|||
Ацет |
|
Йодаль |
|
Йодо- |
Форміат |
||||
альдегід |
|
|
|
форм |
|
|
калію |
||
1.4. СТРУКТУРА, ВЛАСТИВОСТІ ТА БІОЛОГІЧНЕ ЗНАЧЕННЯ КАРБОНОВИХ КИСЛОТ
Карбоновими кислотами називають сполуки, що містять карбоксильну групу –СООН. За кількістю карбоксильних груп карбонові кислоти підрозділяються на монокарбонові, або одноосновні (містять одну групу –СООН), дикарбонові, або двохосновні (дві групи –СООН) тощо. Залежно від будови вуглеводного радикала карбонові кислоти можуть бути аліфатичними, аліциклічними або ароматичними.
Кислотні властивості карбонових кислот
Кислотні властивості карбонових кислот по- в’язані з властивістю атома Гідрогену карбоксильної групи відщеплювати протон:
26

|
|
|
|
|
КАРБОНОВІ КИСЛОТИ |
Декарбоксилювання карбонових кислот |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||
Монокарбонові |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Дикарбонові |
Здатність до декарбоксилювання залежить від |
||||||||||||||||||||||||||||||||||||||||||||
CH3 |
|
COOH |
|
|
|
|
Аліфатичні |
HOOC |
|
CH2 |
|
CH2 |
|
COOH |
будови кислоти. Монокарбонові кислоти втра- |
||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
чають СО2 |
важко, тільки при нагріванні їх солей |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||
Оцтова кислота |
|
|
|
|
|
|
|
|
|
|
|
Бурштинова кислота |
|||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
з твердими лугами. |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HOOC COOH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Щавлева кислота |
|
|
|
|
|
|
|
|
O |
|
|
|
|
t °Ct |
CH + |
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH |
|
|
|
|
|
C |
+ |
NaOH |
Na CHO |
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HOOC |
|
|
CH2 |
|
COOH |
3 |
|
|
|
|
ONa |
|
|
|
4 |
2 3 |
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Малонова кислота |
Про введенні в молекули кислот електроноак- |
||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HOOC |
|
CH2 CH2 CH2 COOH |
||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
цепторних замісників –СООН, –NH2 схильність |
|||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Глутарова кислота |
||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
їх до декарбоксилювання підвищується. Тому |
||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
COOH |
щавлева кислота декарбоксилюється вже при |
||||||||||||||||||||||||||
|
|
COOH |
|
|
|
|
|
|
|
Аліциклічні |
|
|
|
|
|
|
|
|
|
|
|
|
|
слабкому нагріванні: |
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CООH |
HOOC—COOH → |
|
HCOOH |
+ CO2↑ |
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
Циклогексан- |
|
|
|
|
|
|
|
|
|
|
|
Циклогексан-1,2- |
|
|
|
|
|
|
-I |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||
карбонова кислота |
|
|
|
|
|
|
|
|
|
|
|
|
дикарбонова |
Однак декарбоксилювання будь-яких кислот |
|||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
кислота |
легко здійснюється ферментативним шляхом в |
||||||||||||||||||||||||||||||||||
|
|
COOH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
COOH |
організмі. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
Ароматичні |
|
|
|
|
|
|
|
|
|
|
|
|
|
COOH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
Бензенова кислота |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Фталева кислота |
Реакції нуклеофільного заміщення |
|||||||||||||||||||||||||||||||||||||||||||||
Рис. 1.6. Класифікація карбонових кислот |
з утворенням ефірів, амідів кислот, |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
ангідридів кислот (SN) |
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Вони є найбільш характерними для карбоно- |
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
δ -- |
-M; -I |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
вих кислот. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
δ + O |
|
|
Кислотний центр |
Хімічні властивості карбонових кислот зумов- |
|||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
R |
|
|
C |
|
|
|
|
|
лені наявністю карбоксильної групи. |
|||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
O |
|
|
H +M>-I |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||
Спряження карбоксильної групи здійснюєть- |
|
|
|
|
|
|
δ - |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||
ся за рахунок делокалізації неподіленої пари |
|
|
|
|
|
|
-M; -I |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||||
δ + O |
|
Електрофільний центр |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
електронів атома Оксигену гідроксильної групи |
R |
C |
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
O |
|
|
H +M>-I |
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||
й електронів π -зв’язку карбонільної групи, тоб- |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||
то ρ ,π -зв’язку. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Найважливіша група реакцій карбонових |
||||||||||||||||||||||||||||||||
Електронна щільність у ρ ,π -сполученій сис- |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
кислот — це реакції нуклеофільного заміщення. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
темі зміщена в бік електронегативного атома Ок- |
sp2-гібридизований атом Карбону карбок- |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
сигену карбонільної групи. При такій елект- |
сильної групи завдяки електроноакцепторним |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
ронній будові зв’язок О–Н виявляється надто по- |
властивостям атома Оксигену оксогрупи має |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
ляризованим, що зумовлює появу –ОН-кислот- |
частково позитивний заряд, тобто є електрофіль- |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
ного центру. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ним центром. Він може атакуватися нуклеофіль- |
||||||||||||||||||||||||||
Карбонові кислоти значно перевершують за |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
ними частинками, внаслідок чого відбувається |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
кислотністю спирти та феноли. Завдяки повній |
заміщення гідроксильної групи в групі –СООН |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
делокалізації заряду на двох електронегативних |
на іншу нуклеофільну частинку. |
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
атомах Оксигену карбоксилатіон має значно |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||
вищу стабільність. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Реакція етерифікації |
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
При взаємодії карбонових кислот із спиртами |
|||||||||||||||||||||
|
|
|
δ |
-- |
|
|
|
|
|
+ |
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
O- |
в присутності сильних мінеральних кислот утво- |
|||||||||||||||||||||||||||||||||
|
|
|
δ + O |
|
- Н+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
R |
|
|
C |
рюються складні ефіри. |
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
|
R |
C |
|
|
|
|
|
|
|
|
|
|
R C |
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
O |
|
|
H |
|
|
|
|
|
|
|
O- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
O |
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||
|
|
Карбонова |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
|
|
кислота |
|
|
|
|
|
|
|
R |
|
C |
R |
|
C |
|
+ R'OH |
|
|
|
|
|
R |
|
C |
+ H2O |
|||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
OR |
|||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Карбоксилатіон |
Оскільки гідроксидіон (–ОН) — міцно зв’яза- |
|||||||||||||||||||||||||||||||||||||||||||
Утворення стабільних аніонів оксикислот та |
на група, то реакції нуклеофільного заміщення в |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
карбоксильній групі відбуваються в присутності |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
амінокислот можливе у фізіологічних умовах, |
кислотних каталізаторів, особливо у тих випад- |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
звідси зрозумілі назви аміно-, оксо-, оксикислот |
ках, коли використовуються слабкі нуклеофільні |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
у біохімії. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
реагенти — спирти. Для активації карбоксиль- |
|||||||||||||||||||||||
|
|
Глютамінова кислота = глутамат |
ної групи застосовують кислотний каталізатор. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
Аспарагінова кислота = аспартат |
Складний ефір утворюється не тільки зі спир- |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
Піровиноградна кислота = піруват |
ту та карбонової кислоти, але й зі спирту та кис- |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
Молочна кислота = лактат |
невмісної неорганічної кислоти (H2SO4, H3PO4). |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||
27

|
|
|
|
|
|
O |
|
|
|
|
|
|
|
O |
|
|
|||
R'OH + HO |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH + H2O |
||||
|
|
S |
|
|
OH |
|
|
|
R'O |
|
S |
|
|||||||
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
O |
|
|
|||
|
|
|
|
|
OH |
|
|
|
|
|
|
OH |
|||||||
|
+ |
|
|
|
|
|
|
|
|
|
|
|
|
R'O |
|
|
|
OH + H O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
R'OH |
HO P |
OH |
|
P |
|||||||||||||||
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
2 |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
||||
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
||||||
Численні реакції фосфорилування в біохімії можна розділити на дві групи: до однієї належать реакції, що ведуть до утворення складноефірного зв’язку, до другої — реакції утворення ангідридного зв’язку.
|
|
|
|
|
|
|
OH |
O |
|
OH |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
O |
|
P |
|
OH |
C |
O |
P OH |
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
O |
||
Складний ефір |
Ангідрид |
|||||||||||
У процесі гліколізу бере участь 1,3-бісфосфо- гліцерат, що містить складно-ефірний та ангідридний зв’язки:
O OH
C O |
|
P O |
|
|
|
Ангідридний зв’язок |
|
|
|
|
|||
CHOH |
OH |
|
||||
OH |
|
|||||
|
|
Складно-ефірний зв’язок |
||||
CH2 |
O P O |
|
|
|||
|
||||||
|
|
OH |
|
|||
Ангідриди карбонових кислот можуть містити залишки однакових кислот або бути змішаними.
|
|
O |
|
|
|
|
O |
|
|
|
O |
|
|
|
|
|
|
|
|
|
O |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R + H2O |
||
R |
|
C |
|
|
O H + HO |
|
|
C |
|
|
R |
|
|
|
R |
|
C |
|
|
|
O |
|
|
O |
|
|
C |
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ангідрид |
|||||||||||||||
|
|
|
O |
|
|
|
|
|
O H |
|
|
|
|
|
O |
|
|
|
|
|
|
O H |
||||||||||||||||
|
|
|
|
O H + HO |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
R |
|
C |
|
|
P |
|
|
O H |
|
|
|
R |
|
C |
|
O |
|
P |
|
|
O H + H2O |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ангідрид |
||||||||||||||||
Перехід карбоксилвмісних сполук в ангідридну форму становить хімічну основу активації жирних кислот, амінокислот, жовчних кислот, необхідних для участі в наступних перетвореннях.
В організмі процес активації карбоксилвмісних сполук здійснюється за рахунок утворення ациладенілатів змішаних ангідридів карбонових кислот і АТФ.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O- |
|
|
|
O- |
|
|
O- |
|
|
|
|
|
|
|
|
|
|
|
|
NH2 |
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
-O |
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
|
|
|
||||||||||
|
|
|
|
O |
|
|
|
|
P |
|
|
|
O |
|
P |
|
|
O |
|
P |
|
|
|
OCH2 |
O |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
O- |
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
R |
|
|
C |
|
|
|
O |
|
|
|
O |
|
|
O |
|
|
|
|
|
|
|
|
N |
|
N |
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||
Ацилат |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
АТФ OH OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
O- |
|
|
|
|
|
|
|
|
|
|
N |
|
NH2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
R |
|
|
C |
|
O |
|
|
P |
|
|
|
|
OCH2 O |
|
|
|
|
|
|
|
|
- |
|
|
|
|
|
|
|
- |
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
O |
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
N |
|
|
|
-O |
|
|
|
|
|
|
O- |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
H |
|
|
|
|
|
|
|
+ |
|
|
P |
|
|
|
O |
|
|
P |
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
O |
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
Ациладенілат Дифосфатіон
Ациладенілат є проміжним продуктом при утворенні тіоефірів жирних кислот (ацил-КоА):
|
|
|
|
|
O |
|
|
|
O- |
O- |
|||
RCOO- + АТФ + KoASH |
|
|
|
|
АМФ + |
-O |
|
|
|
|
|
O- |
|
|
R |
|
C |
+ |
|
P |
O P |
|
|||||
|
|
|
|
||||||||||
|
|
||||||||||||
|
|
|
|
|
SKoA |
|
|
|
O |
O |
|||
|
|
|
|
|
|
|
|
|
|||||
Утворення амідів кислот залежно від ступеня заміщення у атома Нітрогену можуть бути первинними — RCONH2, вторинними — RCONHR′ і третинними — RCONR′R′′.
Амід кислоти
|
|
|
|
|
|
|
|
O |
|
|
|
O + NH3 |
|
|
R |
|
C |
+ H2O |
|
|
|
|
|
||||||
|
|
|
|
|
|
|
NH2 |
|
|
R |
|
C |
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
||
|
|
OH + NH2R |
|
|
|
|
|
|
|
|
|
|
|
R |
|
C |
+ H |
O |
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
NHR |
|
N-заміщений амід (вторинний)
Конденсація Кляйзена характерна для по-
хідних карбонових кислот складних ефірів і тіоефірів:
|
|
|
|
O |
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
||
|
|
2CH3 |
|
C |
|
|
CH3 |
|
C |
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
OC H |
5 |
|
|
|
CH2 |
|
|
O |
|
C2H5 |
|
|||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
O |
|
|
|
O |
|
|
|
O - |
O |
|||||||||
|
|
|
+ CH |
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|||||
CH |
|
C |
|
|
C |
|
|
|
C |
|
CH2 |
|
C |
|
||||||
|
|
|
|
|
|
|
|
|
||||||||||||
3 |
|
OC H |
2 |
|
OC H |
|
|
|
|
|
|
|
|
|
|
|
OC2H5 |
|||
|
|
5 |
|
|
|
|
|
OC2H5 |
||||||||||||
2 |
|
|
2 5 |
|
|
|
|
|||||||||||||
O O
 CH3 C CH2 C OC2H5
CH3 C CH2 C OC2H5
Ацетооцтовий ефір
Процес β -окиснення жирних кислот включає реакцію, зворотну конденсації Кляйзена, в якій коензим А заміщає ацетилкоензим А, і утворюється жирна кислота, що містить на два атоми Карбону менше вихідної.
Будова і властивості дикарбонових кислот
До дикарбонових кислот належать сполуки з двома карбоксильними групами. Це білі кристалічні речовини, які мають більш кислий характер, ніж монокарбонові кислоти. У міру віддалення електроноакцепторних груп (–СООН) одна від одної сила кислоти в ряді помітно зменшується: щавлева — малонова — бурштинова кислоти.
Кислотні властивості. Порівняно з монокар-
боновими кислотами дикарбонові кислоти мають сильніші кислотні властивості. Висока кислотність більш низьких дикарбонових кислот пояснюється сильною електроноакцепторною дією другої карбоксильної групи, яка сприяє делокалізації негативного заряду на аніоні, який утворився після відриву протона.
O |
|
O |
||
HOOC C |
|
|
|
HOOC C + H+ |
|
|
|||
O H |
|
O- |
||
Щавлева кислота |
Гідроксалатіон |
|||
28
