
Біологічна та біоорганічна хімія_Мардашко О.О._ изд. 2008-342 с._ОНМедУ-2012
.pdf
Таблиця 1.1. Функціональні групи та класи
|
|
|
|
|
|
Функціональна |
|
Загальна |
|||
|
|
|
|
|
|
Клас |
формула |
||||
|
|
|
|
|
|
|
|
|
група |
||
|
|
|
|
|
|
|
|
|
|
класу |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
–F, –CI, –Br, –I |
Галогенопохідні |
R–HaI |
|||||||||
–(Hal) — галогени |
|
|
|||||||||
–ОН — гідроксильна |
Спирти, феноли |
R–OH |
|||||||||
–OR — алкоксильна |
Прості ефіри |
R–OR |
|||||||||
–SH — тіольна |
Тіоли |
R–SH |
|||||||||
|
|
|
|
|
|
|
|
|
|
(меркаптани) |
|
–NH2 — аміно- |
Аміни |
R–NH2 |
|||||||||
|
|
|
|
|
|
|
O |
— нітро- |
Нітросполуки |
R–NO2 |
|
|
|
|
|
|
N |
|
O |
||||
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
O — карбонільна |
Альдегіди, |
R–CH=O |
|||||
|
|
|
|
|
|
|
|
|
|
кетони |
|
|
|
|
C |
O |
— карбо- |
Карбонові |
R–CO–R′ |
||||
|
|
|
OH |
ксильна |
кислоти |
|
|||||
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH — сульфо- |
Сульфокислоти |
R–SO3H |
|
|
|
|
|
|
S |
|
|
||||
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
вуглеводнів, отримані введенням у них функціональних груп.
Функціональна група — це атом або група атомів невуглецевого характеру, які визначають приналежність сполуки до певного класу
(табл. 1.1).
Ознакою, за якою органічні сполуки належать до тих чи інших класів, є природа функціональної групи. Наприклад, якщо в етані СН3–СН3, що належить до класу вуглеводнів, замінити один з атомів Гідрогену на гідроксильну групу ОН, то отримана сполука етанол СН3–СН2ОН належатиме до класу спиртів; якщо ж в етан ввести замість атома Гідрогену атом Хлору, то отримана сполука хлоретан СН3–СН3Сl належатиме до класу галогенопохідних.
Сполуки можуть містити не одну, а кілька функціональних груп. Якщо ці групи однакові, то сполуки називаються поліфункціональними (наприклад, хлороформ, гліцерин). Сполуки, що містять різні функціональні групи, називаються
гетерофункціональними. Їх можна одночасно віднести до кількох класів (наприклад, молочну кислоту можна розглядати як кислоту і як спирт, а коламін — як амін і як спирт).
CHCl3 |
CH |
|
CH |
|
CH |
||||||
|
|
||||||||||
|
|
|
2 |
|
|
|
|
|
|
|
2 |
|
|
|
|||||||||
|
OH |
|
OH OH |
||||||||
Хлороформ |
|
|
Гліцерин |
||||||||
CH3 CH COOH |
H2NCH2 |
|
CH2OH |
||||||||
|
|||||||||||
OH |
|
|
|
|
|
|
|
|
|
|
|
Молочна кислота |
|
|
Коламін |
||||||||
Номенклатура, або спосіб найменування сполук, є «хімічною мовою», що служить для передачі будови сполук. Першими в органічній хімії з’явилися тривіальні (від лат. trivialis — звичайний) назви. Їх давали речовинам, структура
яких навіть не була відома. Тривіальні назви вказували або на джерело їхнього виділення (так, сечовина вперше була виявлена в сечі), або на деякі помітні властивості (наприклад, назви речовин гліцерин, глюкоза, гліцин пов’язані з їхнім солодким смаком (від грецьк. glykys — солодкий). Тривіальні назви поширені серед природних сполук — амінокислот, вуглеводів, алкалоїдів, стероїдів. Ці назви зручні своєю лаконічністю, але вони не можуть бути об’єднані в систему.
Сучасна номенклатура має бути систематичною та міжнародною, щоб фахівці всього світу могли відобразити в назві структуру сполуки й, навпаки, за назвою однозначно уявити структуру. До того ж, сучасна номенклатура має бути придатною для комп’ютерної обробки. Сьогодні визнана систематична номенклатура ІЮПАК (IUPAC — Міжнародна спілка теоретичної та прикладної хімії). Щоправда, для складних за структурою сполук систематичні назви бувають іноді занадто громіздкими, тому для зручності в систематичній номенклатурі допускається вживання деяких найбільш усталених тривіальних назв. Номенклатурні правила ІЮПАК видані англійською мовою. При перекладі на українську мову вони адаптовані з урахуванням її особливостей та традицій української термінології.
Серед варіантів систематичних номенклатур, рекомендованих ІЮПАК, найпоширенішою є
замісна номенклатура. Сама назва номенклату-
ри показує, що в сполуці виділяється якась основа, у якій зроблене заміщення атомів Гідрогену на інші атоми або групи. У систематичній номенклатурі ІЮПАК використовують кілька найважливіших номенклатурних термінів: родоначальна структура, замісник, характеристична група.
Родоначальна структура — це структура, що лежить в основі названої сполуки. Для ациклічних сполук за родоначальну структуру приймається головний вуглецевий ланцюг, а для карбоциклічних і гетероциклічних — цикл.
Назви головних вуглецевих ланцюгів або циклів формуються на основі номенклатури вуглеводнів. Так, у молекулі спирту CH3CH2CH2OH головний вуглецевий ланцюг складається з трьох атомів Карбону, і відповідно родоначальна структура називатиметься «пропан», а в молекулі кислоти СН3СООН головний вуглецевий ланцюг складається з двох атомів Карбону, тому назва родоначальної структури — «етан». Втім, для зазначеної кислоти допустима і тривіальна назва «оцтова кислота».
Замісник — це будь-який атом або група атомів, що заміщають атом Гідрогену в родоначальній структурі.
Характеристична група — це функціональна група, пов’язана з родоначальною структурою.
Замісниками у родоначальній структурі можуть бути як функціональні групи (див. табл. 1.1), так і вуглеводневі радикали. Вуглеводневі радикали — це залишки вуглеводнів, які містять на один атом Гідрогену менше. Назви радикалів походять від назв відповідних вуглеводнів шля-
9
хом заміни суфіксу -ан на -іл, наприклад, метил
— СН3–, етил — СН3СН2–. Однак із пропану утвориться вже два радикали: пропіл та ізопропіл. Слід звернути увагу, що радикал С6Н5–, утворений з бензену, називається феніл, а не бензил. Бензильним називається радикал С6Н5СН2–, утворений з толуену (толуолу).
|
CH3 |
CH– |
CH3CH2CH2– |
CH3 або (CH3)2CH– |
|
Пропіл |
|
Ізопропіл |
|
|
CH2– |
Фенол Бензил
Як утворюється систематична назва сполуки? У замісній номенклатурі — це складне слово, яке містить назву родоначальної структури. Назви замісників позначаються префіксами (приставками) і суфіксами.
Для побудови назви, в першу чергу, визначають тип характеристичної групи (якщо вона наявна). Коли характеристичних груп у сполуці кілька, то виділяють старшу з них. Для характеристичних груп прийнято порядок по убуванню старшинства. Потім визначають родоначальну структуру, до якої обов’язково входить старша характеристична група. Деякі характеристичні групи, а саме: галогени, нітро- і алкоксигрупи, відображуються в загальній назві тільки у вигляді префіксів, наприклад, бромметан, етоксіетан, нітробензен.
NO2
CH3Br– CH3CH2OCH2CH3
Бромметан Етоксіетан Нітробензен
Більшість характеристичних груп може входити до загальної назви у вигляді як суфікса, так і префікса. Старша характеристична група відображується суфіксом, решта (нестарші) — префіксами. Якщо сполука монофункціональна, то характеристична група, для якої передбачений суфікс, завжди виконує роль старшої, вона відображується в назві суфіксом (наприклад, пропанол СН3СН2СН2ОН, етанова кислота СН3СООН) (табл. 1.2).
У гетерофункціональних сполуках тільки одна з характеристичних груп — старша — позначається суфіксом. Всі інші замісники позначаються префіксами та наводяться за алфавітом. При цьому потрібно вказати місце розташування замісників у вуглецевому ланцюзі. Для цього слід попередньо провести нумерацію атомів родоначальної структури. Вуглецевий ланцюг нумерується з одного з її кінців так, щоб старша характеристична група дістала найменший номер. Цифри, які вказують положення замісників, став-
Таблиця 1.2
Префікси та суфікси для позначення деяких характеристичних груп
Характерис- |
Префікс |
Суфікс |
|
тична група |
|||
|
|
||
|
|
|
|
–(С)ООН |
– |
-ова кислота |
|
–СООН |
Карбокси- |
-карбонова кислота |
|
–SO3H |
Сульфо- |
-сульфокислота |
|
–(C)H=O |
Окси- |
-аль |
|
–CH=O |
Форміл- |
-карбальдегід |
|
C=O |
Оксо- |
-он |
|
–OH |
Гідрокси- |
-ол |
|
–SH |
Меркапто- |
-тіол |
|
–NH2 |
Аміно- |
-амін |
|
–NO2 |
Нітро- |
– |
|
–OR |
Алкокси- |
– |
|
F, Cl, Br, I |
Фтор-, хлор-, |
|
|
(Hal) |
бром, йод |
– |
|
|
(галоген-) |
|
|
|
|
|
лять перед префіксами та після суфікса. Цифри від букв відділяються дефісами (рисками), а цифри від цифр — комами.
Так, коламін має систематичну назву 2-амі- ноетанол, а не 2-гідроксіетанамін, оскільки гідроксильна група старша за аміногрупу:
Родоначальна |
Старша характери- |
структура: етан |
стична група: -ол |
2 1
H2N CH2 CH2 OH
Нестарша характерис- 2-Аміноетанол (триві-
тична група: альна назва — коламін) аміно-
З цієї же причини систематична назва молочної кислоти — 2-гідроксипропанова кислота. Тут карбоксильна група старша за гідроксильну:
Родоначальна |
|
|
|
|
|
|
|
|
Старша характе- |
структура: |
|
|
|
|
|
|
|
|
ристична група: |
пропан |
3 |
2 |
|
1 |
1 |
|
-ова кислота |
||
|
|
|
|
|
|
|
|
||
Нестарша ха- |
CH3 |
|
|
CH |
|
COOH |
|
||
|
|
|
|||||||
|
|
|
|
||||||
|
|
|
OH |
|
|
|
|
||
рактеристична |
2-Оксипропанова кислота (триві- |
||||||||
група: окси- |
альна назва — молочна кислота) |
||||||||
Для закінчень -ова кислота й -аль немає необхідності вказувати положення функціональної групи (в атома С-1), тому що вони завжди розміщуються на початку ланцюга. Дуже часто опускається й цифровий показник для закінчення -ол, якщо група ОН перебуває в крайнього атома Карбону (наприклад пропанол СН3СН2СН2ОН), хоча коректніша назва цього спирту — пропанол-1 (щоб відрізнити його від ізомеру — пропанолу-2).
За наявності двох, трьох, чотирьох і т. д. однакових замісників або кратних зв’язків використовують помножувальні префікси ди-, три-, тетра- і т. д., наприклад етанол-1,2, трихлоретаналь.
HOCH2CH2OH |
Cl3C–CH=O |
Етандіол-1,2 (тривіальна |
Трихлоретаналь (триві- |
назва — етиленгліколь) |
альна назва — хлораль) |
10

Для трихлоретаналю вказувати положення атомів Хлору не потрібно, тому що при розташуванні одного з атомів Хлору при атомі С-1 сполука вже не міститиме характеристичної групи
–СН=О, тобто не належатиме до класу альдегідів. У карбоциклічних сполуках нумерацію починають від того атома Карбону, при якому перебуває старша характеристична група. Якщо при цьому неможливо застосувати однозначну нумерацію, то цикл нумерують так, щоб замісники мали найменші номери. Розглянемо назви циклічних структур на прикладах ментолу та
саліцилової кислоти.
|
|
|
|
|
Родоначальна структура |
|
6 |
|
COOH |
|
|
із старшою характерис- |
|
|
|
|
тичною групою: бензойна |
|||
5 |
1 |
|
|
|||
|
|
|
|
|
кислота |
|
|
|
|
|
|
|
|
4 |
2 |
|
|
|
|
|
3 |
OH |
|
|
|
Нестарша характе- |
|
|
|
|
|
|
|
ристична група |
2-Оксибензенова кислота (тривіальна |
||||||
|
назва — саліцилова кислота) |
|||||
|
|
|
|
CH3 |
Родоначальна струк- |
|
|
|
|
|
тура: циклогексан |
||
Вуглеводневі ра- |
|
5 |
|
|||
4 |
6 |
|
||||
дикали: ізопропіл, |
|
|
||||
3 |
|
1 |
|
|||
метил |
|
2 |
|
|||
|
|
OH |
||||
|
|
|
|
CH |
Характеристична |
|
|
|
|
H3C |
|
CH3 |
група: -ол |
|
2-Ізопропіл-5-метилциклогексанол |
|||||
|
(тривіальна назва — ментол) |
|||||
|
|
|
|
CH2COOH |
||
Фенілоцтова (або фенілетанова) кислота
У разі наявності в структурі сполуки одночасно відкритого ланцюга та циклу за родоначальну структуру приймається та, де міститься характеристична група (або старша з них). Наприклад, у фенілоцтовій кислоті родоначальною структурою вважається ланцюг із двох атомів Карбону, тому що в ній міститься карбоксильна група.
Таким чином, загальне правило складання повної назви сполуки можна представити у вигляді такої схеми:
|
|
|
Назва сполуки |
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Префікси |
|
Родоначальна |
Суфікс |
|||||
|
структура |
|||||||
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Вуглеводневі |
|
Головний лан- |
|
Тільки |
||||
радикали та |
|
цюг, основна цик- |
|
старша |
||||
нестарші |
|
лічна або гетеро- |
|
характе- |
||||
характеристичні |
|
циклічна |
|
ристична |
||||
групи |
|
структура |
|
група |
||||
|
|
|
|
|
|
|
|
|
Зворотне завдання — написання структури за систематичною назвою — є зазвичай простішим. Спочатку зображують родоначальну структуру — відкритий ланцюг або цикл, потім нумерують атоми Карбону і розставляють замісники. На закінчення дописують атоми Гідрогену таким чином, щоб кожний атом Карбону мав валентність чотири.
Розглянемо це на прикладі побудови формули 2-амінопентандіової кислоти (тривіальна назва — глутамінова кислота).
Головний вуглецевий |
1 |
2 |
3 |
4 |
5 |
||||||||
ланцюг і нумерація |
|
C—C—C—C—C |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Розташування замісників |
1 |
2 |
|
3 |
|
4 |
|
5 |
|||||
(дві групи СООН) і |
HOOC |
|
|
C |
|
C |
|
C |
|
COOH |
|||
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
група NH2 у атома С-2 |
|
|
|
|
|
NH2 |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Доповнення атомами |
HOOC CH |
|
|
|
CH2 |
CH2 |
COOH |
||||||
|
|
||||||||||||
Гідрогену |
|
|
|
|
|
|
|
||||||
NH2 |
|
|
|
|
|
||||||||
Цілком очевидно, що уявити структуру тільки за тривіальною назвою — завдання дуже складне.
Крім замісної номенклатури інколи викорис-
товується радикально-функціональна номенкла-
тура, що є також варіантом систематичної номенклатури ІЮПАК. Частіше вона застосовується для галогенопохідних, спиртів, амінів і простих ефірів. Для деяких класів сполук, наприклад, карбонових кислот і альдегідів, ця номенклатура незастосовна.
Назва сполуки за радикально-функціональ- ною номенклатурою складається з двох елементів
— назви вуглецевого радикала та назви характеристичної (функціональної) групи або відповідного класу сполук. Нижче наведено приклади назв за радикально-функціональною номенклатурою.
CH3l |
CH3CH2CH2OH |
Метилйодид |
Пропіловий спирт |
CH3CH2OCH2CH3 |
CH3CH2NH2 |
Діетиловий спирт |
Етиламін |
Теорія будови органічних сполук
О. М. Бутлерову вдалося створити логічно завершену теорію будови органічних сполук, яка і донині є науковою основою органічної хімії. Ця теорія базується на матеріалістичному підході до реальної молекули і виходить із можливості пізнання її будови експериментальним шляхом. О. М. Бутлеров при встановленні будови речовин надавав основного значення хімічним реакціям. Теорія будови О. М. Бутлерова не тільки пояснювала вже відомі факти, її наукове значення полягало в прогнозуванні існування нових органічних сполук.
11

Основні положення теорії будови органічних сполук:
1)атоми в молекулах з’єднані між собою хімічними зв’язками відповідно до їх валентності;
2)атоми в молекулах органічних речовин з’єднуються між собою в певній послідовності, що визначає хімічну будову молекули;
3)властивості органічних сполук залежать не тільки від кількості та природи атомів, що входять до їх складу, але й від хімічної будови молекул;
4)у молекулах існує взаємний вплив атомів
—як зв’язаних, так і безпосередньо не зв’язаних між собою;
5)хімічну будову речовини можна визначити в результаті вивчення її хімічних перетворень і, навпаки, за будовою речовини можна охарактеризувати її властивості.
Важливим наслідком теорії будови був висновок, що кожна органічна сполука повинна мати одну хімічну формулу, яка відображає її будову. Для зображення будови органічних сполук використовують формули будови (структурні формули).
Структурна (графічна) формула — це зобра-
ження послідовності зв’язків атомів у молекулі. У структурних формулах органічних сполук кожний хімічний зв’язок позначається рискою між хімічними символами атомів, що зв’язуються. Наприклад, для метилового спирту (метанол) можна представити лише одну можливу послідовність зв’язків з урахуванням валентності атомів, що зв’язуються, у вигляді такої формули:
H
H C O H
H
Метанол (або скорочено — СH3OH)
Для спрощення формул і прискорення їхнього написання зв’язки (риски) між атомами Карбону та Гідрогену звичайно опускаються і символи атомів Гідрогену пишуться разом із символами атомів Карбону, з якими вони зв’язані.
Якщо для сполуки CH4O можливий єдиний варіант послідовності зв’язку атомів, то для сполуки С2Н6О таких варіантів може бути два. Інакше кажучи, одному хімічному складу відповідатимуть дві різні органічні сполуки, що відрізняються будовою, тобто послідовністю зв’язку атомів. Такими сполуками будуть етиловий спирт (рідка речовина) і диметиловий ефір (газоподібна речовина), що відрізняються фізичними й хімічними властивостями.
|
|
H |
|
H |
|
|
H |
|
|
|
H |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
C |
|
C |
|
O |
|
H |
H |
|
C |
|
O |
|
C |
|
H |
||||
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
H |
|
|
H |
|
|
|
H |
||||||||||
СH3СH2OH |
СH3OСH3 |
||||||||||||||||||||
Етиловий спирт |
Диметиловий ефір |
||||||||||||||||||||
(т. кип. — 78 °С) |
(т. кип. — 24 °С) |
||||||||||||||||||||
На цьому прикладі можна легко переконатися в прояві дії одного з основних положень теорії будови — залежності властивостей речовин не тільки від складу сполуки, але й від будови молекул. Цей приклад ілюструє сутність властиво-
го органічним сполукам найважливішого явища
— ізомерії, тобто можливості існування кількох речовин із різними властивостями, які мають при цьому той самий склад та однакову молекулярну масу. Явище ізомерії відоме давно (1830), але воно не могло бути пояснене на той час жодною з існуючих теорій. Тільки теорія будови О. М. Бутлерова дала явищу ізомерії просте та вичерпне пояснення. Крім того, теорія будови змогла відповісти на питання, чому в ізомерів при зміні будови відбувається зміна хімічних властивостей. Це пояснюється тим, що зміна будови, тобто послідовності зв’язування атомів, позначається переважно на зміні характеру взаємного впливу атомів у молекулі.
Вчення про взаємний вплив атомів у молекулі в подальшому було розвинене учнем О. М. Бутлерова — В. В. Марковніковим. Воно активно розвивалося, сповнювалося новим змістом, і в сучасній органічній хімії питання взаємного впливу атомів у молекулі є центральними при розв’я- занні найважливіших проблем, пов’язаних з оцінкою реакційної здатності органічних сполук.
Ізомерія органічних сполук
Важливий вплив на реакційну здатність сполук чинить їх будова. Ще Берцеліус (1830) запропонував новий термін «ізомерія» для сполук, які за однакового хімічного складу й однакової молекулярної маси виявляли різні властивості. Грунтовніше розуміння структури ізомерних сполук належить О. М. Бутлерову, який сформулював основні принципи сучасної структурної теорії (1861).
Ізомери — це хімічні сполуки ідентичних молекулярних мас і однакового складу, але різної будови, що визначає їх різні фізико-хімічні властивості.
У 70-х роках ХІХ ст. теорія будови доповнилася теорією просторового розміщення атомів у молекулі — стереохімічною теорією (ВантГофф, Ле Бель).
Всі ізомери поділяються на два великі класи —
структурні та просторові (рис. 1.1).
|
|
|
|
|
|
|
|
|
|
Ізомери |
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Структурні |
|
|
|
|
|
|
|
|
Стереоізомери |
|
||||||||||||
|
|
ізомери |
|
|
|
|
|
|
(просторові ізомери) |
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ізомери |
|
|
|
Ізомери |
|
|
|
Конфор- |
|
Конфігу- |
||||||||||||||
вуглецево- |
|
|
поло- |
|
|
|
маційні |
|
раційні |
|||||||||||||||
го скелета |
|
|
ження |
|
|
|
ізомери |
|
ізомери |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
кратних |
|
|
положен- |
|
|
|
Цис-, транс-, |
|
|
Оптичні |
||||||||||||||
|
ня гетеро- |
|
|
|
|
|
||||||||||||||||||
зв’язків |
|
|
|
атома |
|
|
|
син-, анти- |
|
|
ізомери, |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
(геомет |
|
енантіомери, |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ричні |
|
|
діастерео- |
||||||
|
|
|
|
|
|
|
функціо- |
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
ізомери) |
|
|
мери |
||||||||||||
|
|
|
|
|
|
|
нальних |
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
груп |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
Рис. 1.1. Класифікація ізомерів |
|||||||||||||||||||
12

Структурними називаються ізомери з різним |
|
|
|
|
С3Н6О |
|
|
|
|
|
|
|||||||||
порядком сполучення атомів. |
|
|
|
|
|
|
|
|||||||||||||
Просторовіізомери відрізняються положенням |
CH3 CH2 C O |
|
|
O |
||||||||||||||||
атомів у просторі при однаковому порядку їх спо- |
|
|
|
|
|
CH3 |
|
|
|
|
CH3 |
|||||||||
|
|
|
|
H |
|
C |
|
|||||||||||||
|
|
|
|
|
|
|||||||||||||||
лучення. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
І. Структурна ізомерія |
|
|
|
|
|
|
Пропаналь (альдегід) |
Пропанон (кетон) |
||||||||||||
Причини утворення структурних ізомерів |
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||
поділяють таким чином: |
|
|
|
|
|
|
Особливим випадком ізомерії між класами є |
|||||||||||||
1. Ізомерія ланцюга (вуглецевого скелета) по- |
таутомерія (динамічна ізомерія). Це явище по- |
|||||||||||||||||||
лягає в тому, що речовини одного складу розріз- |
лягає в тому, що два або кілька структурних |
|||||||||||||||||||
няються порядком зв’язку атомів, які утворюють |
ізомерів за певних умов легко взаємно перехо- |
|||||||||||||||||||
скелет молекули. |
|
|
|
|
|
|
дять з переносом будь-якої рухливої групи та |
|||||||||||||
Найчастіше це спостерігається у вуглеводнів |
відповідним перерозподілом електронної щіль- |
|||||||||||||||||||
із відкритим ланцюгом, якщо n≥ 4: |
|
|
|
|
|
ності. |
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
Таутомерія, пов’язана з перенесенням атома |
|||||||||||
|
|
|
|
|
|
CH3 |
|
Гідрогену (або протона), є прототропною тау- |
||||||||||||
CH3 CH2 CH2 CH3 |
1 |
2 |
|
|
3 |
томерією. Вона спостерігається для сполук із |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
CH3 |
|
|
CH |
|
CH3 |
відкритим ланцюгом і циклічних. |
|||||||||||
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||
н-Бутан 2-Метилпропан
Кількість ізомерів такого типу дуже швидко збільшується зі зростанням кількості n атомів Карбону.
n |
Кількість ізомерів |
4 |
2 |
5 |
3 |
6 |
5 |
7 |
9 |
15 |
4347 |
2. Ізомерія положення:
а) Ізомерія положення функціональних груп зумовлена тим, що при одному вуглецевому скелеті функціональна група зв’язана з різними вуглецевими атомами Карбону:
|
|
Cl |
|
3 |
2 |
1 |
||||
1 |
2 |
|
|
3 |
CH3 |
|
CH2 |
|
CH2Cl |
|
CH3 |
|
|
CH |
|
CH3 |
|
|
|||
|
|
|||||||||
Кільцево-ланцюгова прототропна таутомерія
а) лактимлактамна:
|
O |
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
C |
C2H5 |
|
|
Н |
|
|
|
C |
C2H5 |
|
|
|
|
|
|
|
||||||
|
N |
C |
|
|
|
N |
C |
||||
|
|
C2H5 |
|
|
|
|
|
|
|
|
C2H5 |
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|||
|
C |
C |
|
|
HO |
C |
C |
||||
O |
N |
O |
|
|
|
|
|
N |
O |
||
H |
|
|
|
|
|
|
H |
|
|||
|
|
|
|
|
|
|
|
|
|
||
Лактамна форма |
|
|
Лактимна форма |
||||||||
Люмінал (фенобарбітал)
б) кето-енольна:
|
O |
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
H |
C |
|
|
|
|
|
|
|
|
|
|
|
C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
H |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
N |
|
CH2 |
|
|
|
|
|
N |
|
C |
||||||||
|
|
|
|
|
||||||||||||||
C |
|
C |
|
|
|
|
C |
|
C |
|||||||||
|
|
|
|
|
||||||||||||||
O |
N |
|
|
O |
|
|
|
|
O |
N |
|
|
OH |
|||||
|
H |
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
2-Хлорпропан 1-Хлорпропан
CH3 |
|
|
CH |
|
CH2CI |
|
|
||||
|
|
|
|
|
H2N CH2 CH2 COOH |
|
|
|
|
|
|
|
|
NH2 |
|||
α -Аланін β -Аланін
б) Ізомерія положення кратних зв’язків:
4 |
3 |
2 |
1 |
4 |
3 |
2 |
1 |
1 |
|||||
CH3 |
|
CH2 |
C |
|
CH |
CH3 |
|
C |
|
C |
|
CH3 |
|
|
|
|
|||||||||||
|
|
|
|
|
|||||||||
|
|
|
|||||||||||
Кето-форма |
Енольна форма |
Барбітурова кислота
в) азольна таутомерія молекули імідазолу:
N 3 |
|
4 |
CH3 |
|
|
|
||||
2 |
1 |
5 |
|
|
|
|
H N |
1 |
5 |
CH3 |
|
|
|
|
|
|
2 |
|
|||
|
N |
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
|
3 |
|
||
N
H
Бутин-1 |
Бутин-2 |
4-Метилімідазол |
5-Метилімідазол |
||||||
в) Ізомерія положення гетероатомів у лан- |
ІІ. Стереоізомерія (просторова ізомерія) тра- |
||||||||
цюзі: молекули однакового атомного складу ма- |
диційно поділяється на конфігураційну та кон- |
||||||||
ють різні функціональні групи (належать до |
фірмаційну (див. рис. 1.1). |
|
|||||||
різних класів): |
|
|
|
|
|
1. Конфігураційна ізомерія поділяється на гео- |
|||
|
|
|
С2Н6О |
метричну (цис-, транс-) та оптичну ізомерію. |
|||||
|
Розташування атомів відносно певних пло- |
||||||||
CH3 |
|
CH2OH |
CH3 |
|
O |
|
CH3 |
щин, які проходять через певні зв’язки, назива- |
|
|
|
|
|||||||
Етанол |
Диметиловий ефір |
ють конфігурацією молекули. |
|||||||
а) Цис-, транс-ізомерія алкенів зумовлена на- |
|||||||||
(спирт) |
(простий ефір) |
явністю в молекулі подвійного зв’язку (π -зв’язку) |
|||||||
13
та різним положенням замісників відносно площини π -зв’язку. Більшість алкенів можуть існувати у вигляді цис- і транс-ізомерів.
Наприклад, бутендіова кислота
HOOC CH CH COOH
CH COOH
відома у двох формах цис- і транс-:
H |
|
|
C |
|
COOH |
H |
|
C |
|
COOH |
|||
|
|
|
|
|
|||||||||
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
COOH |
HOOC |
|
C |
|
|
H |
|||
|
|
|
|
|
|||||||||
цис-форма |
транс-форма |
||||||||||||
Малеїнова кислота |
Фумарова кислота |
||||||||||||
У цис-ізомері (малеїнова кислота) два об’ємних замісники — карбоксильні групи (-СООН)
—розташовані по один бік площини π -зв’язку,
а у транс-ізомері (фумарова кислота) ці замісники розташовані по різні боки площини π - зв’язку.
Фотоізомеризація цис-, транс-алкенів має важливе фізіологічне значення. Порушення світлового перетворення фумарової кислоти на малеїнову при дефіциті ферментів спричинює важко виліковне шкірне захворювання — псоріаз.
Цис-, транс-фотоізомерія лежить в основі фоторецепції. Одного кванту видимого світла достатньо для того, щоб молекула транс-ретиналю
—сполуки, яка знаходиться у зоровому рецепторі, перетворилася на цис-ретиналь.
CH3 |
CH3 |
H3C CH3 |
|
O
CH3
Транс-ретиналь
H3C CH3 CH3
СН3 |
H3C |
O |
|
Цис-ретиналь
Це, в свою чергу, зумовлює каскад послідовних біохімічних перетворень, у результаті чого формується відповідний нервовий імпульс.
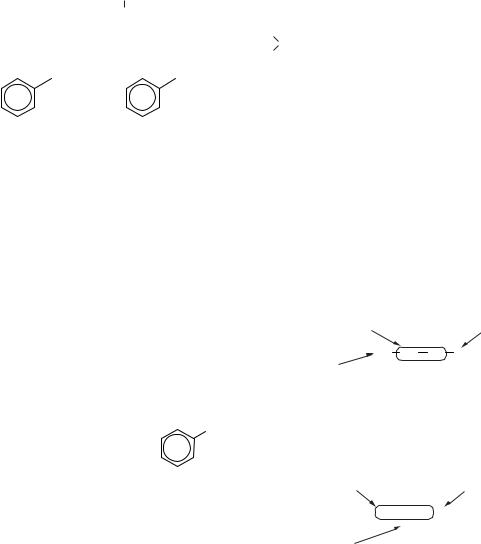
Для циклоалканів характерна просторова ізомерія, пов’язана з різним розташуванням замісників відносно площини циклу. При їхньому розміщенні по одну сторону площини циклу утворюється цис-ізомер; при розміщенні по різні сторони площини циклу — транс-ізомер.
Цис- і транс-ізомери циклоалканів — це самостійно існуючі сполуки. Вони не можуть взаємно перетворюватися, бо для такого перетворення був би необхідний розрив кільця.
CH3 CH3 |
CH |
|
3 |
CH3
Цис-1,2-диметил- Транс-1,2-диметил- циклогексан циклогексан
Прикладом біохімічно значущого явища цис-, транс-ізомерії циклоалканів є молекула інозиту, що має набір із 8 геометричних ізомерів, однак у природі найбільш розповсюджений один із них — моноінозит.
OH
OH
OH
OH
OH OH
Моноінозит
Молекула кокаїну спричинює у 85 раз сильнішу наркотичну дію, ніж молекула його стереоізомеру — псевдококаїну.
CH3OOC |
|
OCOC6H5 |
|
|
|
|||||||
|
N |
|
|
|
CH3OOC |
|
OCOC6H5 |
|||||
|
|
|
|
|
||||||||
|
|
|
|
|
N |
|
|
|||||
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
||
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
Кокаїн (транс-ізомер) Псевдококаїн (цис-ізомер)
Особливим випадком ізомерії є син-анти-ізо-
мерія, яка аналогічна цис-транс-ізомерії, але по-
в’язана з розміщенням замісників відносно C=N– або –N=N–-зв’язку.
Наприклад, для оксиму бензенового альдегіду відомі дві форми:
|
|
N |
|
|
OH |
|
|
N |
|
|
OH |
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
C6H5 |
|
C |
|
H |
H |
|
C |
|
C6H5 |
||
|
|
|
|
||||||||
анти-форма син-форма
б) Одним із видів просторової ізомерії єоптич-
на ізомерія.
Якщо плоскополяризований промінь світла спрямувати на розчини деяких сполук або на деякі кристали, то після його виходу з розчину площина поляризації може відхилитися вправо або вліво. Сполуки, які відхиляють площину поляри-
зації, дістали назву оптично активних сполук. Луї Пастер, вивчаючи під мікроскопом змішану калійамонійну сіль винно-кам’яної кислоти (1860),
O O
C СН СН C
K O OH OH O NH4
виявив кристали двох типів, які відрізняються між собою тільки розміщенням площин поляризації світла, тобто вони відносяться один до одного як предмет і його відбиття в плоскому дзеркалі. Такі кристали були оптично активними, але відхиляли плоскополяризований промінь у різних напрямках.
ВантГофф і Ле Бель незалежно і майже водночас (1874) виявили, що всі оптично активні речовини відомої будови містять у своїх молекулах
14

хоча б один атом Карбону, зв’язаний з чотирма різними групами. Такі атоми називають хіральними. Оптичну активність має, наприклад, 2-гідроксипропанова (молочна) кислота.
H |
|
|
СН C* |
COOH |
|
3 |
|
|
OH |
|
|
Молочна кислота |
|
|
С* — хіральний атом (від грец. χδιροζ |
(хірос) |
|
—рука).
Більшість оксикислот (молочна, яблучна, вин-
на) мають хіральний атом (Карбону), внаслідок чого для них характерна оптична ізомерія.
За наявності в молекулі хірального атома Карбону можливе існування двох оптичних ізомерів (енантіомерів), що належать до різних генетичних рядів (D- i L-) і співвідносяться між собою як предмет і несумісне з ним дзеркальне відображення.
Е. Фішер (1891) і Розанов (1906) запропонували користуватися як моделями порівняння D (+) і L (–) гліцериновими альдегідами (від лат. dexter
— правий, laevus — лівий).
Амінокислота треонін має два центри хіральності, отже, повинна мати 4 ізомери (22).
|
|
|
|
|
|
|
CH3 |
|
|
* |
CH |
*CH COOH |
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
OH NH2 |
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
Треонін |
|
|
|
|
|
|
|
|
||||
|
COOH |
|
|
|
COOH |
|
COOH |
|
|
COOH |
||||||||||||||
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
||||||||||||||||||
H |
|
|
NH2 |
|
NH2 |
|
|
|
H |
|
|
|
|
NH2 |
|
|
H |
|
H |
|
|
|
NH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HO |
|
H |
|
|
|
2 |
|||
HO |
|
|
H |
|
H |
|
|
|
OH |
|
|
|
|
|
|
H |
|
|
|
OH |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|||||||||||||||||||
|
CH3 |
|
|
|
CH3 |
|
|
|
|
|
|
CH3 |
|
|
CH3 |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
дзеркало |
|
|
|
|
|
|
|
|
|
|
|
дзеркало |
|
|
|
|
|||||
|
І |
|
ІІ |
|
|
|
|
|
|
ІІІ |
|
|
|
IV |
||||||||||
D-треонін L-треонін |
|
|
L-ало-треонін D-ало-треонін |
|||||||||||||||||||||
|
||||||||||||||||||||||||
|
|
Енантіомери |
|
|
|
|
|
|
|
|
|
|
Енантіомери |
|
|
|
|
|||||||
Енантіомери І і ІІ мають однакові фізичні та хімічні властивості, але протилежні знаки обертання площини поляризації світла. Аналогічно енантіомери ІІІ та IV (від. грецьк. allos — інший) відрізняються тільки знаком кута обертання. D-треонін (І) та L-ало-треонін (ІІІ) є парою діа-
стереомерів.
H C O |
|
H |
C O |
|
|||
|
|||
|
|
||
H C* OH |
|
HO |
C* H |
|
|||
CH2OH |
|
|
CH2OH |
|
|
||
|
|
||
дзеркало |
|
||
D (+) гліцериновий |
|
L (–) гліцериновий |
|
альдегід |
|
альдегід |
|
Так, D-молочна кислота конфігурації І, одержана при бродінні сахарози за присутності
Bacillus acidi laevolactici, належить до D-ряду і є лівообертаючою, а м’ясомолочна (+) кислота конфігурації ІІ, виділена з м’язів, належить до L-ряду і є правообертаючою. Знак обертання не має прямого зв’язку з конфігурацією.
HO |
C O |
HO |
C O |
H |
C* OH |
HO |
C* H |
|
CH3 |
|
CH3 |
І |
|
|
ІІ |
Енантіомери молочної кислоти
У 1951 р. рентгеноструктурно було доведено, що вибір моделі гліцеринового альдегіду був вірним.
Суміш певної кількості ліво- і правообертаючих ізомерів не має оптичної активності і називається рацематом. Кількість оптичних ізомерів для даної сполуки залежить від кількості хіральних атомів Карбону і визначається формулою:
X = 2n,
де n — кількість хіральних атомів Карбону. Якщо n>1, то підвищується і кількість можли-
вих стереоізомерів. Такі ізомери відрізняються конфігурацією у деяких (але не у всіх) центрів і називаються діастереоізомерами.
Номенклатура оптичних ізомерів
D-, L-система позначення конфігурації має обмежене застосування, використовується переважно в хімії вуглеводів і амінокислот. Щодо інших класів сполук D-, L-система часто не дає однозначних результатів. Іноді буває неможливо співвіднести конфігурацію сполук із D- або L-гліцериновим альдегідом. Наприклад, неясно, як зіставити кисневмісні замісники в гліцериновому альдегіді з атомами галогенів у молекулі бромфторхлорметану.
|
CI |
|
CI |
||
|
|
||||
Br |
|
F |
F |
|
Br |
|
|
||||
|
H |
|
H |
||
|
|
||||
|
|
||||
дзеркало Енантіомери бромфторхлорметану
Тому була запропонована більш універсальна номенклатурна система позначення конфігурації центрів хіральності — R-, S-система (від лат. rectus — правий, sinister — лівий). В основі її лежить принцип старшинства замісників, пов’язаних із центром хіральності. Старшинство замісників визначається атомним номером елемента, безпосередньо пов’язаного з центром хіральності,
— чим він більше, тим старше замісник. Так, у молекулі бромфторхлорметану замісники розташовуються за убуванням у такому порядку:
35Br > 17CI > 9F > 1H.
У складніших випадках старшинство груп, які оточують центр хіральності, визначають за другим, третім і більш далекими шарами атомів. Звичайно таке потрібно в ситуаціях, коли з центром хіральності зв’язані замісники, які мають у першому шарі атоми Карбону. Наприклад, група –СН2ОН старша за групу
–СН2СН3.
15

а б
Рис. 1.2. R-, S-система:
а — R-конфігурація; б — S-конфігурація
Після встановлення старшинства замісників молекулярну модель сполуки розташовують у просторі так, щоб наймолодший замісник (у нашому і в багатьох інших випадках — це атом Гідрогену) не потрапляв у поле зору спостерігача. Якщо старшинство трьох інших замісників убуває за годинниковою стрілкою, то центру хіральності приписують R-конфігурацію (рис. 1.2, а), якщо проти годинникової стрілки — S-конфігурацію (рис. 1.2, б).
2. Конформаційна ізомерія
Ізомери, які взаємоперетворюються при обертанні навколо простого зв’язку, називаються ро-
томерами, конформерами або конформаційними ізомерами (ізомери, що утворюються внаслідок вільного повороту навколо σ -зв’язків). Оскільки енергетичні бар’єри між такими ізомерами незначні, розділити їх практично неможливо, але виявити в суміші фізико-хімічними методами дослідження можна.
а) σ -зв’язок допускає вільне обертання атомів навколо зв’язку, яке однак може гальмуватися об’ємними замісниками. Кожний із можливих варіантів називається конформацією. Вільне обертання ілюструють проекційні формули Ньюмена:
H |
H |
H |
|
H |
H |
H |
|
H |
|
H |
H |
H H H |
|||||
H |
|
H |
|
H |
|
|||
|
H |
H |
|
|
H |
|||
|
H |
|
H H |
H H |
H |
|||
|
|
|
|
|
||||
Загальмована Заслонена Конформації стану
Переважне перебування молекул природних і фізіологічно активних сполук у певній конформації означає набування або втрату цими сполуками відповідних властивостей. Наприклад, ацетилхолін є передавачем нервових імпульсів.
|
|
|
H |
|
|
|
H |
|
H |
+ |
|
H |
+ |
||
CH COO |
|
|
N(CH3)3X- |
NH COO |
|
|
N(CH3)3X- |
|
|
|
|||||
3 |
|
|
|
2 |
|
|
|
H H |
|
H H |
|
||||
Ацетилхолін Карболхолін
Ця функція здійснюється в тій конформації, в якій два об’ємних замісники — СН3СОО– та –N+(CH3)3 — максимально віддалені один від одного. Дефіцит ацетилхоліну спричинює параліч. Синтетичний аналог ацетилхоліну карбохолін має таку ж просторову будову та властивості, а тому може тимчасово виконувати функцію ацетилхоліну в тих чи інших клітинах.
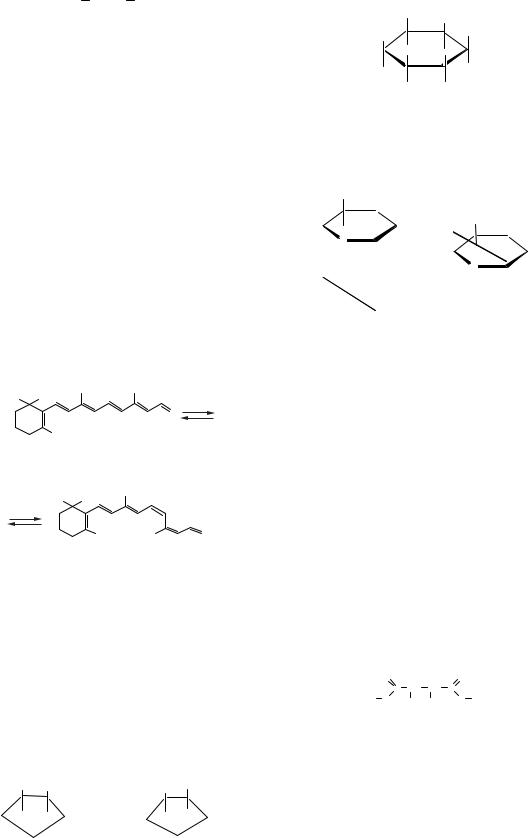
б) Найвідомішими конформерами є конформаційні ізомери циклогексану. На одномірній потенціальній кривій подане співвідношення між окремими формами:
«крісло» «твіст-кон- |
скручена |
«ванна» |
формація» |
«ванна» |
|
Конформації циклогексану
Найстабільнішою є форма «крісла», другому мінімуму відповідає форма скрученої ванни («твіст-форма») (рис. 1.3).
Е 
37,7–46,0 |
22,2 |
28,9 |
кДж/моль |
кДж/моль кДж/моль |
|
Конформаційна координата
Рис. 1.3. Енергетика конформаційних перетворень циклогексану
Електронна структура атома Карбону в органічних сполуках
У періодичній системі елементів Д. І. Менделєєва Карбон розташований у головній підгрупі IV групи, його порядковий номер 6 (6C). Звичайно в органічних сполуках атом Карбону має валентність чотири. Виходячи з електронної структури атома Карбону в основному стані, можна дійти висновку про його двохвалентність, тому що на зовнішньому електронному шарі перебувають два неспарених електрони. Тому для опису чотирьохвалентного стану вдаються до уявлення про збудження атома Карбону та гібридизацію його атомних орбіталей.
Електронна структура атома Карбону
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2s2 2p |
|
1 |
2p |
1 |
2p |
0 |
|
|
|
2s1 2p |
1 |
2p |
|
1 2p |
|
1 |
|||||||||||||
|
|
|
|
|
|
|
|
x |
|
|
y |
z |
|
|
|
|
|
|
|
x |
|
|
y |
|
|
|
z |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1s2 |
|
|
|
|
|
|
|
|
|
1s2 |
|
|
|
|
|
|
|
|
|
|||||||||||||
|
Основний стан |
|
|
|
Збуджений стан |
|
||||||||||||||||||||||||||
Атомна орбіталь — це частина простору, в якій імовірність знаходження електрона максимальна.
s-орбіталь має сферичну форму, а р-орбіталь
— форму об’ємної вісімки, певним чином орієнтованої в просторі (рис. 1.4).
При збудженні атома Карбону один із двох електронів 2s-підрівня переходить на вільну орбіталь 2р-підрівня. Це можливо й у зв’язку з неве-
16

z
|
|
y |
|
інних орбіталей. За формою вони також являють |
|
|
|
|
собою об’ємні вісімки. Відмінність їх від sp3- |
||
|
|
|
|
||
|
|
|
|
гібридних орбіталей в тому, що більша лопать |
|
|
|
x |
|
об’ємної вісімки в них трохи коротша. Sp2- |
|
|
|
|
|
гібридні орбіталі лежать в одній площині й спря- |
|
|
|
|
|
мовані під кутом 120° одна до одної, тобто їхні |
|
|
s |
|
|
вершини утворюють рівнобічний трикутник. |
|
|
|
|
Одна р-орбіталь залишається вільною, не- |
||
|
|
|
z |
||
z |
z |
|
гібридизованою. Вона зберігає форму правиль- |
||
y |
|
||||
|
|
y |
ної об’ємної вісімки й розташовується перпенди- |
||
y |
|
|
|||
|
|
|
кулярно площині, в якій лежать три sp2-гібридні |
||
|
|
|
|
||
x |
|
x |
x |
орбіталі. |
|
|
В sp-гібридизації беруть участь одна s- і одна |
||||
|
|
xy |
|
||
|
|
|
р-орбіталь. У результаті утворюються дві рівно- |
||
|
|
xz |
|
||
уz |
|
|
цінні гібридні орбіталі, що мають форму об’ємних |
||
|
|
|
|||
px |
py |
|
pz |
вісімок із ще коротшою великою лопаттю. Вони |
|
|
розташовуються під кутом 180° одна до одної, |
||||
|
|
|
|
||
Рис. 1.4. Атомні s- і р-орбіталі |
|
тобто на одній прямій, і спрямовані в протилежні |
|||
|
|
|
|
сторони від ядра атома. |
|
|
|
|
|
Дві р-орбиталі, які не беруть участь у гібриди- |
|
ликою різницею в енергії 2s- і 2р-підрівнів. Такий |
зації, зберігаютьформуправильнихоб’ємнихвісімок |
||||
атом Карбону в збудженому стані має вже чоти- |
і розташовуються взаємно перпендикулярно. |
||||
ри неспарених електрони: один на 2s- і три — на |
|
||||
2р-орбіталях. |
|
|
|
|
|
Для обгрунтування рівноцінності чотирьох |
|
||||
валентностей атома Карбону використовують |
1.2. КЛАСИФІКАЦІЯ ХІМІЧНИХ |
||||
опис його електронної структури із залученням |
|||||
РЕАКЦІЙ. РЕАКЦІЙНА ЗДАТНІСТЬ |
|||||
поняття гібридизації. Такий опис базується на |
|||||
АЛКАНІВ, АЛКЕНІВ, АРЕНІВ, |
|||||
уявленні про те, що після змішання орбіталей |
|||||
СПИРТІВ, ФЕНОЛІВ, АМІНІВ |
|||||
відбувається утворення нових, гібридних орбіта- |
|||||
лей, рівноцінних за енергією (рис. 1.5). |
Вивчення взаємозв’язку між будовою і влас- |
||||
При цьому гібридизацію слід розуміти як ма- |
|||||
тематичну, квантово-механічну модель, а не як |
тивостями різних природних і лікарських сполук |
||||
якийсь фізичний процес. Залежно від кількості |
довело, що їхня біологічна активність значною |
||||
орбіталей збудженого атома Карбону, що беруть |
мірою визначається просторовим розміщенням |
||||
участь у гібридизації, можливі три її види. |
атомів і молекул, які входять до складу цих спо- |
||||
В sp3-гібридизації беруть участь чотири орбі- |
лук. Комплементарність лежить в основі проце- |
||||
талі — одна s- і три р-орбіталі — з утворенням |
су гідролізу харчових продуктів під впливом фер- |
||||
чотирьох рівноцінних гібридних орбіталей. Sp3- |
ментів (структурна відповідність конфігурацій |
||||
гібридні орбіталі мають форму об’ємної вісімки, |
ферменту і субстрату), процесу синтезу нових спе- |
||||
у якої одна з лопатей значно більша за інші. |
цифічних для даного організму біополімерів (мат- |
||||
Ці орбіталі розташовуються в просторі одна |
ричні синтези білків і нуклеїнових кислот), захис- |
||||
відносно одної під кутом 109,5°. Якщо з’єднати |
них (імунних) реакцій організму та ін. |
||||
вершини цих орбіталей, то утвориться об’ємна |
Механізми дії лікарських засобів на організм |
||||
фігура — тетраедр. Атом Карбону в sp3-гібрид- |
людини (на відповідні рецептори клітинних мем- |
||||
ному стані прийнято називати тетраедричним. |
бран) також зумовлені просторовою будовою |
||||
В sp2-гібридизації беруть участь одна s- і дві |
цих сполук і відповідних їм рецепторів. Визначен- |
||||
р-орбіталі з утворенням трьох гібридних рівноц- |
ня просторового розміщення атомів у молекулах |
||||
|
|
|
|
органічних сполук, що мають біологічну ак- |
|
|
z |
|
|
тивність, полягає в послідовності виявлення їх |
|
|
y |
|
будови, конфігурації та конформації. |
||
|
|
|
|||
|
|
x |
|
Будову біологічно активних сполук знахо- |
|
|
|
|
дять на основі елементного аналізу (вміст C, H, |
||
|
|
|
|
||
|
|
|
|
N, O, S, P тощо). Просторова конфігурація моле- |
|
|
|
|
|
кул біологічно активних речовин визначається |
|
pz |
pz |
|
pz |
гібридизацією електронних орбіталей атомів, які |
|
|
беруть участь в утворенні хімічних зв’язків. |
||||
|
|
|
py |
||
|
|
90° |
В органічних сполуках атом Карбону може |
||
109,5° |
|
90° |
|||
|
90° |
перебувати у трьох валентних станах — їм відпо- |
|||
|
|
||||
120° |
|
px |
px |
відають sp3-, sp2-, sp-гібридизація. В усіх випад- |
|
|
|
|
|
ках тип зв’язку однаковий — ковалентний непо- |
|
|
|
|
|
лярний або малополярний. Перебіг будь-якої |
|
sp3 |
sp2 |
|
sp |
хімічної реакції супроводжується розривом ста- |
|
Рис. 1.5. Види гібридизації атома Карбону |
рих і встановленням нових зв’язків. Напрямок |
||||
реакції визначається величиною зміни вільної |
|||||
17
енергії Гіббса (∆ G), швидкість процесу — швидкістю найповільнішої лімітуючої стадії. Оскільки розрив ковалентного зв’язку потребує значної витрати енергії, то часто перша стадія є найповільнішою, через що швидкість органічних реакцій набагато менша, ніж швидкість іонних реакцій.
Природа хімічного зв’язку передбачає і механізм взаємного впливу атомів, безпосередньо не зв’язаних між собою. Електронні орбіталі можуть зміщуватись у молекулі так, щоб електрони «обслуговували» не тільки пару атомів, які утворюють зв’язок, а також інші атоми. Потрібно враховувати, що електронні орбіталі не мають меж і, відповідно, можуть перекриватись і впливати одна на одну через простір (ефект поля). Значною мірою взаємодія через простір відбувається в тому випадку, якщо атоми достатньо зближені, оскільки взаємодія ослаблюється пропорційно квадрату відстані.
Здатність молекули до тих чи інших типів перетворень визначається насамперед розподілом і рухливістю електронів, що залежить від таких факторів:
1.Статична поляризація зв’язків.
2.Динамічна поляризація зв’язків. Ідеальний ковалентний зв’язок може існува-
ти тільки між однорідними атомами або групами атомів. Якщо атоми характеризуються різною електронегативністю, то зв’язок між ними завжди буде полярним.
Зміщення електронної щільності по ланцюгу σ -зв’язку називається індуктивним ефектом і позначається літерою І.
Індукційний ефект передається по ланцюгу зі згасанням. Напрямок зміщення електронної густини всіх σ -зв’язків позначається прямими стрілками.
σσσ+ |
σσ+ |
σ+ |
|
σ− |
|
|
CH3 |
|
CH2 |
|
CH2 |
|
Cl |
|
|
|
||||
|
|
|
|
+ІС3Н7 |
–ІСl |
|
σσ , σσσ — поступове зменшення частки початкового заряду.
Індукційний ефект позначається стрілкою за σ -зв’язком, який сполучає атоми, у бік атома з більшою електронегативністю.
Індукційний ефект насиченого С–Н-зв’язку умовно дорівнює нулю: І = 0.
Електроноакцепторні замісники, тобто атом або група атомів, які зміщують електронну густину σ -зв’язку від атома Карбону, виявляють не-
гативний індуктивний ефект (–І-ефект).
Електронодонорні замісники, тобто атом або група атомів, які зміщують електронну густину до атома Карбону, виявляють позитивний індук-
тивний ефект(+І-ефект).
Негативний індукційний ефект мають усі без винятку ненасичені групи; зі збільшенням кількості кратних зв’язків величина –I-ефекту зростає.
Нижче подані замісники, розміщені за зменшенням –I-ефекту:
−NO2 > −C≡ N > −F > −Cl > −Br > −I >
> −COOR > −OH > −NH2 > H
Позитивний ефект мають усі алкільні замісники, величина +I-ефекту зростає зі збільшенням ступеня розгалуження ланцюга:
|
|
CH3 |
|
CH3 |
|
CH3 < |
|
C2H5 < CH |
< C |
|
CH3 |
|
|
||||
|
|
CH3 |
|
CH3 |
|
Електронне зміщення у спряжених системах за участю електронів кратних зв’язків чи неподілених електронних пар називають ефектом спря-
ження, або мезомерним ефектом (± М) за раху-
нок делокалізації р-орбіталей, які належать двом чи більше π -зв’язкам або π -зв’язкам і р-орбіталям неподілених пар електронів, які розділені одним простим зв’язком.
Спряження, або мезомерія (від грецьк. mesos
— середній) — вирівнювання зв’язків і зарядів у реальній молекулі порівняно з ідеальною.
CH2 CH CH CH2 Ідеальна молекула Бутадієн-1,3
CH2

 CH
CH

 CH
CH

 CH2 Реальна молекула
CH2 Реальна молекула
Мезомерний ефект у бутадієні-1,3 здійснюється за рахунок ππ -взаємодії.
Графічно мезомерний ефект зображується у вигляді зігнутої стрілки від подвійного зв’язку до одинарного і передається всій системі спряжених зв’язків.
Наприклад,
π,π -взаємодія
δ + |
δ + |
O |
|
||||||
H2C |
|
CH CH CH |
|
|
C |
O |
|
H |
ρ,π -взаємодія |
|
|
||||||||
|
|
|
|
||||||
|
|
|
|
|
|
|
|
||
Позитивний мезомерний ефект мають усі елек-
тронодонорні замісники, які здатні відштовхувати електронну густину у напрямку сусіднього подвійного зв’язку:
–NH2 > –OH > –OCH3 > –Cl > –Br
Негативний мезомерний ефект мають усі елек-
тронноакцепторні замісники, які притягують до себе π -електрони сусіднього подвійного зв’язку.
|
|
|
|
|
|
O |
O |
||||
NO2 > |
|
C |
|
N > C O > |
|
C > |
|
C |
> |
|
CONH2 |
|
|
||||||||||
|
|
|
|
|
|||||||
|
|
||||||||||
|
|
|
|
|
|
OR |
OH |
||||
Таким чином, у молекулі під впливом індукційного поля і мезомерних ефектів замісників відбувається формування реакційних центрів із надлишком або нестачею електронної густини. Молекула стає підготовленою для перебігу хімічної реакції за тим чи іншим механізмом.
Інколи основний вплив на реакційну здатність молекули створюють просторові ефекти, коли підхід атакуючої частинки до реакційного центру утруднений через великі за об’ємом замісники, що оточують реакційний центр.
При цьому швидкість реакції різко знижується або реакція взагалі не відбувається. Наприклад, зміна швидкості реакції приєднання за карбонільною групою нуклеофільних реагентів залежно від зв’язаних із нею замісників.
18
