
- •Молекулярная физика и термодинамика Статистический и термодинамический методы исследования
- •Молекулярно-кинетическая теория газов. Опытные законы идеальных газов.
- •Уравнение Клапейрона-Менделеева.
- •Основное уравнение молекулярно-кинетической теорииидеальных газов.
- •Закон равномерного распределения энергии по степеням свободы молекул.
- •Распределение молекул идеального газа по скоростям (распределение Максвелла).
- •Распределение молекул идеального газа во внешнем потенциальном поле.
- •Средняя длина свободного пробега молекул.
- •Основы термодинамики. Внутренняя энергия, работа и теплота.
- •Первое начало термодинамики.
- •Применение первого начала термодинамики к изопроцессам идеальных газов.
- •Адиабатный и политропный процессы идеальных газов.
- •Теория теплоемкостей идеальных газов.
- •Тепловые двигатели.
- •Холодильные машины.
- •Цикл Карно.
- •Обратимые и необратимые процессы.
- •Второе начало термодинамики.
- •Энтропия.
- •Статистический смысл второго начала термодинамики.
Средняя длина свободного пробега молекул.
При хаотическом
движении молекулы газа сталкиваются
не только со стенками сосуда, но и между
собой. Между столкновениями они движутся
равномерно и прямолинейно и проходят
расстояние, называемое длиной свободного
пробега
![]() .
Для характеристики всей совокупности
молекул газа вводится понятиесредней
длины свободного пробега молекул
.
Для характеристики всей совокупности
молекул газа вводится понятиесредней
длины свободного пробега молекул
![]() .
.
Модель идеального газа предполагает, что молекулы сталкиваются так же, как обычные шарики, только очень малого диаметра d~10-10 м. В результате каждого столкновения направление движения молекул изменяется. Поэтому траектория молекулы газа представляет собой ломаную линию.
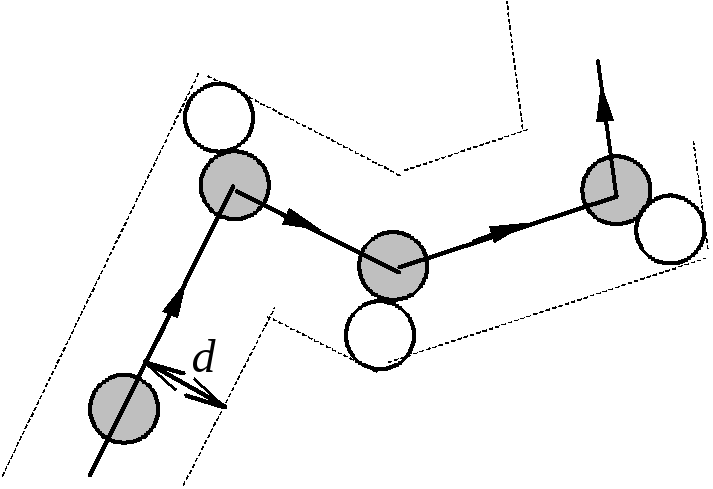
![]() столкновений молекулы в единицу времени
равно произведению объема цилиндра на
концентрацию молекул, т. е.
столкновений молекулы в единицу времени
равно произведению объема цилиндра на
концентрацию молекул, т. е.
![]() .
.
С учетом того, что
все молекулы движутся, возможность
столкновения определяется средней
относительной скоростью
![]() .
Если молекулы газа распределены по
скоростям по закону Максвелла, то
.
Если молекулы газа распределены по
скоростям по закону Максвелла, то![]() оказывается равной
оказывается равной
![]() .
.
Тогда
![]() .
.
Средняя длина свободного пробега молекул найдется как отношение среднего пути за единицу времени к среднему числу столкновений за единицу времени:
![]() .
.
Представление
молекул в виде шариков, конечно, является
идеализацией. Каждая молекула - это
сложная система, состоящая из ядер и
электронов. Поэтому под d
нужно понимать так называемый «эффективный»
диаметр, который зависит от температуры.
С повышением температуры центры молекул
сближаются при столкновении на меньшее
расстояние, т. е. «эффективный» диаметр
молекул уменьшается, следовательно,
![]() растет. Но эффект роста
растет. Но эффект роста
![]() с повышением температуры довольно
слабый, и в первом приближении им можно
пренебречь.
с повышением температуры довольно
слабый, и в первом приближении им можно
пренебречь.
Основы термодинамики. Внутренняя энергия, работа и теплота.
Любая термодинамическая система обладает кроме механической энергии также и внутренней энергией U, зависящей только от внутреннего состояния системы. Во внутреннюю энергию делают вклад следующие виды энергии:
1)кинетическая энергия хаотического поступательного и вращательного движения молекул;
2)кинетическая и потенциальная энергия колебаний атомов в молекулах;
3)потенциальная энергия межмолекулярного взаимодействия;
4)энергия электронных оболочек атомов и ионов;
5)внутриядерная энергия.
Внутренняя энергия является однозначной функцией состояния термодинамической системы, т. е. не зависит от того, каким образом система пришла в это состояние. Подобно потенциальной энергии в механике внутренняя энергия может быть определена только с точностью до произвольной постоянной. Однако в термодинамических расчетах это несущественно, поскольку в них определяются только изменения внутренней энергии. Поэтому под внутренней энергией обычно понимают только те ее составляющие, которые изменяются в рассматриваемых процессах. Например, для идеального газа под внутренней энергией будем подразумевать суммарную кинетическую энергию теплового движения всех молекул.

![]() ,
,
где dV - приращение объема газа.
При расширении dV>0, поэтому работа газа положительна, при сжатии dV<0 и работа газа отрицательна, т. е. работу совершают внешние силы над газом.

![]()
и имеет простую геометрическую интерпретацию. Она численно равна площади под графиком процесса в координатах p, V (см. рис.). Поскольку давление при изменении объема может меняться по-разному, полная работа будет зависеть от способа перехода из начального состояния 1 в конечное 2.
Теплообменом называется процесс обмена тел внутренними энергиями, не сопровождающийся совершением работы. Энергия, переданная в результате теплообмена, называется количеством теплоты Q.
Понятия теплоты и работы не являются функциями состояния системы, они имеют смысл только в связи с процессом изменения состояния системы.
