
- •Рассказать методологию и подходы биотестирования, основные требования к методам, тест-объектам и тест-функциям.
- •Рассказать суть методологии биоиндикации. В чем отличие методов биотестирования от методов, предполагаемых биоиндикационные исследования?
- •В чем преимущества и недостатки использования тест-объектов растительного происхождения в биотестировании? а в биоиндикации?
- •Влияние стрессирующих воздействий на морфологический гомеостаз (раскрыть на конкретных примерах). Назвать типы, классы или виды живых организмов, используемых в данном подходе биотеситрования.
- •В чем преимущества и недостатки биоиндикаторов животного происхождения? Назвать типы, классы и виды животных, используемых в биоиндикации.
- •Как провести оценку энергетического обмена в рамках физиологического подхода биотестирования. Суть подхода.
- •В чем преимущества использования клеток высших растений в цитогенетических тестах. Назвать виды растений, применяемых в качестве тест-объектов радиационного и химического загрязнения.
- •Принцип методов биоиндикации качества атмосферного воздуха с помощью лишайников. Оценочная шкала. Индекс полеотолерантности
- •Как провести оценку нарушения процессов роста на примере растительных объектов (например, колеоптилей злаковых культур) в рамках физиологического подхода биотестирования.
- •Эффективность биохимических тестов при исследовании состояния организма и среды обитания. Рассказать суть любого метода, применяемого в данном подходе.
- •Методы биоиндикации воды с помощью макрофитов. Прямые и косвенные индикаторы. Коэффициенты достоверности и значимости. Индекс неоднородности Симпсона.
- •Как и какие клетки млекопитающих возможно использовать в цитогенетических тестах. В чем преимущества? Назовите известные Вам методы.
- •Методы оценки флуктуирующей асимметрии.
- •Иммунологический подход.
- •Как реконструировать дозу ионизирующего излучения, полученную человеком с помощью микроядерного теста. В чем принцип метода?
- •Генетический подход оценки качества окружающей среды. Предложить бальную оценку состояния тест-объектов по уровню генетических нарушений. Указать известные методы, предлагаемые данным подходом.
- •Перечислить краткосрочные (экспресс) тесты для выявления мутагенных и канцерогенных химических веществ. Предложить тест-объекты, применяемые для этих целей.
- •Провести биоиндикацию качества воды в проточном водоеме по системе сапробности. Рассчитать индекс сапробности. Назвать организмы-индикаторы (типы, классы, виды).
- •Провести предварительное обследование водоема
- •Реконструировать дозу ионизирующего излучения, полученную человеком, по хромосомным аберрациям в лимфоцитах периферической крови. В чем принцип метода?
- •Перечислить требования и преимущества принципа биотестирования с помощью беспозвоночных. Охарактеризовать известные методы (на примере любой природной среды в рамках любого подхода).
- •Применять на практике методы ботанического, зоологического, альгологического, микробиологического анализов почв в рамках биоиндикационного подхода.
- •Рассказать преимущества и недостатки использования микроорганизмов в качестве биоиндикаторов. Колииндекс и колититр. Общее микробное число.
- •Провести оценку трофических свойств воды и почвы с помощью макрофитов. Коэффициент общности по Жаккару и Соренсену. Индекс Коха. Коэффициент дифференциальности.
- •Провести оценку качества воды с помощью олигохентного индекса. В чем суть метода?
- •Провести оценку качества воды с помощью олигохентного индекса. В чем суть метода?
- •В чем преимущества и недостатки использования клеток микроорганизмов для генетического анализа? Дать суть методов генетического мониторинга с помощью микроорганизмов.
- •Составить схему отбора проб воды в локальных водоемах для импактного мониторинга предприятия.
- •Составить схему отбора проб воды в текучем водоеме для импактного мониторинга предприятия.
- •Составить схему отбора проб почвы для импактного мониторинга предприятия.
- •Составить схему рекогносцировочной поездки для регионального мониторинга территории
- •Составить схему проведения биологического мониторинга наземной территории, загрязненной нефтепродуктами
- •Составить схему проведения биологического мониторинга водоема, загрязненного тяжелыми металлами и радионуклидами.
- •Составить общую схему регионального мониторинга территории для проведения природоохранных мероприятий (например, создания парковой зоны или заказника).
- •Составьте схему биологического мониторинг водоема-охладителя атомной станции, в котором наблюдается сильная эвтрофикация, приводящая к засорению фильтров для забора воды.
- •Предложите набор экспресс-методов биомониторинга водоема-охладителя атомной станции для принятия решения о мероприятиях по обновлению его видового состава.
- •Составить схему этапов экологической экспертизы территории для разрешения строительства химического предприятия.
- •Предложите набор цитогенетических экспресс-методов биомониторинга наземной территории в районе расположения атомной станции.
- •Предложите набор экспресс-методов биоиндикации для глобального биомониторинга проточных водоемов
- •Предложить схему эксперимента (подход биотестирования, тест-организм(ы), тест-функции) для оценки влияния физического (химического) фактора на организм.
- •Предложить батарею тестов для проведения биологического мониторинга городской территории, расположенной в районе размещения базовой станции сотовой связи.
Реконструировать дозу ионизирующего излучения, полученную человеком, по хромосомным аберрациям в лимфоцитах периферической крови. В чем принцип метода?
Цитогенетические тесты in vitro направлены на то, чтобы продемонстрировать индукцию хромосомных нарушений (аберраций) в культивируемых клетках. Обычно в этих тестах клетки изучаются на стадии метафазы.В норме хромосомы по форме можно разделить на три группы(рис. 2 1.1): акроцентрические (галочковидные, у которых одно плечо очень маленькое) — на рисунке хромосомные пары 13, 14, 15 —средние, 2 1, 22 — мелкие; субметацентрические (неравноплечие) — хромосомные пары 2 — самые крупные, 4, 5 — крупные,6 — 12 — средние, 16 — 18 — мелкие; метацентрические (равноплечие) — хромосомные пары 1 — самые крупные, 3 — крупные,19, 20 — мелкие.
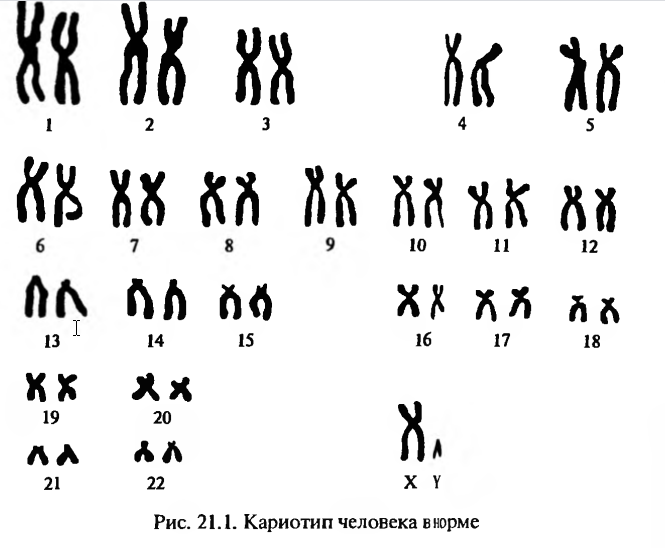
Хромосомные аберрации являются крупным повреждением хромосом и, следовательно, ДНК, поэтому кластогенные факторы (физический или химический фактор классифицируется как кластоген, если он вызывает увеличение числа разрывов хромосом по сравнению с контрольным образцом) должны рассматриваться как потенциально опасные. Клетки с видимыми хромосомными аберрациями, по всей вероятности, не способны к выживанию, но в клетках, которые кажутся неповрежденными, может происходить репарация ДНК и, если этот процесс протекает с ошибками, возможно возникновение мутаций. Отдельные виды хромосомных нарушений, такие как некоторые делении и перестройки (транслокации, инверсии), могут и не вызывать летального эффекта. Сравнительно высокий уровень хромосомных нарушений у людей свидетельствует о возможной роли изменений хромосом в популяциях человека.
Хромосомные аберрации анализируются в метафазах митотического деления клеток пролиферирующих тканей, например костного мозга лабораторных животных. Данный тест имеет широкое применение, и многие регламентирующие органы, принимающие решения в области охраны окружающей среды, придают ему особое значение. Поскольку он проводится на целом организме животных, то лишен очевидных недостатков, связанных с применением искусственных систем метаболической активации in vitro
Хромосомные аберрации возникают в результате нарушений в ДНК, приводящих к разрыву двойной спирали. При изучении процессов репарации ДНК установлено много видов первичных нарушений: одно- и двунитевые разрывы, повреждения оснований, сшивки ДНК-ДНК и ДНК-белок, алкилирование оснований или фосфатных групп, тиминовые димеры, сайты, лишенные пуринов и пиримидинов. Эти нарушения могут либо исправляться, либо трансформироваться, при этом либо восстанавливается оригинальная последовательность оснований, либо образуются хромосомные аберрации и/или генные мутации.
Часто для исследования хромосомных аберраций используются лимфоциты периферической крови человека (мононуклеарные лейкоциты). Лимфоциты не способны к делению в культуре, но этот процесс можно стимулировать путем обработки каким-либо митогеном, например фитогемагглютиннином (ФГА). Культуру получают из образца свежеполученной крови и проводят культивирование на протяжении нескольких циклов делений. Первой метафазы после внесения митогена клетки достигают не ранеечем через 36—40 ч, после чего они делятся приблизительно каждые 18 ч.
После введения в культуру клеток тестируемого вещества клетки выращивают в течение одного или двух клеточных циклов с тем, чтобы большинство клеток достигло первой метафазы после обработки, а затем проводят фиксацию. Перед фиксацией добавляют вещество, блокирующее образование веретена деления, например колхицин, для того чтобы остановить деление клеток на стадии метафазы. Клетки обрабатывают гипотоническим раствором, например 0,56% = М (075М) хлористым калием, после чего фиксируют свежеприготовленной смесью этилового спирта и ледяной уксусной кислоты (в соотношении 3:1). Затем клетки окрашивают по Гимзе, орсеином или другим красителем для хромосом и изучают под микроскопом.
Принцип метода основан на образовании хромосомных аберраций в лимфоцитах периферической крови человека под влиянием мутагенов и канцерогенов.
ЧАСТОТА БИНУКЛЕАРНЫХ КЛЕТОК С МИКРОЯДРАМИ В КУЛЬТУРЕ ЛИМФОЦИТОВ ЧЕЛОВЕКА ПОСЛЕ y-ОБЛУЧЕНИЯ
Микроядерный метод заключается в количественной регистрации микроядер в лимфоцитах периферической крови человека.
Известно, что именно лимфоциты периферической крови сохраняют полученные повреждения в течение длительного времени. Микроядра обнаруживаются в лимфоцитах сразу после первого митоза. Поскольку в обычных условиях лимфоциты представляют собой неделящуюся популяцию, их подвергают ФГА-стимуляции в культуре. Для построения дозовой зависимости кровь облучают in vitro и спустя 72 ч от начала ФГА-стимуляции анализируют.
Подсчитывают обычно 500 бинуклеарных клеток, используя метод цитокинетического блока. Он основан на введении в культуру лимфоцитов цитохолазина-Б, который блокирует разделение цитоплазмы. Блокирование цитокинеза ведет к накоплению в культуре бинуклеарных клеток, которые удобно анализировать на возможность присутствия в них микроядер.
Для правильного анализа клеток с микроядрами следует учитывать ряд правил.
• Микроядра имеют обычно округлую или овальную форму и обладают типичной ядерной окраской.
• В цитоплазме одной бинуклеарной клетки может присутствовать одно микроядро и более.
• Большинство микроядер по размеру значительно меньше основного ядра (меньше половины).
• Регистрировать следует те микроядра, между которыми и основным ядром четко выявляется ядерная мембрана.
В научных исследованиях некоторых лабораторий показано, что при дозах облучения от 1 до 4—5 Гр количество микроядер в клеткахувеличивается линейно для всех видов излучений. При дозах от
0,05 до 2 Гр выход микроядер может быть описан линейно-квадратичной зависимостью, хотя в диапазоне доз 0,05 — 0,1 Гр имеется плато (дозонезависимый участок).
С помощью микроядерного теста можно реконструировать дозу,полученную человеком ранее. Для этого предлагается пользоваться калибровочными таблицами, полученными в лаборатории прииспользовании венозной крови клинически здоровых доноров в возрасте 20—35 лет. Лимфоциты облучают в дозах от 0,05 до 2 Гр.
Дозовая зависимость, полученная при образовании бинуклеарных клеток, аппроксимируется линейно-квадратичной функцией:

Построив калибровочную кривую и подсчитав количество микроядер в клетках лимфоцитов исследуемой крови, можно рассчитать дозу, полученную человеком.
Если в лаборатории нет условий для построения калибровочной кривой, можно пользоваться кривыми, полученными в других лабораториях.
Принцип метода заключается в образовании микроядер вследствие нарушения распределения генетического материала между дочерними клетками (5 %) или формирующихся из обломков хромосом (до 95 %).
Использовать разные индексы для оценки качества воды по сообществам бентосных макро беспозвоночных (биотический индекс, общий индекс биологического качества, биологический индекс общего качества). Перечислить преимущества и недостатки каждого.
Для оценки уровней загрязнения биогеоценозов могут быть использованы различные индексы видового разнообразия. Максимальным индекс будет в случае, когда каждая особь принадлежит к отдельному виду, а минимальным — когда все особи относятся к одному виду. Преимущество имеют те индексы разнообразия, которые не зависят от размеров пробы, показывают относительное значение видов в сообществе и являются безразмерными.
Наиболее широко в биомониторинге используют индекс Шеннона- Винера — индекс Н. Разнообразие Н по Шеннону—Винеру математически характеризует два параметра ценоза — число имеющихся видов и равномерность распределения их популяций (численность особей или их количественную долю):
![]() где
где
![]()
В
выборке истинное значение р, неизвестно,
поэтому в качестве оценки берется![]() отсюда
отсюда![]()
где S — число видов; л, — количество (численность или масса особей) /-го вида; N — общее количество видов; р, — относительная частота встречаемости /-го вида; А, — частичная мера информации /-го вида или структура доминирования /-го вида.
Величина индекса разнообразия Шеннона—Винера обычно укладывается в интервале от 1,5 до 3,5 и очень редко превышает 4,5. Применение этого индекса для экологического анализа водоема показало, что его величина резко падает в месте сброса сточных вод независимо от того, оценивается ли он на уровне видов, родов, отрядов или классов гидробионтов на разных трофических уровнях. Это значительно расширяет возможности применения данного индекса, причем не только для оценки разнообразия гидробионтов, но и для оценки степени загрязнения, например, городских экосистем.
![]() Индекс
видового разнообразия Маргалефа d был
предложен для оценки загрязнения
водоемов, котооые обычно характеризуются
уменьшением биоразнообразия:
Индекс
видового разнообразия Маргалефа d был
предложен для оценки загрязнения
водоемов, котооые обычно характеризуются
уменьшением биоразнообразия:
где S— количество видов; In TV— натуральный логарифм количества особей.
Коэффициент принимает максимальное значение, если все особи принадлежат к разным видам (5 — TV), и равен нулю, когда все особи принадлежат к одному виду.
Проточные водоемы могут быть оценены с помощью биотического индекса, разработанного в Англии и впервые опробованного на реке Трент. Определение биотического индекса ведется по рабочей шкале, в которой использована наиболее часто встречаемая последовательность исчезновения бентосных беспозвоночных по мере увеличения загрязнения. Метод Вудивиса имеет многочисленных сторонников, которые, однако, признают ряд его недостатков: довольно общий и часто упрощенный с плохой репрезентативностью отбор проб; часто не принимающиеся во внимание трудности идентификации; недостатки стандартной таблицы для расчета" индекса, а именно — различная чувствительность к загрязнению в некоторых группах выделенных видов, недостаточное таксономическое разнообразие.
Обобщенный индекс биологического качества имеет ряд преимуществ: дифференцированный отбор проб с идентификацией разных зон, стандартная таблица благодаря коррекциям и уточнениям, внесенным в списки таксонов и в классификацию, более удобна в пользовании. Вместе с тем рабочая нагрузка, обусловленная большим разнообразием проб, недостаток классов таксономического разнообразия в стандартной таблице делают использование этого индекса сомнительным. Параллельно с обобщенным индексом биологического качества был предложен индекс потенциального биологического качества, удобный для исследования больших глубин. Более совершенным является биологический индекс общего качества, отличающийся тем, что усовершенствованный отбор проб дает мозаичную картину населения зоны; в списке из 135 таксонов 38 являются индикаторами.
Общий уровень загрязнения часто оценивают по индексу сапробности Пантле и Букка:
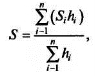 %
%
где S — индекс значимости вида; h — частота встречаемости организмов.
Загрязнение приводит не только к снижению видового разнообразия, но и к увеличению доминирования определенных видов. При этом обилие свойственно небольшому числу видов, которые можно оценить индексом неоднородности Симпсона'.
![]()
где я, — число особей /-го вида; N— общее число особей. По мере увеличения D разнообразие уменьшается, поэтому используют его обратную величину l/D. Величина индекса в сильной степени зависит от присутствия в пробе самых обильных видов, но в слабой — от видового разнообразия.
При
оценке водоемов, загрязненных органическими
соединениями, может использоваться
олигохетный индекс, или индекс Гуднайта
и Уитлея. В собранной пробе подсчитывается
общее количество организмов и отдельно
число олигохет:![]() где
N — численность (экз./м2).
где
N — численность (экз./м2).
Значение коэффициента увеличивается по мере ухудшения качества воды. Так, высокую концентрацию загрязнения характеризует олигохетный индекс gt; 80 %; сомнительным загрязнение считается при индексе 60—80%; состояние водной среды хорошее, когда индекс lt; 60 %.
Помимо олигохет в бентосе континентальных водоемов широко представлены личинки комаров-звонцов, принадлежащие к трем подсемействам: Chironominae, Orphocladinae и Tanypodinae. Орфокладины обитают в основном в чистых водах, таниподины — в загрязненных, хирономиды выдерживают относительно невысокие степени загрязнения. Таким образом, по соотношению численности представителей этих подсемейств можно судить о качестве воды. Е. В. Балушкина предложила индекс К, который может служить для этой цели:
![]()
где![]() —
—
выраженные в процентах отношения численности личинок одного из подсемейств к общей численности личинок этого семейства. Величина L0 — верхний предел значений индекса. Нижний предел его равен нулю.
