- •Рассказать методологию и подходы биотестирования, основные требования к методам, тест-объектам и тест-функциям.
- •Рассказать суть методологии биоиндикации. В чем отличие методов биотестирования от методов, предполагаемых биоиндикационные исследования?
- •В чем преимущества и недостатки использования тест-объектов растительного происхождения в биотестировании? а в биоиндикации?
- •Влияние стрессирующих воздействий на морфологический гомеостаз (раскрыть на конкретных примерах). Назвать типы, классы или виды живых организмов, используемых в данном подходе биотеситрования.
- •В чем преимущества и недостатки биоиндикаторов животного происхождения? Назвать типы, классы и виды животных, используемых в биоиндикации.
- •Как провести оценку энергетического обмена в рамках физиологического подхода биотестирования. Суть подхода.
- •В чем преимущества использования клеток высших растений в цитогенетических тестах. Назвать виды растений, применяемых в качестве тест-объектов радиационного и химического загрязнения.
- •Принцип методов биоиндикации качества атмосферного воздуха с помощью лишайников. Оценочная шкала. Индекс полеотолерантности
- •Как провести оценку нарушения процессов роста на примере растительных объектов (например, колеоптилей злаковых культур) в рамках физиологического подхода биотестирования.
- •Эффективность биохимических тестов при исследовании состояния организма и среды обитания. Рассказать суть любого метода, применяемого в данном подходе.
- •Методы биоиндикации воды с помощью макрофитов. Прямые и косвенные индикаторы. Коэффициенты достоверности и значимости. Индекс неоднородности Симпсона.
- •Как и какие клетки млекопитающих возможно использовать в цитогенетических тестах. В чем преимущества? Назовите известные Вам методы.
- •Методы оценки флуктуирующей асимметрии.
- •Иммунологический подход.
- •Как реконструировать дозу ионизирующего излучения, полученную человеком с помощью микроядерного теста. В чем принцип метода?
- •Генетический подход оценки качества окружающей среды. Предложить бальную оценку состояния тест-объектов по уровню генетических нарушений. Указать известные методы, предлагаемые данным подходом.
- •Перечислить краткосрочные (экспресс) тесты для выявления мутагенных и канцерогенных химических веществ. Предложить тест-объекты, применяемые для этих целей.
- •Провести биоиндикацию качества воды в проточном водоеме по системе сапробности. Рассчитать индекс сапробности. Назвать организмы-индикаторы (типы, классы, виды).
- •Провести предварительное обследование водоема
- •Реконструировать дозу ионизирующего излучения, полученную человеком, по хромосомным аберрациям в лимфоцитах периферической крови. В чем принцип метода?
- •Перечислить требования и преимущества принципа биотестирования с помощью беспозвоночных. Охарактеризовать известные методы (на примере любой природной среды в рамках любого подхода).
- •Применять на практике методы ботанического, зоологического, альгологического, микробиологического анализов почв в рамках биоиндикационного подхода.
- •Рассказать преимущества и недостатки использования микроорганизмов в качестве биоиндикаторов. Колииндекс и колититр. Общее микробное число.
- •Провести оценку трофических свойств воды и почвы с помощью макрофитов. Коэффициент общности по Жаккару и Соренсену. Индекс Коха. Коэффициент дифференциальности.
- •Провести оценку качества воды с помощью олигохентного индекса. В чем суть метода?
- •Провести оценку качества воды с помощью олигохентного индекса. В чем суть метода?
- •В чем преимущества и недостатки использования клеток микроорганизмов для генетического анализа? Дать суть методов генетического мониторинга с помощью микроорганизмов.
- •Составить схему отбора проб воды в локальных водоемах для импактного мониторинга предприятия.
- •Составить схему отбора проб воды в текучем водоеме для импактного мониторинга предприятия.
- •Составить схему отбора проб почвы для импактного мониторинга предприятия.
- •Составить схему рекогносцировочной поездки для регионального мониторинга территории
- •Составить схему проведения биологического мониторинга наземной территории, загрязненной нефтепродуктами
- •Составить схему проведения биологического мониторинга водоема, загрязненного тяжелыми металлами и радионуклидами.
- •Составить общую схему регионального мониторинга территории для проведения природоохранных мероприятий (например, создания парковой зоны или заказника).
- •Составьте схему биологического мониторинг водоема-охладителя атомной станции, в котором наблюдается сильная эвтрофикация, приводящая к засорению фильтров для забора воды.
- •Предложите набор экспресс-методов биомониторинга водоема-охладителя атомной станции для принятия решения о мероприятиях по обновлению его видового состава.
- •Составить схему этапов экологической экспертизы территории для разрешения строительства химического предприятия.
- •Предложите набор цитогенетических экспресс-методов биомониторинга наземной территории в районе расположения атомной станции.
- •Предложите набор экспресс-методов биоиндикации для глобального биомониторинга проточных водоемов
- •Предложить схему эксперимента (подход биотестирования, тест-организм(ы), тест-функции) для оценки влияния физического (химического) фактора на организм.
- •Предложить батарею тестов для проведения биологического мониторинга городской территории, расположенной в районе размещения базовой станции сотовой связи.
Применять на практике методы ботанического, зоологического, альгологического, микробиологического анализов почв в рамках биоиндикационного подхода.
Почва является естественной средой обитания микроорганизмов. В ней имеются все условия для благоприятного их развития (достаточное количество влаги, органических и минеральных веществ). Из природных субстратов почва обильно заселена микроорганизмами, которые составляют ее постоянную микрофлору. Санитарно-гигиеническая роль этой микрофлоры огромна. Почвенные микроорганизмы участвуют в минерализации органических отбросов, самоочищении почвы, в круговороте веществ в природе.
В почву могут попадать патогенные микроорганизмы со сточными водами, с трупами людей и животных. В связи с этим почва может служить источником распространения возбудителей инфекционных болезней, через почву загрязняются объекты окружающей среды, может происходить обсеменение сапрофитными и болезнетворными микроорганизмами сырья, пищевых продуктов, кормов.
Количественный и видовой состав микроорганизмов в почве обусловлен содержанием в ней органических веществ, влаги, рН, температурой, климатическими условиями и т.д.
В составе микрофлоры почвы принято выделять так называемые физиологические группы микроорганизмов, которые участвуют в различных процессах и на разных этапах постепенного разложения органических веществ, к которым относятся:
1. Аммонофикаторы (гнилостные).
2. Нитрифицирующие бактерии.
3. Азотофиксирующие.
4. Бактерии, расщепляющие клетчатку, а также вызывающие различные брожения (молочнокислое, спиртовое, маслянокислое и др.)
5. Бактерии, участвующие в круговороте серы, железа, фосфора других элементов.
В почве могут быть и патогенные бактерии, продолжительность их выживаемости зависит от вида и условий внешней среды.
Краткий санитарно-бактериологический анализ почвы включает определение двух показателей: общего количества микробов (в 1 г почвы) и коли-титра.
Отбор проб почвы. На обследуемой территории до 1000 м выделяют два участка по 25 м2 каждый: один участок выбирают вблизи, другой – вдали от источника загрязнения. С каждого участка отбирают среднюю пробу, составленную из 5 образцов, взятых по диагонали или в четырех точках по краям и в одной в центре. Образцы берут на глубине до 20 см, при исследовании почвы скотомогильников – ниже глубины захоронения не менее чем на 25 см, Пробы отбирают стерильной железной лопаткой, совком или специальным буром в стерильные широкогорлые банки, которые закрывают ватными пробками. К банке приклеивают этикетку с датой и номером отобранной почвы.
Определение общего микробного числа (ОМЧ)
Из последних 3-4 пробирок приготовленных разведений берут 1 мл и переносят в стерильные чашки Петри (не менее двух чашек на каждое разведение). В эти чашки заливают по 10 мл расплавленного и охлажденного до 45°С МПА и тщательно перемешивают. Посевы культивируют в термостате при 37°С 24-48 ч.
Учет результатов проводят путем подсчета выросших колоний и определения среднеарифметического числа. Полученное число колоний умножают на степень разведения исследуемой почвы, получая число бактерий в 1 г почвы.
Определение коли-титра почвы методом бродильных проб с использованием среды Кесслера. Исследования проводят в три этапа. На первом этапе готовят разведения: для чистых почв от 1:10-1 до 1:10-3: для загрязненных – от 1:10-3 до 1:10-6 . После тщательного перемешивания 1 мл полученной суспензии из различных разведений переносят в пробирку с 9 мл среды Кесслера (на 1 л дистиллированной воды 10 г пептона, 50 мл бычьей желчи, 2,5 г лактозы, 4 мл 1%-ного водного раствора генцианвиолета). Посевы культивируют при 43°С в течение 48 часов.
На втором этапе исследования просматривают посевы на среде Кесслера. Из пробирок с наличием газа продолжают высев на среду Эндо. Посевы культивируют при 37°С в течение 24 ч.
На третьем этапе исследуют колонии, выросшие на среде Эндо. Отбирают колонии, типичные для бактерий группы кишечных палочек, готовят из них мазки, красят по Граму, микроскопируют. При обнаружении в мазках коротких полиморфных грамотрицательных палочек производят высев из этих колоний на среду Кесслера для подтверждения газообразования в чистой культуре.
Окраска по методу Грама.
1. На фиксированный мазок нанести карболово-спиртовой раствор генцианового фиолетового через полоску фильтровальной бумаги. Через 1—2 мин ее снять, а краситель слить.
2. Нанести раствор Люголя на 1—2 мин.
3. Обесцветить этиловым спиртом в течение 30—60 с до прекращения отхождения фиолетовых струек красителя.
4. Промыть водой.
5. Докрасить водным раствором фуксина в течение 1—2 мин, промыть водой, высушить и микроскопировать.
Грамположительные бактерии окрашиваются в темно-фиолетовый цвет, грамотрицательные — в красный (рис. 2.2.1; на вклейке). В основе этого метода лежит избирательное обесцвечивание — удаление комплекса генцианового фиолетового с йодом под действием спирта. Результат окраски по методу Грама определяется особенностями строения и химического состава клеточной стенки бактерий и зависит от способности удерживать образовавшийся в процессе окраски комплекс ген-цианового фиолетового с йодом.
Фирмикутные бактерии окрашиваются грамположительно, поскольку имеют многослойный пептидогликан, связанный с тейхоевыми кислотами. Последние обусловливают прочную фиксацию красителя и резистентность к обесцвечиванию спиртом. Грациликутные бактерии окрашиваются грамотрица-тельно.
Окраска по методу Грама имеет важное дифференциально-диагностическое значение и широко используется в микробиологии. К грамположительным бактериям относятся стафилококки, стрептококки, коринебактерии дифтерии и др., к грам-отрицательным — гонококки, менингококки, кишечная палочка и др. Некоторые виды бактерий (клостридии, гарднереллы) могут окрашиваться по методу Грама вариабельно в зависимости от возраста культуры, особенностей культивирования и других факторов, воздействующих на структуру клеточной стенки.
ХАРАКТЕРИСТИКА КАЧЕСТВАПОЧВЫ С ПОМОЩЬЮ РАСТЕНИЙ-ИНДИКАТОРОВ
Принцип метода основан на учете видового разнообразия макрофитов и их индикаторной значимости. Фитоиндикаторами называют растения, растительные сообщества или их особенности, указывающие на какие-то конкретные свойства среды. Так, с помощью растений можно выявить отдельные признаки почв: их механический состав, влажность, кислотность, засоленность, обеспеченность питательными веществами.
Различают прямые и косвенные индикаторы. Первые непосредственно связаны с объектом индикации, т. е. с каким-то конкретным условием среды, и зависят от него. Косвенные индикаторы не имеют непосредственной связи с объектом индикации, они показывают предметы или явления, которые, в свою очередь, могут быть связаны с индикатором, интересующим человека. Например, на урановых месторождениях очень часто можно встретить различные виды астрагалов (Astragalus pattersonii, A. bisulcutus, A. racemosus в штате Колорадо, США). Эти растения, накапливая до 1,5% селена, являются прямыми его индикаторами, но, поскольку селен встречается на урановых месторождениях, то по отношению к урану астрагалы будут косвенными индикаторами.
Растения могут быть индикаторами как на всем протяжении своего ареала, так и в какой-то его части. В зависимости от этого выделяют универсальные (панареальные) и локальные индикаторы. Если связь между индикатором и объектом индикации наблюдается по всему ареалу, индикатор называется универсальным. Гораздо чаще приходится иметь дело с локальными индикаторами, связанными с объектом индикации только в какой-то части своего ареала.
Для практических целей следует знать, насколько надежен и эффективен тот или иной индикатор, поэтому индикаторы характеризуют по достоверности и значимости. Достоверность — это степень сопряженности индикатора с объектом индикации. Абсолютно достоверным считается индикатор, которому в 100 % случаев соответствует объект индикации. Для расчета показателя достоверности берут определенное число эталонных участков или площадок (обычно 100), где обязательно имеется индикатор. Среди них есть и такие, где индикатор встречается вместе с объектом индикации. Процентное соотношение этих участков и участков с индикатором, но без объекта индикации служит количественным показателем достоверности индикатора. Эталонные участки обычно выбираются в одном экотопе с помощью квадратной рамки размером 100 х 100 см.
Коэффициенты достоверности и значимости являются важными характеристиками индикаторных свойств растения. Если они достаточно высокие, можно начинать фитоиндикацию. Для этого в таблицу вносят названия всех индикаторных видов, обнаруженных на площади 10м2. Растениям, характеризующим свойства почвы, присуждаются номера: оценка влажности: — гигрофиты; — ксерофиты; механический состав: — пелитофиты; — алевритофиты; — псаммофиты; оценка кислотности: — крайние ацидофилы; — умеренные ацидофилы; — слабые ацидофилы; — ацвдофилнейтральные; — околонейтральные; — нейтрально-азофильные; достаток питательных веществ в почве:
1 — эвтрофы; — мезотрофы; — олиготрофы.
Частоту встречаемости учитывают по девятибалльной шестиступенчатой шкале со следующими обозначениями: 1 — очень редко, 2 — редко, 3 — нередко, 5 — часто, 7 — очень часто, 9 — масса.
По
шкале индикаторных видов растений,
характеризующих кислотность почв![]() почвы
исследуемого участка соответствует
6,0. Вычисляют погрешность. Оценку проводят
на 5%-м уровне значимости с точностью до
0,1.
почвы
исследуемого участка соответствует
6,0. Вычисляют погрешность. Оценку проводят
на 5%-м уровне значимости с точностью до
0,1.
Альгологический анализ почвы
В настоящее время в альгодиагностике определились три направления:
1) выявление приуроченности группировок водорослей к тем или иным почвам и протекающим в них процессам;
2) поиск видов-индикаторов определенных почвенных свойств;
3) использование некоторых видов водорослей в качестве тест-объектов при анализе современного состояния почв.
В основе почвенно-альгологических индикационных методов лежит следующее положение: зональности почв и растительности соответствует зональность водорослевых группировок. Она проявляется в общем видовом составе и комплексе доминантных видов водорослей, в наличии специфических видов, в характере распространения по почвенному профилю, в преобладании определенных жизненных форм.
Основными факторами, контролирующими особенности альгогруппировок являются степень сомкнутости растительного покрова, наличие подстилки на поверхности почвы, водный и солевой режим.
Определенным почвообразовательным процессам соответствуют определенные альгосинузии:
Подзолообразовательный -простая группировка водорослей с преобладанием одноклеточных зеленых и желто-зеленых, устойчивых к низкому рН. Незначительное разнообразие видов и небольшая биомасса.
Дерновый -большое разнообразие видов при равном числе сине-зеленых и зеленых и значительным числом видов желто-зеленых и диатомовых. Значительная биомасса.
Болотный -разнообразие видов и небольшая масса. Доминирование зеленых и наличие гидрофильных форм.
Степной -преобладание сине-зеленых и одноклеточных зеленых-убиквистов. Невысокая биомасса.
Солонцовый -доминирование диатомовых. Низкая масса и небольшое видовое разнообразие.
Осолодение -доминирование зеленых и желто-зеленых.
Пустынный -низкая численности и разнообразие желто-зеленых и диатомовых, доминирование сине-зеленых нитчатых форм.
Зональные особенности альгосинузий.
Вопреки бытующим представлениям о космополитизме водорослей, в последнее время убедительно показано, что в соответствии с географическими и экологическими особенностями биогеоценозов своеобразны и их альгосинузии.

Различия выражаются в общем систематическом составе водорослей, в составе доминирующих и специфических видов, в их экологической характеристике.
Зоологический анализ почвы
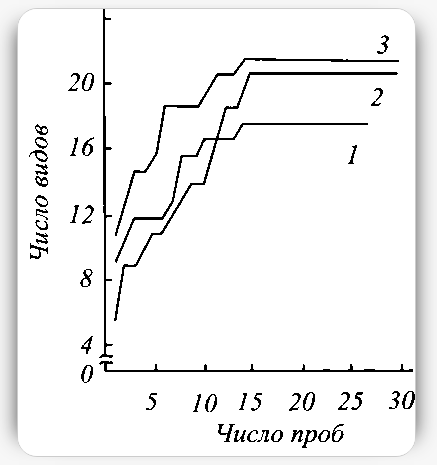
Одна из важнейших методических трудностей почвенно-зоологических исследований - полнота учета видового состава исследуемых групп в данном биотопе или районе. Количественные учеты в почвенных пробах охватывают относительно небольшие площади, в связи с чем постоянно возможен недоучет малочисленных или спорадично обитающих видов.
Для восполнения этих пробелов при учете крупных форм, например дождевых червей, личинок насекомых, параллельно с количественными пробами проводятся произвольные сборы, охватывающие возможно большее разнообразие экологических условий в пределах исследуемого типа сообщества. Труднее обстоит дело при работе с мелкими почвенными беспозвоночными - ногохвостками, клещами. Наиболее надежным способом выявления фауны этих групп служит разборка почвенных количественных проб, повторность которых, однако, всегда ограничена ввиду большой трудоемкости.
Некоторые методы качественного сбора этих групп (кошение сачком, вылов эксгаустером, флотация и т.д.) также весьма трудоемки и не всегда дают желаемые результаты вследствие крайней выборочности. В связи с этим при учете мелких почвенных беспозвоночных особенно большое значение приобретает проблема оптимального числа проб, которое должно определяться не только требованиями статистической достоверности, но и полнотой выявления видового состава. Повышение его полноты может быть достигнуто двумя путями: увеличением числа (или размера) проб и более рациональным их размещением. При этом необходимо учитывать особенности изучаемых групп и экологические условия в исследуемых биотопах.
Естественно, что в разных условиях для этой цели требуется разное число проб. На рисунке показаны результаты учетов коллембол на Западном Таймыре с помощью вороночного эклектора в пробах 5x5 см. Кривые отражают увеличение числа фиксируемых в данном биотопе видов по мере просмотра проб. На всех кривых отчетливо выражен резкий перелом. Вероятно, дальнейшее увеличение повторности может прибавить лишь немного видов. В полигональной и бугорковой осоково-моховых тундрах при повторности в 30 проб число видов увеличивалось лишь при разборе первых 14—15, тогда как следующие 15 проб не прибавили к этому списку ни одного вида. Очевидно, наблюдаемый перелом кривой определяется главным образом суммарной площадью проб. При увеличении объема проб момент относительно полного выявления видов в данном месте, вероятно, наступил бы раньше.