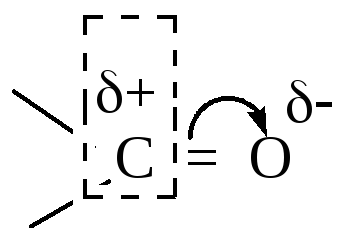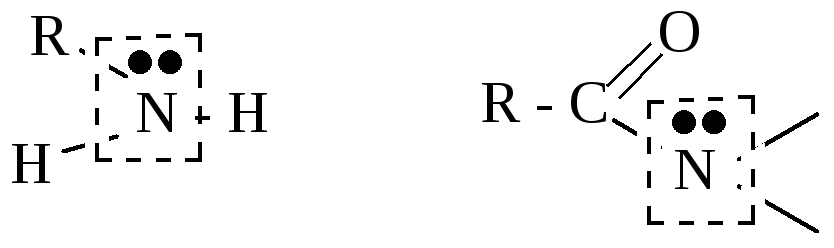- •3. Основные понятия о реакционной способности органических молекул
- •1. Концепция теории мезомерии.
- •2. Концепция теории резонанса (Полинг, 1928 г.).
- •3. Делокализованное π-облако изображается пунктиром (в цикле – сплошной линией).
- •4. Классификация химических реакций и промежуточных частиц
- •Стабилизация интермедиатов.
- •Примеры построения названий по систематической номенклатуре
- •7. Кислотные и основные свойства органических соединений
- •Кислотные и основные функции веществ
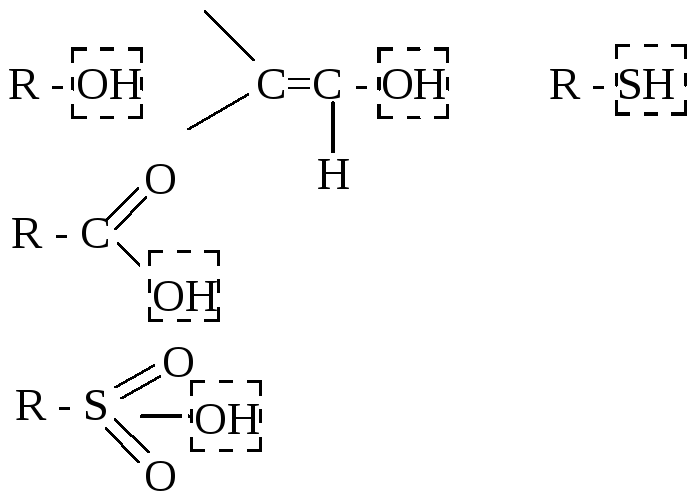
- •Кислотность и основность по Бренстеду-Лоури.
- •Примеры.
- •Кислотность спиртов.
- •Сольватация аминов.
- •Кислоты и основания Льюиса.
- •Жесткие и мягкие кислоты и основания по Пирсону (жмко).
- •8. Углеводороды
- •8.1 Алканы
- •5. Воздействие анаэробных бактерий на растительные остатки:
- •6.1 Гидролиз карбидов:
- •7.1 Гидрирование алкенов:
- •7.2 Гидрирование алкадиенов:
- •7.3 Гидрирование алкинов:
- •1. Реакции замещения атомов водорода при взаимодействии с активными радикалами.
- •1.1.1 Фтор:
- •1.1.3 Бром:
4. Классификация химических реакций и промежуточных частиц
Химическая реакция – это следствие перераспределения электронов внешних оболочек атомов реагирующих веществ, в результате чего разрушаются одни и возникают новые химические связи.
Компоненты реакции:
субстрат (с реакционным центром);
атакующий реагент;
интермедиат;
катализатор (или ингибитор);
конечные продукты реакции.
Химизм реакции – описание реакции с указанием только исходных веществ, конечных продуктов и условия проведения реакции.
Механизм реакции – это реальный путь, по которому протекает реакция. Описываемый в литературе механизм – гипотеза, предлагаемая для объяснения экспериментальных данных.
Движущей силой химических реакций является стремление к образованию новых, обладающих меньшей свободной энергией, и, следовательно, более стабильных систем.
Энергия активации – это избыточное количество энергии, которое необходимо придать исходной системе для преодоления энергетического барьера, чтобы прошла реакция.
Активированный комплекс – создается при сближении молекул, обладает наивысшей свободной энергией.
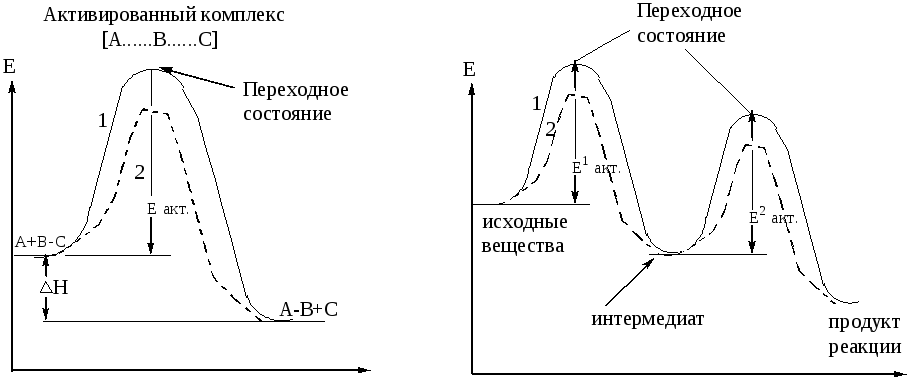
Ход одностадийной реакции Ход двухстадийной реакции
1 – некатализируемая реакция
2 – катализируемая реакция
Рисунок 20 – Энергетическая диаграмма химических реакций
Переходное состояние – участок энергетического профиля реакции, соответствующий энергии активированного комплекса.
Интермедиат – промежуточный продукт многостадийной реакции.
Лимитирующая стадия – определяющая скорость всего много-стадийного процесса, стадия образования интермедиата.
Катализатор – понижает величину энергии активации, увеличивает скорость химической реакции.
Реакционная способность – способность вещества вступать в ту или иную химическую реакцию и реагировать с большей или меньшей скоростью.
Органическую химию отличает чрезвычайное разнообразие превращений. Для ориентирования разработана классификация органических реакций по различным признакам. Все органические реакции подразделяют по механизму, направлению, молекулярности, агрегатному состоянию, принадлежности реагента или продуктов к различным классам соединений.
По характеру реагирующих частиц и типу разрыва ковалентной связи реакции могут быть:
гомолитическими;
гетеролитическими.
Гомолитические (радикальные реакции) сопровождаются гомолитиче-ским разрывом ковалентной связи. Реагентами в таких реакциях обычно являются радикалы либо молекулы, легко разрушающиеся до радикалов в условиях реакции, или атомы. В условия осуществления гомолитических реакций включают газовую фазу или неполярный растворитель, высокие температуры, воздействие светом или высокой энергией.
Гетеролитические (ионные, полярные) реакции сопровождаются гетеролитическим распадом связи. В отличие от гомолитических такие реакции протекают в полярной среде при умеренных температурах и нередко требуют присутствия катализатора. Гетеролитические реакции по характеру реагента подразделяют на два типа:
нуклеофильные реакции, в которых образование новой связи осуществляется за счет электронов реагента (нуклеофила);
электрофильные реакции, в которых образование новой связи осуществляется за счет электронов субстрата, реагент – электрофил.
Такое деление реакций справедливо для элементарных стадий, т. к. во многих реакциях происходит одновременно разрыв и образование новых связей за счет перемещения электронов с образованием переходного комплекса.
По направлению и конечному результату (по суммарному изменению, происходящему в исходных молекулах) различают следующие реакции:
реакции, протекающие с сохранением углеродного скелета;
реакции, протекающие без сохранения углеродного скелета.
Реакции, протекающие с сохранением углеродного скелета:
реакции присоединения – А (от англ. addition);
реакции отщепления – E (от англ. elimination);
реакции замещения – S (от англ. substitution);
реакции перегруппировки (изомеризации);
конденсации;
поликонденсации;
полимеризации;
перциклизации.
Реакции, протекающие без сохранения углеродного скелета:
удлинения цепи;
укорачивания цепи;
циклизации;
раскрытия цикла;
сжатия и расширения цикла.
По предпочтительному образованию одного из нескольких возможных изомеров:
региоселективные и региоспецифичные;
стереоселективные и стереоспецифичные;
хемоселективные;
кислотно-основные взаимодействия;
согласованные реакции.
Региоселективные реакции – реакции, предпочтительно протекающие по одному из нескольких реакционных центров с образованием смеси структурных изомеров с преобладанием одного из них.
Региоспецифичные реакции – реакции, протекающие с образованием только одного из изомеров.
Стереоселективные реакции – реакции, протекающие с предпочтительным образованием одного из стереоизомеров.
Стереоспецифические реакции – реакции, в результате которых из данного стереоизомерного соединения получается только один стереоизомер.
Хемоселективные реакции – реакции, предпочтительно протекающие по одной из родственных групп.
Согласованные (синхронные) реакции – реакции, в которых разрыв старых связей и образование новых связей происходит одновременно без участия радикалов или ионных частиц.
Молекулярность органической реакции определяют по числу молекул, в которых происходит реальное изменение ковалентных связей на лимитирующей стадии реакции. Различают следующие виды реакций:
мономолекулярные – на лимитирующей стадии участвует одна молекула; бимолекулярные – две молекулы и т. д.
По агрегатному состоянию реагирующих веществ реакции подразделяют на гомогенные, т. е. протекающие в одной фазе и гетерогенные, идущие на границе раздела фаз.
Часто органические реакции классифицируют по принадлежности реагентов или продуктов реакции к различным классам соединений. Например – гидрирование, гидратация, галогенирование, алкоголиз, эфиролиз и т. д.
Особенности ионных и радикальных реакций.
Ионные реакции
проходят в полярных растворителях;
ускоряются под действием кислотных или основных катализаторов;
скорость реакции не изменяется в присутствии акцепторов свободных радикалов;
в кинетическом отношении являются реакциями первого или второго порядка.
Радикальные реакции
проходят в неполярных растворителях или в газовой фазе;
ускоряются под действием света, нагревания или свободными радикалами, образующимися при разложении других веществ;
замедляются веществами, легко реагирующими со свободными радикалами;
в кинетическом отношении являются цепными.
Таблица 10 – Типы реакций (примеры)
|
Класс |
Название реакционного центра |
Атакующий реагент |
Тип, механизм реакции |
|
Алканы Циклоалканы |
тетрагональный атом углерода с неполярными связями
|
свободный радикал |
SR |
|
Алкены |
тригональный атом углерода (sp2), экранированный с двух сторон π-облаком |
электрофильный |
AE |
|
Алкины |
дигональный атом углерода (sp), экранированный цилиндрическимπ-облаком
|
электрофильный |
AE |
|
Арены |
sp2-гибридизованные атомы углерода, экранированные замкнутым π-облаком
|
электрофильный |
SE |
|
Спирты, галогенопроизводные углеводородов |
тетрагональный (sp3) или тригональный (sp2) электрофильный атом углерода
|
нуклеофильный |
SN1 или SN2 |
|
Альдегиды Кетоны |
sp2-гибридизованный электрофильный (электронодефицитный) атом углерода
|
нуклеофильный |
AN SN (ANE) |
|
Продолжение 10 | |||
|
Спирты, фенолы, |
ОН-кислотый центрSH-кислотный центр |
основание |
диссоц-я, образов-е |
|
енолы, карбоновые кислоты, сульфоновые кислоты, тиолы |
|
|
солей |
|
Галогеналканы Спирты |
β-СН-кислотный центр |
основание |
Е1 илиЕ2 |
|
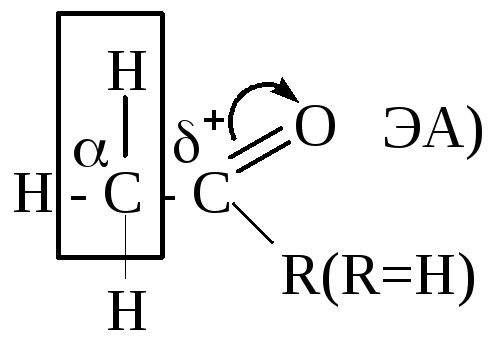
Альдегиды Кетоны |
α-СН-кислотный центр
|
основание |
альд. конден-я, галоформ. реакция |
|
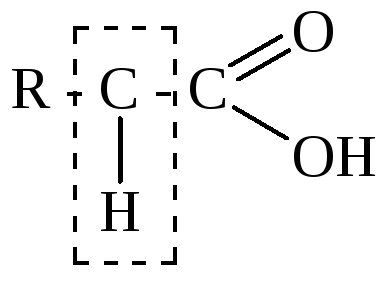
Карбоновые кислоты |
α-СН-кислотный центр
|
основание |
галоген-е |
|
Амины Амиды кислот
|
Основный центр
|
кислота |
образов-е солей |
Символы обозначения механизмов реакций:
SR – реакция радикального замещения;
АЕ – реакция электрофильного присоединения;
AN – реакция нуклеофильного присоединения;
SE – реакция электрофильного замещения;
SN1 – мономолекулярная реакция нуклеофильного замещения;
SN2 – бимолекулярная реакция нуклеофильного замещения;
Е1 – мономолекулярная реакция элиминирования;
Е2 – бимолекулярная реакция элиминирования;
ААС2 – кислотно-катализируемая ацильная бимолекулярная реакция;
ВАС2 – ацильная бимолекулярная реакция, катализируемая основанием.
Факторы, определяющие реакционную способность органических соединений
I. Статические факторы (нереагирующее состояние):
электронные факторы, обусловленные распределением электронной плотности в молекуле, предопределяющие появление реакционных центров в субстрате и направление атаки на него соответствующего реагента;
стерический фактор, обусловливающий пространственные затруднения для атаки реагентом реакционного центра субстрата, окруженного объемными заместителями.
II. Динамические факторы (проявляются в процессе многостадийной реакции), определяющие предпочтительное протекание реакции в направлении образования наиболее стабильного интермедиата.
Кинетически контролируемая реакция – реакция, завершающаяся получением изомера, скорость образования которого наибольшая (в мягких условиях).
Термодинамически контролируемая реакция – преимущественное образование изомера с большей термодинамической устойчивостью (в более жестких условиях).
Характеристика компонентов реакций. Тип расщепления ковалентной связи. Каждая органическая реакция приводит к образованию соответствующих продуктов, т. е. характеризуется определенным направлением. С другой стороны, образование продуктов реакции протекает обычно через специфические для данной реакции промежуточные стадии. Из участвующих в реакции нескольких веществ одно часто рассматривается в качестве субстрата – объекта превращения, а другое реагента – атакующее вещество. При выборе реагента и субстрата руководствуются следующими правилами:
в качестве субстрата выбирается соединение, один из атомов углерода которого является реакционным центром, тогда реагентом является вещество, атакующее С – атом субстрата;
если в результате реакции образуется новая С–С связь, то в качестве реагента рассматривается соединение, у которого в реакции участвует более полярная связь.
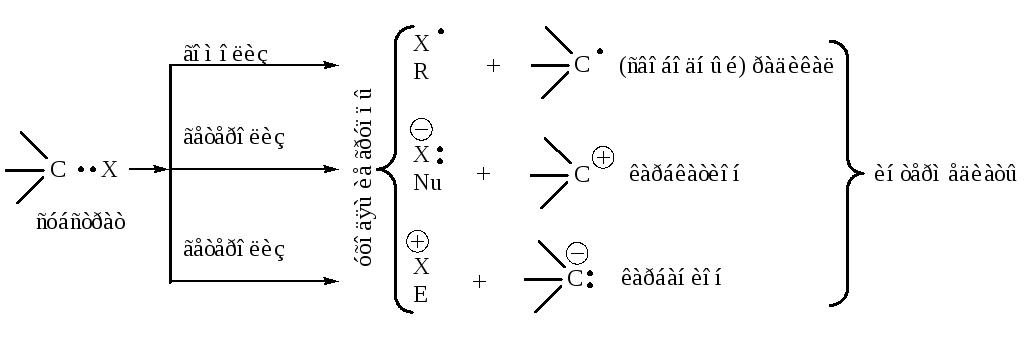
Субстрат – органическое соединение более сложного строения, чем реагент, поставляющее для образования новой связи атом углерода.
Уходящая группа – замещаемая часть субстрата (Х).
Электрофуг – уходящая группа без пары электронов.
Нуклеофуг – уходящая группа с парой электронов.
Реакционный центр – атом или группа атомов, непосредственно участвующих в данной химической реакции.
Классификация реагентов проводится по наличию сродства к ядру (нуклеофилы), к электронам (электрофилы) или к атомам (радикалы). Первые два типа реагентов имеют четное число электронов, радикалы несут неспаренный электрон.
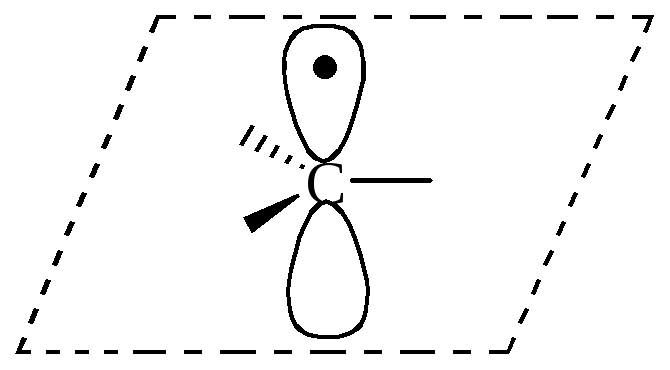
Свободные радикалы – атомы или частицы с неспаренным электроном.
Образуются при гомолитическом расщеплении ковалентной связи в результате:
фотолиза;
термолиза;
окислительно-восстановительной реакции;
под действием ультразвука.
Электрофильный реагент (электрофильная частица, электрофил – Еδ+ или Е) – положительно заряженный ион, электронейтральная молекула с электронодефицитным атомом или сильнополяризованная молекула, образующаяся в реакции комплексообразования с кислотами Льюиса. Электрофил – акцептор электронной пары. Чем выше электронодефи-цитность электрофила, тем выше его электрофильность.
Нуклеофильный реагент (нуклеофильная частица, нуклеофил – Nu) – отрицательно заряженный ион или электронейтральная молекула с атомом, имеющим свободную электронную пару, идущую на образование новой ковалентной связи. Нуклеофил – донор электронной пары. Нуклеофильность возрастает с уменьшением электроотрицательности атома (сравниваются элементы одного периода) и увеличением поляризуемости (сравниваются элементы одной группы). ЭД – заместители увеличивают, ЭА – заместители ослабляют нуклеофильные свойства. Анионы более нуклеофильны, чем нейтральные молекулы.
Таблица 11 – Примеры реагентов
|
Свободные радикалы |
Электрофилы |
Нуклеофилы | |||
|
строение |
название |
строение |
название |
строение |
название |
|
|
галоген |
Н+ |
протон |
|
гидрид-ион |
|
|
метил- |
Н3О+ |
катион гидроксония |
|
вода |
|
|
изопропил- |
N+O2 |
катион нитрония |
|
гидроксид-ион |
|
Продолжение таблицы 11 | |||||
|
|
бензоил- |
N+O |
катион нитрозония |
|
цианид-ион |
|
|
бензоат- |
[Ar-NN]+ |
катион диазония |
|
хлорид, бромид-ион |
|
|
аллил- |
|
карбонил |
|
метоксид-ион |
|
|
бензил- |
SO3 |
триоксид серы |
|
метанол |
|
– |
– |
R-C+=O |
катион ацилия |
|
метантиол |
|
– |
– |
|
– |
|
метанамин |
|
– |
– |
– |
– |
|
диметило-вый эфир |
Амбидентный ион – термин, используемый для описания активных частиц, обладающих двумя различными взаимодействующими центрами, каждый из которых, в зависимости от условий, может участвовать в образовании различных химических связей.
Интермедиат – частица со временем жизни больше одного молекулярного колебания (10-13 сек). Интермедиат образуется из реагентов и ему соответствует локальный минимум потенциальной энергии. Превращения интермедиата приводят к продуктам реакции.
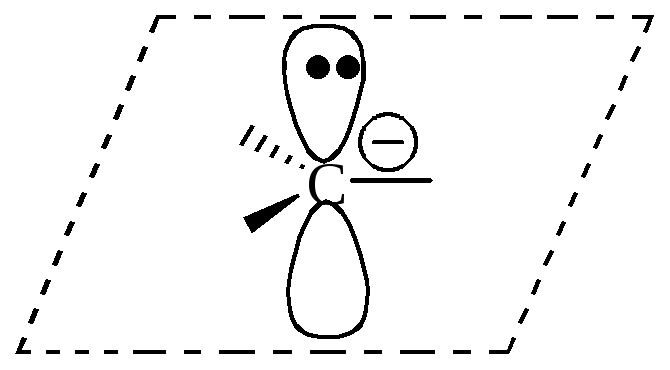
Карбанион – отрицательно заряженная частица (анион) имеющая четное число электронов, в которой отрицательный заряд (НЭП) полностью либо частично принадлежит одному или нескольким атомам углерода.
Карбен – термин, обозначающий частицы содержащие нейтральный атом углерода, имеющий два заместителя или два несвязывающих электрона, которые могут быть в синглетном или триплетном состоянии.
Карбин – термин, используемый для обозначения частицы Н·C: и ее производных (R·C:), в которых одновалентный атом углерода обладает тремя несвязанными электронами.
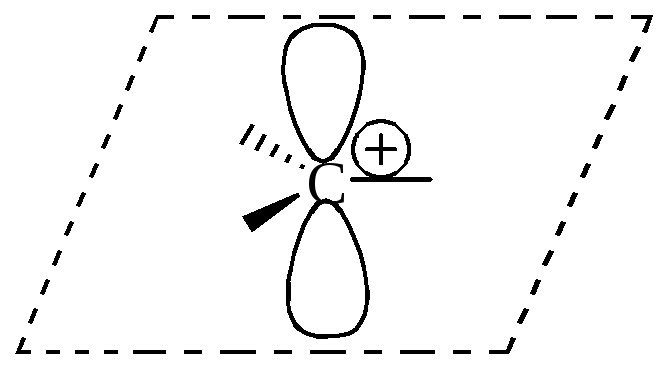
Карбкатион (карбениевый или карбониевый ион) – положительно заряженная частица, имеющая четное число электронов, в котором положительный заряд расположен на одном или нескольких атомах углерода. Часто этот термин применяют для карбкатионов, в которых атом углерода с избытком положительного заряда, обладает вакантной р-орбиталью.
Таблица 12 – Электронное строение интермедиатов.
|
Название интер-та |
Структ. |
Гибридизация |
Конфигурация | |
|
Свободный радикал |
|
sp2 |
плоская |
|
|
Карбкатион |
|
sp2 |
плоская |
|
|
Карбанион |
|
sp2 (в сопряженной системе)
|
плоская
|
|
|
sp3 (связан с sp3-гибридизованным атомом) |
тетраэдр. |
| ||