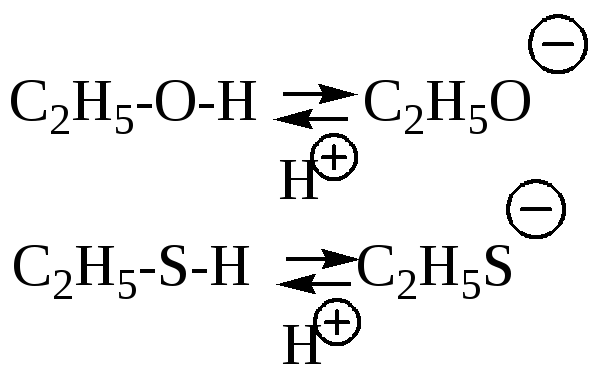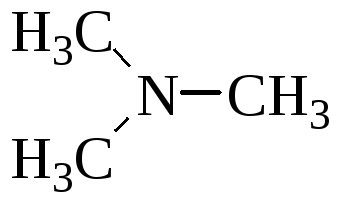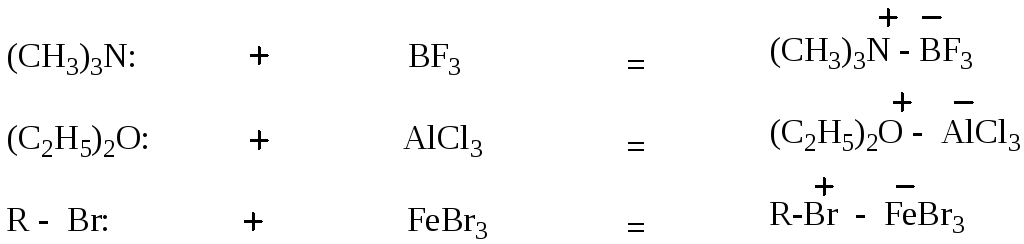- •3. Основные понятия о реакционной способности органических молекул
- •1. Концепция теории мезомерии.
- •2. Концепция теории резонанса (Полинг, 1928 г.).
- •3. Делокализованное π-облако изображается пунктиром (в цикле – сплошной линией).
- •4. Классификация химических реакций и промежуточных частиц
- •Стабилизация интермедиатов.
- •Примеры построения названий по систематической номенклатуре
- •7. Кислотные и основные свойства органических соединений
- •Кислотные и основные функции веществ
- •Кислотность и основность по Бренстеду-Лоури.
- •Примеры.
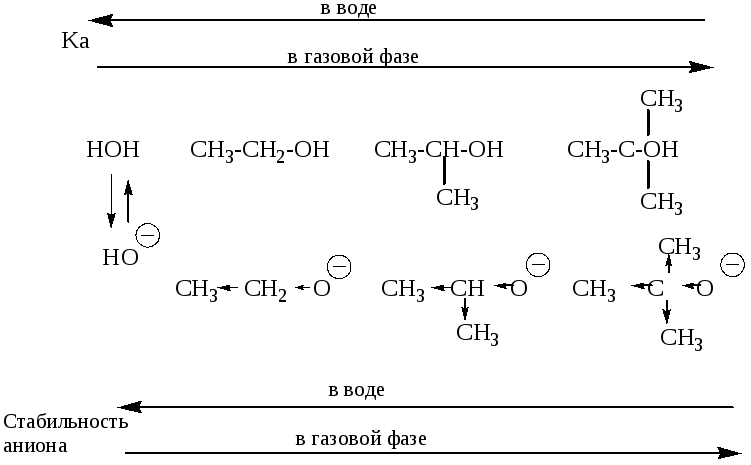
- •Кислотность спиртов.
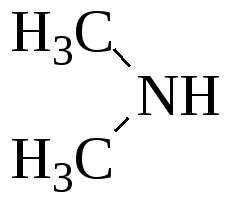
- •Сольватация аминов.
- •Кислоты и основания Льюиса.
- •Жесткие и мягкие кислоты и основания по Пирсону (жмко).
- •8. Углеводороды
- •8.1 Алканы
- •5. Воздействие анаэробных бактерий на растительные остатки:
- •6.1 Гидролиз карбидов:
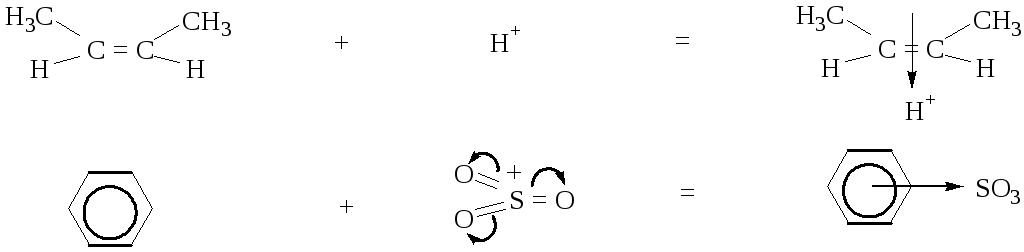
- •7.1 Гидрирование алкенов:
- •7.2 Гидрирование алкадиенов:
- •7.3 Гидрирование алкинов:
- •1. Реакции замещения атомов водорода при взаимодействии с активными радикалами.
- •1.1.1 Фтор:
- •1.1.3 Бром:
Примеры.
1. Электроотрицательность (учитывается для атомов одного периода).
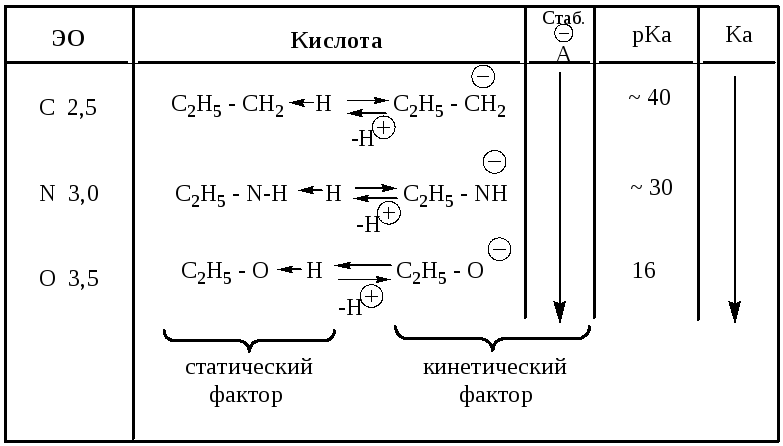
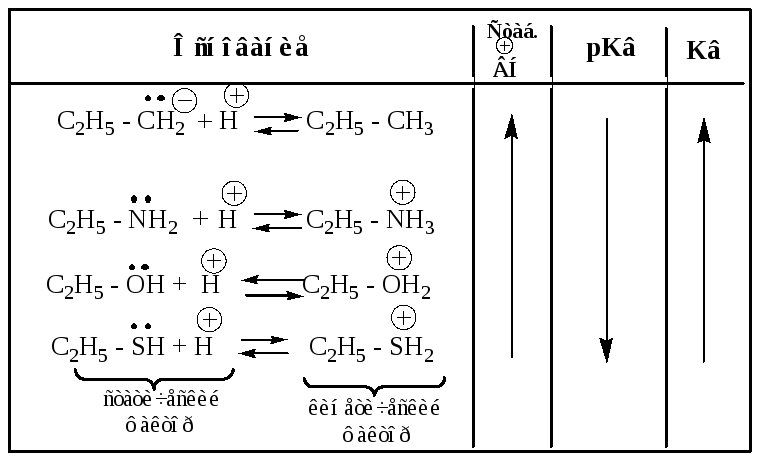
2. Поляризуемость (учитывается для элементов одной группы).
|
Атомный радиус |
Кислота |
|
Ка |
Основание |
|
Кв |
|
|
|
|
|
|
|
|
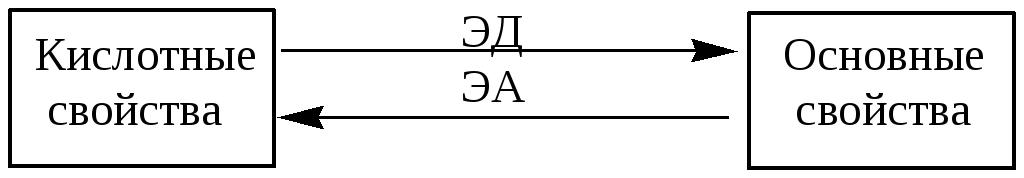
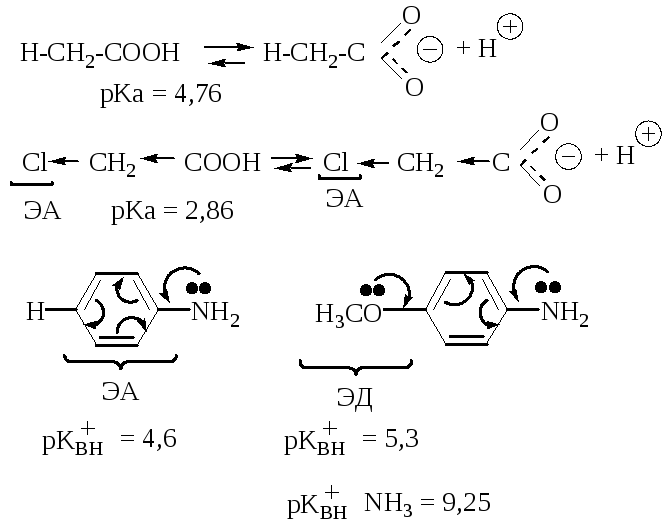
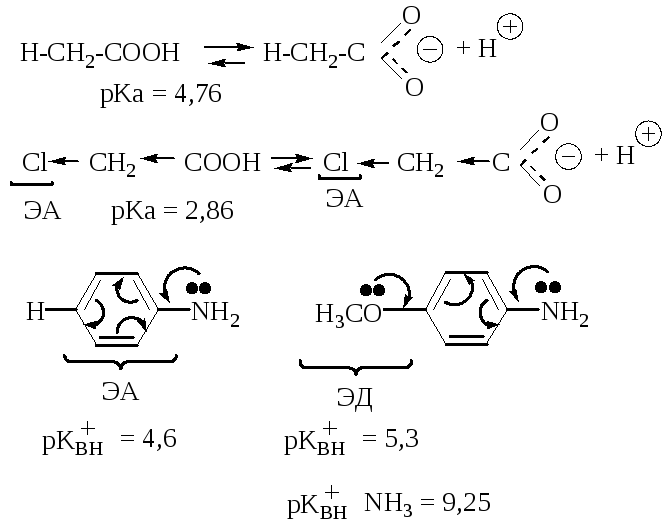
3. Электронные эффекты заместителей.
4. Стерический фактор.
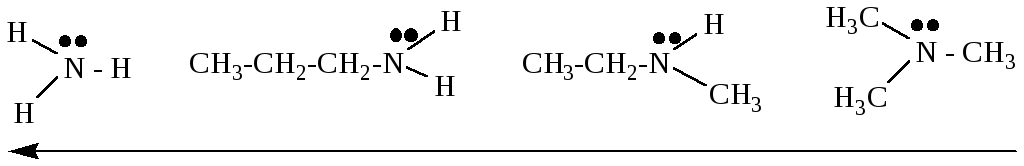
основность
5. Орто-эффект.
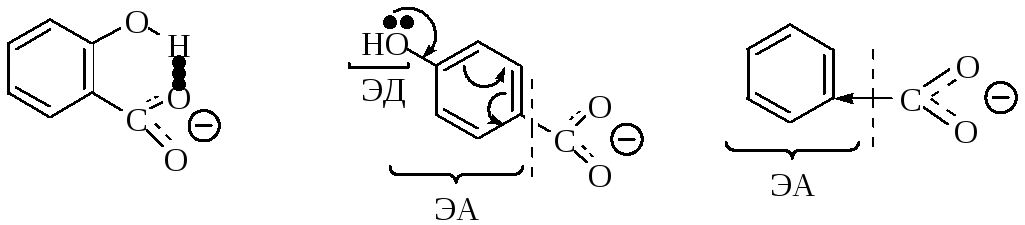
Салицилат-анион
Ка = 11· 10-5Ка = 3,3 · 10-5Ка = 6,6 · 10-5
6. Эффект сольватации. Сольватация – взаимодействие растворенных частиц с молекулами растворителя с образованием сольватов (гидратов, если растворитель – вода).
При сольватации иона происходит перераспределение заряда с участием окружающих его молекул растворителя, приводящее к стабилизации иона. Чем меньше размер иона и чем больше локализован в нем заряд, тем он лучше сольватирован, более стабилен.
В молекулах с резко различающимися по размеру углеводородными радикалами энергетический вклад сольватации больше, чем электронных эффектов. В растворе по сравнению с газовой фазой происходит обращение ряда кислотности и основности на противоположный.
Кислотность спиртов.
Сольватация аминов.
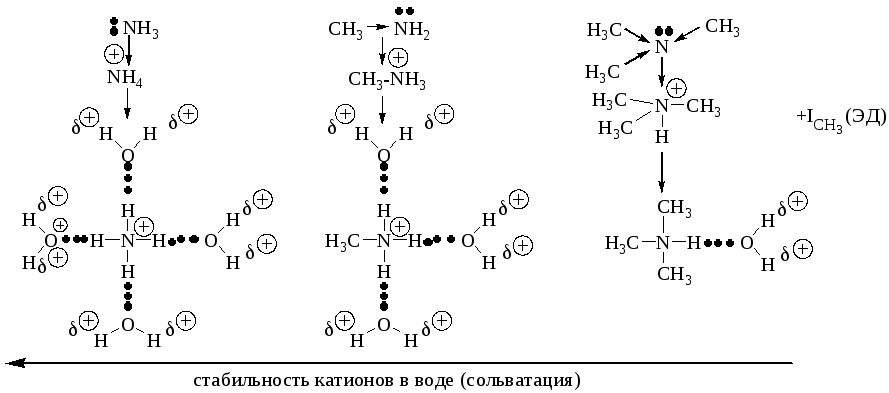
Таблица 16 – Основность алифатических аминов.
|
Амины |
+I CH3 (суммарный) |
Стерический эффект |
Эффект сольватации |
Суммарный эффект
|
|
NH3
CH3 – NH2
|
|
|
|
|
В молекулах, имеющих близкие по размерам углеводородные радикалы, энергетический вклад эффекта сольватации меньше, чем электронных эффектов. Порядок изменения кислотности и основности в газовой фазе и в водной среде совпадают.
Кислоты и основания Льюиса.
Кислоты Льюиса – акцепторы пары электронов, т.е. любая частица с вакантной орбиталью, которая способна дополнить свою электронную оболочку парой электронов.
Основания Льюиса – доноры пары электронов.
В кислотно-основной реакции кислота Льюиса представляет валентную орбиталь для электронной пары основания.
Таблица 17 – Взаимодействие между кислотами и основаниями Льюиса
|
n-Основания Льюиса |
Кислоты Льюиса |
Продукт нейтрализации (n-комплексы) |
|
| ||
|
π-Основания Льюиса |
Кислоты Льюиса |
π-Комплексы |
|
| ||
Жесткие и мягкие кислоты и основания по Пирсону (жмко).
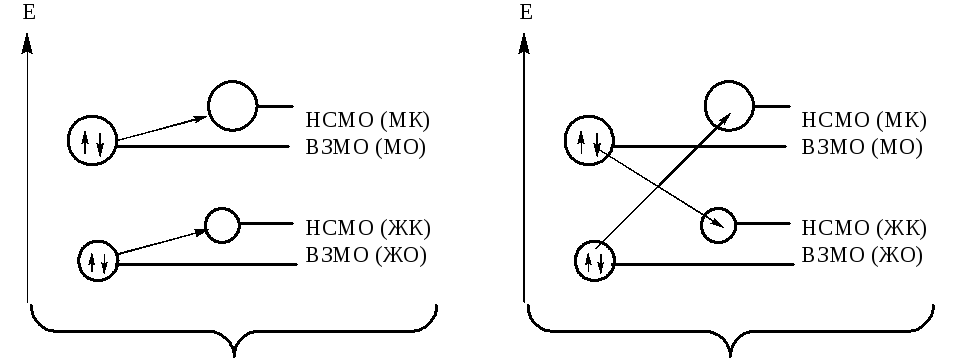
Жесткие кислоты – кислоты Льюиса, в которых акцепторные атомы малы по размеру, обладают большим положительным зарядом, большой электроотрицательностью и низкой поляризуемостью. НСМО имеет низкую энергию.
Мягкие кислоты – кислоты Льюиса, в которых акцепторные атомы большого размера с малым положительным зарядом, небольшой электроотрицательностью, высокой поляризуемостью. НСМО имеет высокую энергию.
Жесткие основания – донорные частицы, обладающие высокой электроотрицательностью, низкой поляризуемостью, трудно окисляю-щиеся. ВЗМО имеет низкую энергию.
Мягкие основания – донорные частицы с низкой электро-отрицательностью, высокой поляризуемостю, легко окисляющиеся. ВЗМО имеет высокую энергию.
Жесткие кислоты лучше координируются с жесткими основаниями, мягкие кислоты – с мягкими основаниями, взаимодействие между орбиталями с близкими энергиями эффективнее. Это выражается в большей скорости реакции и в образовании устойчивых соединений. Деление оснований и кислот на жесткие и мягкие не является абсолютным. В некоторых случаях трудно провести четкие границы.
Схематическое изображение взаимодействия жестких и мягких кислот и оснований.
Взаимодействие эффективно Взаимодействие не эффективно
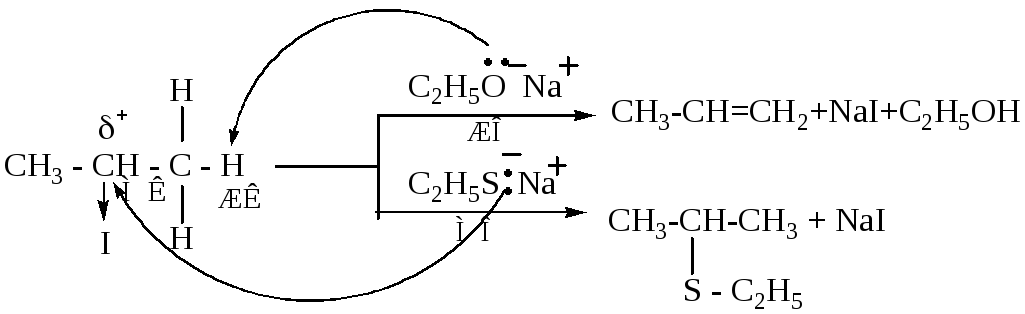
Таблица 18 – Жесткие и мягкие кислоты и основания
|
Основания |
Кислоты | ||
|
жесткие |
мягкие |
жесткие |
мягкие |
|
H2O, HO- ROH, RO-
Cl-, F- |
RSR, RSH, RS- H-, I-
R2C = CR2
|
H+, Na+, K+ Mg2+, Ca2+, Mn2+
Al3+, AlCl3
R – C+ = O |
Cu2+ I2
|
|
Промежуточные | |||
|
Br–, C6H5NH2,
|
Cu2+, Fe2+, R3C+, C6H5+ | ||
Примечание: ВЗМО– высшая занятая молекулярная орбиталь.
НСМО– низшая свободная молекулярная орбиталь.