
- •8.2 Алкены
- •3. Дегалогенирование вициальных дигалогеналканов:
- •5. Восстановление алкадиенов и алкинов:
- •7.2.4 Реакция Хека:
- •8. Реакции окисления.
- •10.1 Катионная полимеризация:
- •10.2 Анионная полимеризация:
- •10.3 Радикальная полимеризация:
- •8.3 Алкадиены
- •2. Получение алкадиенов-1,2 (аллены)
- •2.2.1 Присоединение галогенводорода:
- •2.2.2 Присоединение галогена:
- •2.2.3 Присоединение воды:
- •8.3.1 Каучук
- •8.3.2 Природные изопреноиды. Терпены
- •8.4 Алкины
- •4. Реакции отщепления.
- •1. Реакции присоединения.
- •1.1 Реакции электрофильного присоединения.
- •1.1.3 Гидрогалогенирование:
- •1.2 Реакции нуклеофильного присоединения:
- •2. Реакции окисления.
8.4 Алкины
Алкины, углеводороды ряда ацетилена, содержащие тройную связь. Простейшим алкином является этин С2Н2, открытый в 1836 году Э. Дэви в светильном газе, остальные углеводороды этого ряда рассматривают как его производные. Общая формула СnН2n–2.
Номенклатура алкинов. Для названия алкинов используют следующие номенклатуры:
тривиальную;
рациональную;
систематическую.
Тривиальная. Алкины имеют в названиях те же корни, что и алканы, исключение составляет ацетилен, название которого связано с ацетатом, (лат. acetum – уксус, это же происхождение имеют ацеталь и ацетон, последний раньше получали прокаливанием ацетата кальция).
Рациональная. В рациональной номенклатуре алкины рассматривают как алкилзамещенный ацетилен.
Систематическая (заместительная, международная, ИЮПАК). Систематическое название строят, принимая за главную цепь самую длинную углеродную цепь, содержащую тройную связь, которую обозначают суффиксом -ин. Нумерация цепи начинается со стороны, к которой ближе расположена тройная связь, которая может быть концевой (терминальной) или внутренней.
Изомерия. Для алкинов характерны следующие виды изомерии:
Структурная:
скелетная;
изомерия положения;
метамерия.
Способы получения.
1. Карбидный метод (Ф.Велер, 1862 г.):
СаС2
+ 2Н2О
![]() НС≡СН + Са(ОН)2
НС≡СН + Са(ОН)2
Карбид кальция можно рассматривать как металлорганическое соединение, содержащее сильно полярную связь углерод - металл:
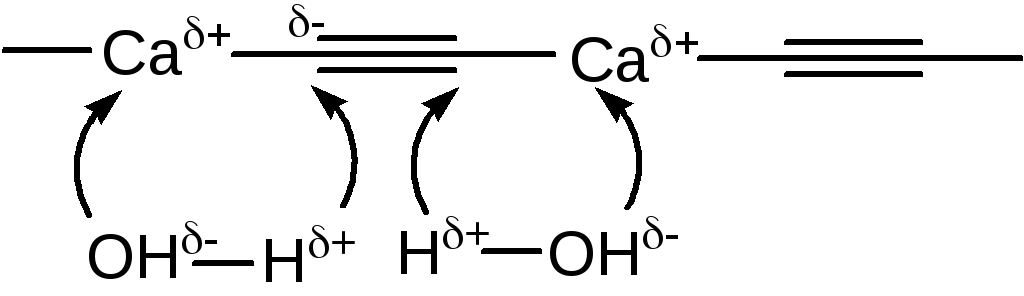
Аналогично реакция протекает для карбидов стронция, бария. Карбид магния в этих условиях образует пропин:
Mg2С3
+ 4Н2О
![]() СН3С≡СН
+ Mg
(ОН)2
СН3С≡СН
+ Mg
(ОН)2
2. Из простых веществ (М.Бертло, 1860 г.):
2С + Н2
![]() НС≡СН
НС≡СН
3. Пиролиз (1000-1200оС):
2СН4
![]() НС≡СН + 3Н2
НС≡СН + 3Н2
СН2=СН2![]() НС≡СН + Н2
НС≡СН + Н2
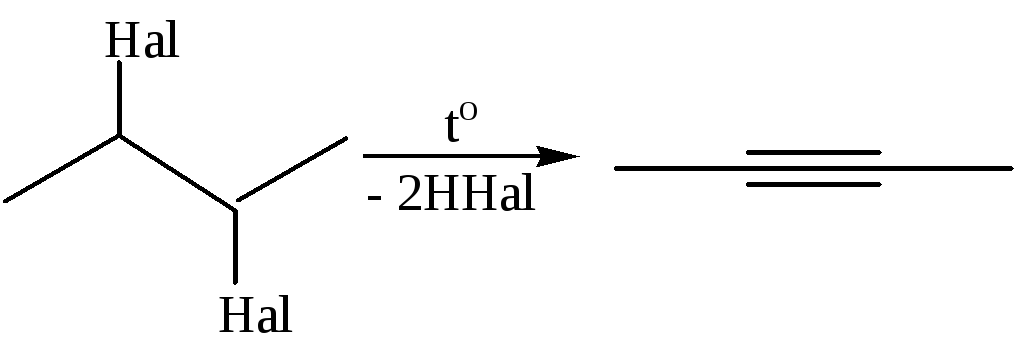
4. Реакции отщепления.
4.1 Дегалогенирование:
4.1.1
4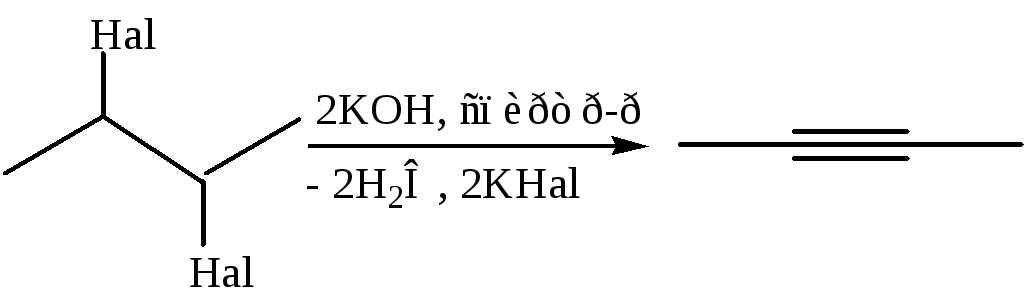 .1.2
.1.2
4.1.3
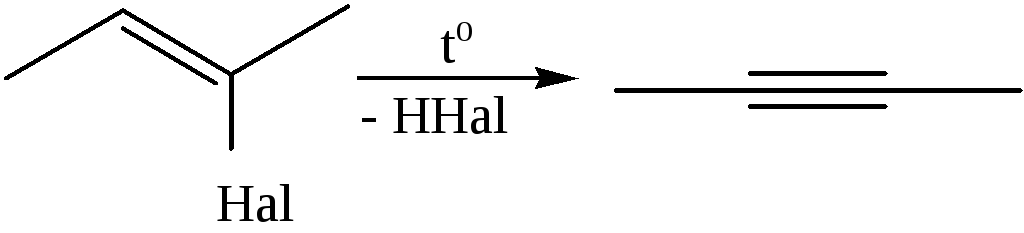
4.1.4

4.1.5
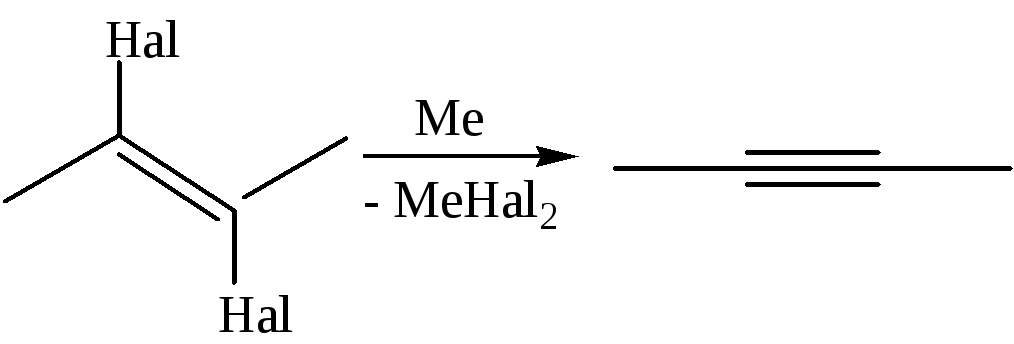
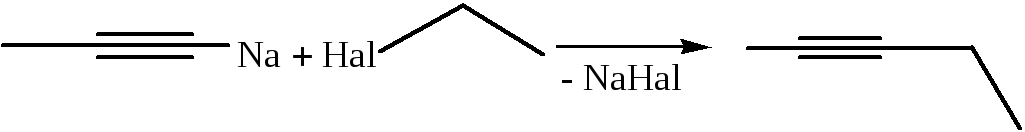
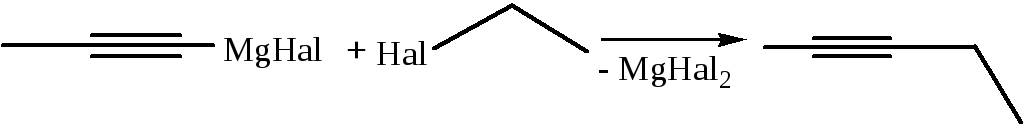
5. Алкилирование алкинов (Ж.И. Иоцич, 1902 г.):
6. Получение из природных источников. Соединения с сопряженными тройными связями выделены из сложноцветных, зонтичных растений. Например, из подсолнечника выделен углеводород желтого цвета – тридецен-1-пентаин-3,5,7,9,11:
![]()
Физические свойства алкинов. Низшие алкены – газы, не обладающие ни цветом ни запахом. Начиная с С17 алкины кристаллические вещества. Они имеют более высокие температуры кипения, чем алкены. Алкины с терминальной связью кипят ниже, чем соответствующие изомеры с внутренней связью. Плотности, температуры кипения, плавления у алкинов выше, чем у соответствующих алканов. Чем выше молекулярная масса алкинов, тем эта разница меньше. Строение алкинов позволяет низшим гомологам ацетилена образовывать плотно упакованные молекулярные кристаллические решетки по сравнению с алкенами и алканами. Это отражается на их физических свойствах (табл. 24).
Для алкинов характерна большая молекулярная рефракция, чем у алкенов, что свидетельствует о большей поляризуемости тройной связи.
Наличие sp-гибридных орбиталей для образования σ-связей приводит к их укорочению по сравнению с C–C и С–Н связями этилена и этана в соответствии с величиной ковалентных радиусов (табл. 21).
π-МО более компактны, чем у этилена, что несколько затрудняет реакции присоединения.
Таблица 24 – Физические свойства некоторых алкинов
|
Соединение |
|
Формула |
Температура, °С |
Плотность,
| |
|
плавления |
кипения | ||||
|
этин |
28 |
СН≡СН |
–81,8 |
–81,0 |
0,656* |
|
пропин |
40 |
СН3С≡СН |
–102,7 |
–23,2 |
0,670* |
|
бутин-1 |
52 |
СН3СН2С≡СН |
–125,7 |
+8,5 |
0,678* |
|
бутин-2 |
52 |
СН3С≡ССН3 |
–32,7 |
+27,0 |
0,691 |
|
пентин-1 |
64 |
СН3(СН2)2СН≡СН |
–105,7 |
+40,2 |
0,691 |
|
гексин-1 |
64 |
СН3(СН2)3С≡СН |
–131,9 |
+71,3 |
0,716 |
|
гептин-1 |
64 |
СН3(СН2)4С≡СН |
–80,9 |
+99,7 |
0,733 |
|
децин-1 |
64 |
СН3(СН2)7С≡СН3 |
–44,0 |
+174,0 |
0,766 |
|
октадецин-1 |
252 |
СН3(СН2)15С≡СН |
+27,0 |
+313,0 |
0,802 |
Примечание: * значения измерены при температуре кипения
Алкины с терминальной тройной связью обладают дипольным моментом большим, чем алкены с тем же числом атомов углерода, что свидетельствует о большей поляризации тройной связи под влиянием электронодонорных алкильных групп.
Алкины, подобно алканам и алкенам, нерастворимы в воде, но хорошо растворимы в органических растворителях – тетрахлорметане, бензоле, эфире.
Химические свойства. Характеристика реакционной способности. Алкины проявляют ряд особых свойств, возникновение которых связано с особенностями их электронного строения:
Следствием sp гибридизации является повышенная электроотрица-тельность атомов углерода, что значительно уменьшает способность π-электронного облака к поляризации под действием внешних агентов.
Длина С–С связи в алкина меньше, чем в алкенах и алканах приводит к более эффективному боковому перекрыванию. π-Электроны находятся ближе к межъядерной оси, внешние области С-атомов обеднены электронами, поэтому становится возможной атака ядра нуклеофилами, т. е. осуществление реакций нуклеофильного присоединения (АN).
За счет разрыва π-связей непредельные углеводороды склонны к реакциям полимеризации, которые можно отнести к особому типу присоединения.
Алкины, в отличие от других углеводородов обладают заметной С–Н кислотностью благодаря повышенной полярности терминальной С–Н связи.
