- •Комплексные (координационные) соединения
- •Основные понятия в химии координационных соединений.
- •Номенклатура координационных соединений
- •Хелатный эффект макроциклический эффект
- •Комплексонаты.
- •Сандвичевые металлокомплексные соединения. Ферроцен.
- •Металлокластеры.
- •Структура аниона [Re2Cl8]2-
- •Пространственное строение координационных соединений.
- •Dipy - 2,2'-дипиридил:
- •Константы нестойкости некоторых комплексных ионов
- •Гидролиз как процесс комплексообразования.
- •Амфотерность как процесс комплексообразования.
- •Влияние комплексообразования на окислительно-восстановительные свойства центрального атома
- •Орбитали dх2-у2 (а) и dxz (б) в октаэдрическом поле лигандов
- •Тертраэдрическое поле Сферическое поле Октаэдрическое поле
- •Значения величин расщепления кристаллическим полем 0
- •Литература
|
|
|
Комплексные (координационные) соединения
ВВЕДЕНИЕ
Комплексные (координационные) соединения чрезвычайно широко распространены в живой и неживой природе, применяются в промышленности, сельском хозяйстве, науке, медицине. Так, хлорофилл – это комплексное соединение магния с порфиринами, гемоглобин содержит комплекс железа(II) с порфириновыми циклами. Многочисленные минералы, как правило, представляют собой координационные соединения металлов.
Подавляющее большинство соединений металлов побочных подгрупп (d- и f- металлы) относятся к числу так называемых координационных или комплексных соединений. Эти вещества являются устойчивыми в растворе, твердом состоянии и являются стехиометрически достоверными, но в тоже время они являются комбинацией из других химических соединений, которые сами по себе являются стабильными. Известны они с 19 века, например:
Берлинская лазурь:
KCN·Fe(CN)2.Fe(CN)3 или KFe[Fe(CN)6]
соли Тассера:
CoCl3·6NH3 желтая;
CoCl3·5NH3 пурпурная;
CoCl3·4NH3 зелёная;
CoCl3·3NH3 фиолетовая.
Для объяснения строения аммиакатов солей металлов и им подобных соединений потребовался почти столетний напряженный труд многих ученых. Некоторые комплексные соединения, сыгравшие большую роль в развитии координационной химии, называют по имени авторов, впервые их получивших, например :
соль Цейзе – K[Pt(C2H4)Cl3];
соль Косса – K[Pt(NH3)Cl3];
соль Пейроне – цис-[Pt(NH3)2Cl2];
соль Магнуса – [Pt(NH3)4][PtCl4] ;
Строение комплексных соединений рассматривают на основе координационной теории, предложенной в 1893 г. швейцарским химиком Альфредом Вернером. Ученый синтезировал много новых комплексных соединений, систематизировал ранее известные и вновь полученные комплексные соединения и разработал экспериментальные методы доказательства их строения.
Согласно теории Вернера – Миолати следует, что существует три типа классических вернеровских комплексов:
-
координационные ацидосоединения, во внутренней сфере которых содержатся только кислотные остатки;
-
молекулярные координационные соединения, во внутренней сфере которых содержатся только лиганды в молекулярной форме;
-
смешанные ацидо-молекулярные координационные соединения.
Основные понятия в химии координационных соединений.
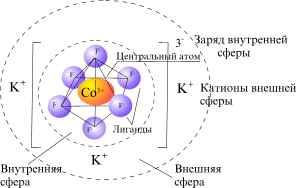
Центральное положение в координационном соединении занимает центральный атом (ион металла), который называют комплексообразователь, вокруг которого формируется координационная сфера из заряженных ионов или нейтральных молекул, которые называются лигандами. Число лигандов, окружающих комплексообразователь, называется координационным числом. Различают внутреннюю и внешнюю координационные сферы. Внутренняя включает ионы, которые непосредственно связаны с атомом металла комплексообразователя. При записи формул координационных соединений внутреннюю координационную сферу заключают в квадратные скобки:
[Co(NH3)5Cl]Cl2;
K3[CoF6];
KFe[Fe(CN)6] ;
[Cu(NH3)4]Cl2 и тд.
Номенклатура координационных соединений
Первым в именительном падеже называется анион, а затем в родительном падеже- катион. В названии комплексного иона сначала перечисляются лиганды, далее центральный ион. Число лигандов указывается греческими числительными- ди, три, тетра, пента, гекса и т.д. К латинскому названию лигандов добавляют окончание «о»: Cl-- хлоро; NO2- - нитро и тд.
Примеры:
[Cu(NH3)4]Cl2 - хлорид тетрамминмеди (II);
[Pt(NH3)3NO2Cl]SO4 - сульфат хлоронитротриамминплатины (IV);
[PtCl4(NH3)2] - диаминтетрахлороплатина.
За некоторыми координационными соединениями сохранились исторически сложившиеся названия: K3[Fe(CN)6] – красная кровяная соль; K4[Fe(CN)6] – желтая кровяная соль и др.
Лигандами могут быть нейтральные молекулы или анионы кислот:
1) нейтральные H2O, NH3, CO, этилендиамин- Н2N-CH2-CH2-NH2 и др.
2) анионы: Cl-, OH-, CN-, F-, оксалат-ион- С2O42- и др.
Заряд внутренней сферы складывается из заряда катиона металла и суммы зарядов лигандов: [Ag(CN)2]-, [Pt(Cl)6]2-, [Fe(CN)6]4-.
Лиганды могут быть монодентатными и полидентатными. Монодентатные лиганды связаны с центральным атомом металла только одной связью, а полидентатные- несколькими, например:

Простой линией обозначается внутрикомплексная химическая связь, образованная между катионом металла и отрицательно заряженным анионным лигандом (б), а стрелочкой – донорно-акцепторная связь между катионом металла и электронейтральным лигандом (а).
Важнейшим параметром комплексообразователя и всего координационного соединения является координационное число (к.ч.), которое наряду со степенью окисления в комплексных соединениях служит еще одной его характеристикой.
Координационным числом называют число атомов лигандов, непосредственно присоединенных к центральному атому. Лиганды характеризуются дентатностью (от английского «dent» – зуб). К лигандам, способным занимать только одно координационное место (монодентатным), относятся H2O, NH3, C5H5N – пиридин, другие полярные молекулы (PPh3), однозарядные анионы CN–, Hal–, OH– и т. п. Некоторые лиганды могут занимать более одного координационного места, если содержат два и более донорных (со свободной электронной парой) атома. Такие лиганды называют полидентатными: NH2–CH2–CH2–NH2 – этилендиамин, NH2–CH2–COO– – глицинат.
Координационные соединения с бидентатными лигандами, образующие металлоциклы, как указано выше, часто называют хелатными.
Так, в комплексах металлов с диметилглиоксимом реализуются хелатные металлоциклы, например, в комплексе никеля(II):
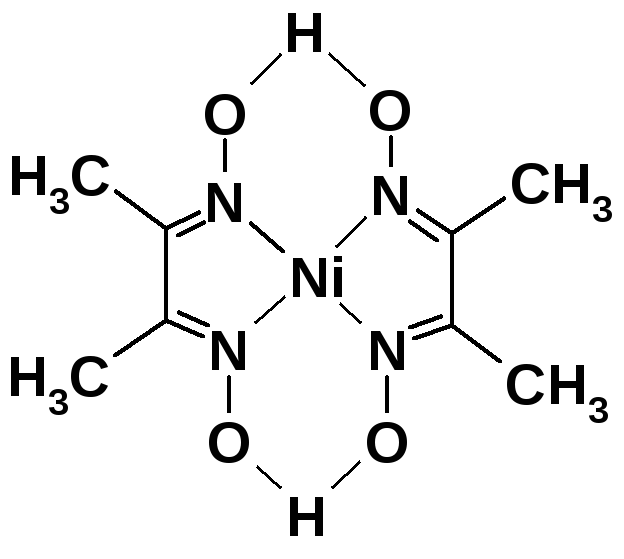
Здесь точками обозначены внутримолекулярные водородные связи. Этот плоский (квадратный) комплекс - бис(диметилглиоксимато)никель(II), представляет собой малорастворимое в воде соединение красного цвета; применяется для определения никеля(II).
Прочность таких соединений как правило выше, чем с монодентатными лигандами с аналогичными донорными группами. Этот эффект усиления прочности связывания бидентатными лигандами называют хелатным эффектом (от англ. Сhelate – клешня) .
Хелатный эффект- это частный случай общей закономерности усиления прочности связывания ионов металла при увеличении степени его обхвата лигандом.
Например для лигандов: