
- •Комплексные (координационные) соединения
- •Основные понятия в химии координационных соединений.
- •Номенклатура координационных соединений
- •Хелатный эффект макроциклический эффект
- •Комплексонаты.
- •Сандвичевые металлокомплексные соединения. Ферроцен.
- •Металлокластеры.
- •Структура аниона [Re2Cl8]2-
- •Пространственное строение координационных соединений.
- •Dipy - 2,2'-дипиридил:
- •Константы нестойкости некоторых комплексных ионов
- •Гидролиз как процесс комплексообразования.
- •Амфотерность как процесс комплексообразования.
- •Влияние комплексообразования на окислительно-восстановительные свойства центрального атома
- •Орбитали dх2-у2 (а) и dxz (б) в октаэдрическом поле лигандов
- •Тертраэдрическое поле Сферическое поле Октаэдрическое поле
- •Значения величин расщепления кристаллическим полем 0
- •Литература
Сандвичевые металлокомплексные соединения. Ферроцен.
В 1951 г. Английскими химиками Посоном и Кили был открыт ферроцен – Fe(C5H5)2: желтое кристаллическое вещество. Оно легко получается при нагревании циклопентадиена с восстановленным железом в атмосфере азота при 300оC:
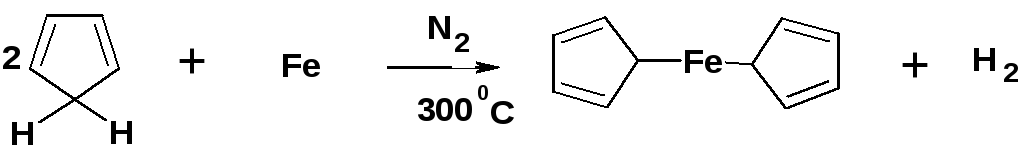
Это соединение стало родоначальником широко изученного теперь класса так называемых сэндвичевых соединений. Потребовалось около года, чтобы понять, как построено это соединение. Выяснилось, что атом железа "запечатан" между двумя высокосимметричными пятичленными кольцами:
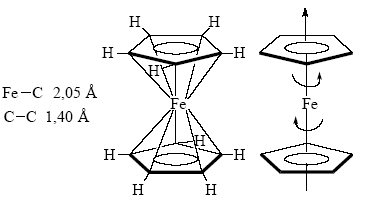
И, кроме того, оказалось, что кольца свободно вращаются в молекуле относительно друг друга вокруг оси, соединяющей центры колец и пронизывающей атом железа насквозь. Соединение было названо ферроценом, а подобный структурный тип – сандвичевым.
О стабильности ферроцена следует сказать несколько конкретных слов. В вакууме, то есть при отсутствии других, в том числе и агрессивных, реагентов, соединение выдерживает, не разрушаясь, нагревание до температуры выше 5000C. И даже в присутствии воздуха, в котором содержится агрессивный для ферроцена кислород, ферроцен оказывается стабильным при нагревании до 400оC. Для него можно провести классические для ароматических соединений реакции без разрушения сэндвичевой структуры.
Металлокластеры.
Термин "кластер" происходит от английского "cluster" – рой, гроздь, груда, скопление. В химии это понятие стало использоваться с 1964 года, когда профессор Ф.А. Коттон предложил называть химические соединения, в которых атомы металла образуют между собой химическую связь, кластерами. Примером таких соединений может быть ион [Re2Cl8]2-. При исследовании структуры этого аниона было установлено, что атомы рения непосредственно связаны друг с другом:

Структура аниона [Re2Cl8]2-
Характерные структурные типы кластеров относятся к одному из самых необычных и красивых разделов современной химической науки. Структурная химия кластеров соединяет новизну строительных принципов и совершенство геометрических форм молекул и ионов полиэдры из атомов металла, скрепленные связями металл-металл. В роли лигандов могут выступать самые разнообразные одно-, двух- и многоатомные ионы и нейтральные молекулы, например, СO.
CO (окись углерода), имеет свободные π* орбиты, является важнейшим из лигандов π – акцепторов. Любой из переходных металлов образует карбонильные производные по меньшей мере одного типа. Первые комплексные соединеия карбонилов металлов – Ni(CO)4 и Fe(CO)5 – были открыты Мондом в 1890 и 1891 гг.
Приведем примеры малых кластеров, содержащих от трех до шести атомов металла.

В карбонильном кластере Os3(CO)12 (а) атомы осмия образуют трехчленный металлоцикл в виде равностороннего треугольника. Примером карбонильного кластера с 60 валентными электронами может служить соединение состава Ir4(CO)12(б). Одним из представителей шестичленных кластеров, является анион состава [Os6(CO)18]2-(в). Кластеры переходных металлов проявляют каталитическую активность в различных химических реакциях (гидрирования, карбонилирования, изомеризации и др.). В настоящее время на основе кластеров разрабатывается новое поколение каталитических систем.
