
- •Комплексные (координационные) соединения
- •Основные понятия в химии координационных соединений.
- •Номенклатура координационных соединений
- •Хелатный эффект макроциклический эффект
- •Комплексонаты.
- •Сандвичевые металлокомплексные соединения. Ферроцен.
- •Металлокластеры.
- •Структура аниона [Re2Cl8]2-
- •Пространственное строение координационных соединений.
- •Dipy - 2,2'-дипиридил:
- •Константы нестойкости некоторых комплексных ионов
- •Гидролиз как процесс комплексообразования.
- •Амфотерность как процесс комплексообразования.
- •Влияние комплексообразования на окислительно-восстановительные свойства центрального атома
- •Орбитали dх2-у2 (а) и dxz (б) в октаэдрическом поле лигандов
- •Тертраэдрическое поле Сферическое поле Октаэдрическое поле
- •Значения величин расщепления кристаллическим полем 0
- •Литература
Хелатный эффект макроциклический эффект
наблюдается увеличение прочности связывания с катионом металла при увеличении дентатности лиганда для реакции:

 [Ni(H2O)6]2+
+ n L
[Ni(L)n(H2O)2]2+
+ 4H2O
[Ni(H2O)6]2+
+ n L
[Ni(L)n(H2O)2]2+
+ 4H2O
где L - NH3 , (en), (trien) (хелатный эффект) или соединение (2,3,2) - макроциклический эффект. Логарифмы констант устойчивости (lgn) приведены в таблице:
-
L=
NH3
en
trien
2-3-2
n=
4
2
1
1
lgn=
8,12
13,5
13,8
14,6
В случае макроциклического эффекта для более прочного связывания катиона металла необходимо, чтобы диаметр полости макроцикла соответствовал диаметру центрального атома. Это свойство многократно усилено в краун-эфирах из-за большого числа гетероатомов в цикле, к тому же неподеленные электронные пары ориентированы внутрь цикла.
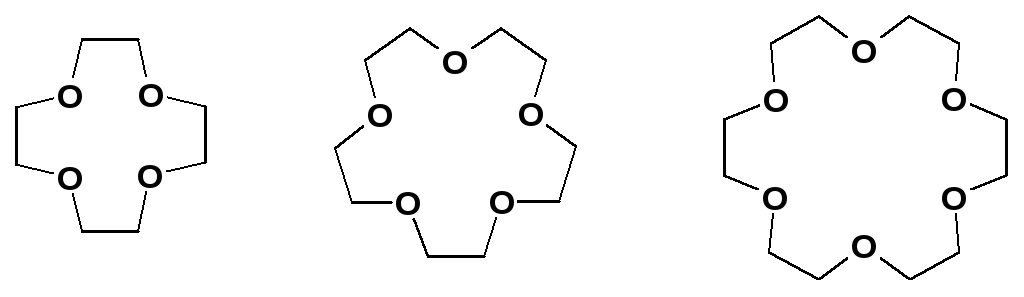
12-краун-4 15-краун-5 18-краун-6
В результате ионы щелочных и щелочноземельных металлов входят внутрь цикла, образуя прочные комплексы. Меняя величину цикла и, соответственно, размер внутренней полости, можно точно настроить краун-эфир на удерживание катиона определенного размера, например, 12-краун-4 наиболее прочно захватывает катион лития:
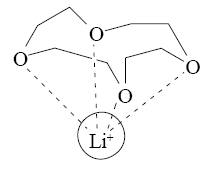
15-краун-5 соответствует по размеру катиону натрия, а 18-краун-6 «подходит по размеру» катиону калия.У краун-эфиров склонность к «захвату» катионов выражена настолько сильно, что даже если катион не соответствует по размеру внутренней полости цикла, то все равно оказываются возможными варианты, при которых катион все же удерживается. Например, если катион по размеру много больше внутренней полости, то он может окружить себя двумя молекулами краун-эфира, образуя подобие бутерброда.
Применение краун-эфиров определяется, прежде всего, их избирательной способностью захватывать катионы определенного размера. Например, широко применяемый окислитель перманганат калия KMnO4 практически нерастворим в органических растворителях, но в присутствии 18-краун-6 он легко растворяется в бензоле, приобретая при этом высокую окисляющую способность. Причина в том, что в водном растворе анионы MnO4–, осуществляющие окисление, окружены водной сольватной оболочкой, а в бензольном растворе они как бы обнажены и потому высокоактивны.
Комплексонаты.
Комплексонаты – это координационные соединения металлов с анионами комплексонов – полиосновных аминокарбоновых или аминофосфорных кислот. Анионы комплексонов обычно выступают в роли полидентатных лигандов. Примеры комплексонов.
Этилендиаминтетрауксусная кислота (ЭДТА). Как видно, молекула ЭДТА содержит 4 кислотных и 2 основных центра. Удачное сочетание и взаимное расположение этих центров сделало ЭДТА одним из наиболее эффективных действующих и универсальных комплексонов, нашедших весьма широкое и разнообразное применение.
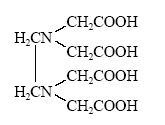
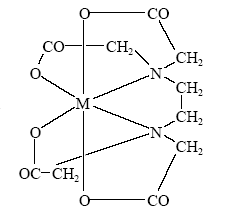
В кислом растворе ЭДТА (H4edta) протонируется, образуя катион – кислоты Н5edta+ и H6edta2+, если edta4– - анион четырехосновной кислоты. Формула комплексона показывает, что анион edta4– является потенциально декадентатным: координация может осуществляться через два атома азота и восемь атомов кислорода, считая четыре "карбоксильных" и четыре "карбонильных". Однако пространственная структура соединения такова, что дентатность не может быть выше шести – в координации могут участвовать два атома азота и четыре "карбоксильных" атома кислорода. При этом образуются пять пятичленных металлоциклов, что приводит к исключительно высокой устойчивости комплексонатов.
Среди комплексонов с фосфоновыми группами наиболее полно охарактеризована нитрилтриметиленфосфоновая кислота N(CH2PO3Н2)3 (НТФ) и оксиэтилендифосфоновая кислота (ОЭДФ), содержащая две фосфоновые группы:
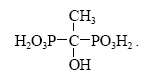
ОЭДФ и НТФ широко применяются в водоподготовке для предотвращения карбонатных, сульфатных отложений (накипи) на теплопередающих поверхностях водогрейных котлов и оборотных циклах водоснабжения систем охлаждения. Ингибиторы на основе комплексонов с фосфоновыми группами, способны в субстехиометрическом (т.е. в 100-1000 раз меньше стехиометрического) соотношении препятствовать росту кристаллов труднорастворимых солей щелочноземельных металлов.
