
- •Комплексные (координационные) соединения
- •Основные понятия в химии координационных соединений.
- •Номенклатура координационных соединений
- •Хелатный эффект макроциклический эффект
- •Комплексонаты.
- •Сандвичевые металлокомплексные соединения. Ферроцен.
- •Металлокластеры.
- •Структура аниона [Re2Cl8]2-
- •Пространственное строение координационных соединений.
- •Dipy - 2,2'-дипиридил:
- •Константы нестойкости некоторых комплексных ионов
- •Гидролиз как процесс комплексообразования.
- •Амфотерность как процесс комплексообразования.
- •Влияние комплексообразования на окислительно-восстановительные свойства центрального атома
- •Орбитали dх2-у2 (а) и dxz (б) в октаэдрическом поле лигандов
- •Тертраэдрическое поле Сферическое поле Октаэдрическое поле
- •Значения величин расщепления кристаллическим полем 0
- •Литература
Пространственное строение координационных соединений.
В зависимости от природы металла-комплексообразователя, координационного числа и типа лигандов, комплексы могут иметь различные структуры:
|
Тип гибридизации |
К.Ч. |
Геометрия комплекса |
Примеры |
|
sp |
2 |
линейная |
[Ag(CN)2] [Cu(NH3)2]+ |
|
sp2 |
3 |
треугольная |
[HgI3] |
|
sp3 |
4 |
тетраэдр |
[Be(OH)4]2 [MnCl4]2 [Zn(NH3)4]2+ |
|
dsp2 |
4 |
квадрат |
[Ni(CN)4]2 [PtCl4]2 [Pt(NH3)2Cl2]0 |
|
sp3d(z2) |
5 |
тригональная бипирамида |
[Fe(CO)5] |
|
sp3d(x2y2) |
5 |
квадратная пирамида |
[MnCl5]3 [Ni(CN)5]3 |
|
sp3d2, d2sp3 |
6 |
октаэдр |
[Al(H2O)6]3+ [SnCl6]2 [Co(NH3)6]3+ [Fe(CN)6]3 |
|
sp3d3 |
7 |
пентагональная бипирамида |
[V(CN)7]4 [ZrF7]3 |
Изомерия комплексных соединений.
Под изомерами обычно понимают соединения одного и того же состава, но различного строения и свойств. У комплексных соединений встречается геометрическая изомерия, ионизационная, гидратная, связевая, оптическая и другие виды изомерии.
Геометрическая изомерия. Этот вид изомерии обусловлен различным пространственным расположением лигандов разнолигандных комплексов во внутренней координационной сфере:
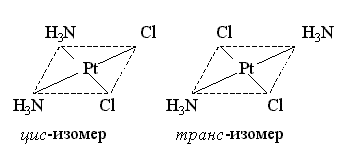
соль (или хлорид) Пейроне хлорид второго основания Рейзе
В 1969 г. было установлено, что цис–[Pt(NH3)2Cl2] обладает отчетливо выраженными противоопухолевыми свойствами, тогда как у его геометрического транс–изомера они напрочь отсутствуют.
И.Черняев в 1926 г. открыл для комплексов платины и палладия важную закономерность - трансвлияние: во внутренней сфере комплекса координированные лиганды оказывают наиболее сильное влияние при условии их транс- расположения. Трансвлияние ослабляет связь металла с лигандом, находящимся в транс- положении. Широко используется для получения различных изомеров комплексов платины, например:
[Pt(NH3)4]Cl2 + 2HCl = транс-[Pt(NH3)2Cl2] + 2NH4Cl
K2[PtCl4] + 2NH3 = цис-[Pt(NH3)2Cl2] + 2KCl
Т рансвлияние
хлорид иона более сильное, чем аммиака,
поэтому замещение в последней реакции
идет по хлору в цис-положение:
рансвлияние
хлорид иона более сильное, чем аммиака,
поэтому замещение в последней реакции
идет по хлору в цис-положение:








 Cl Сl
— Cl
NH3
Cl Сl
— Cl
NH3




 Pt + NH3
= Pt + Cl-
Pt + NH3
= Pt + Cl-

 Cl NH3
Cl
NH3
Cl NH3
Cl
NH3




Ряд трансвлияния: Cl- NO2- NCS- Br- NH3 OH- H2O.
Цис-транс-изомерия известна и для некоторых хелатных комплексов, например для хелатов меди(II) с 2-хлорбензгидразидом. Однако образовать сразу два подобные изомера могут только довольно устойчивые комплексы, для лабильных же свойствен лишь изомер термодинамически более стабильный, т.е. с наименьшей свободной энергией. Какой из двух изомеров будет преобладать в растворе, где они находятся в таутомерном равновесии, зависит от растворителя. Если он полярный, равновесие смещается в сторону образования цис-формы, а если неполярный, - транс-изомера. Благодаря этому в неполярном диоксане можно, например, превратить цис-хелат меди(II) с 2-хлорбензгидразидом в соответствующий транс-комплекс.
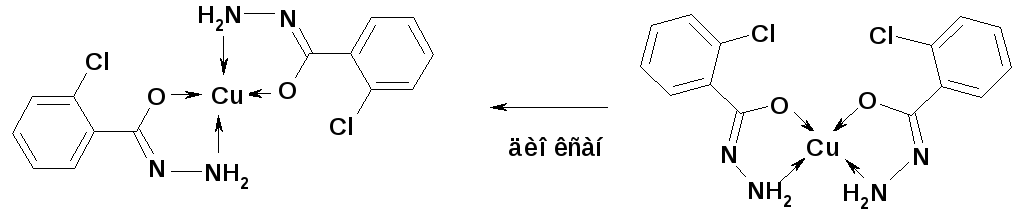
Схема трансформации одного изомера хелата меди в другой.
Помимо квадрата и тетраэдра возможны и другие варианты аллогональных изомеров - додекаэдр и квадратная антипризма, существующие в разных условиях и переходящие друг в друга. Так, если комплекс с ионом [Mo(CN)8]4– находится в твердом состоянии, этот анион представляет собой додекаэдр, а если в водном растворе - квадратную антипризму:
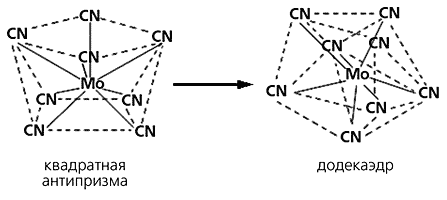 Превращение
аллогональных изомеров.
Превращение
аллогональных изомеров.
Спиновая изомерия. Спиновые изомеры - это координационные соединения, у которых в зависимости от температуры или каких-либо иных факторов изменяется лишь число неспаренных электронов, тогда как все остальное (стехиометрический состав, лиганды, их взаимное расположение в пространстве и даже геометрия координационного многогранника) одинаково. Примеры таких соединений - хелаты железа(III) c тио- или селеносемикарбазонами:
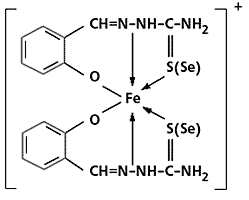
Изомер, который содержит один неспаренный электрон, существует при низкой (<270 К) температуре, а второй, с пятью такими электронами, - при высокой. Окраской эти изомеры тоже отличаются друг от друга, и это вполне понятно, если учесть, что набор разрешенных электронных переходов, ответственных за цвет в видимой области спектра, у них резко различен.
Ионизационная изомерия. Эта форма изомерии состоит в различном распределении ионов между внутренней и внешней сферой: темно- фиолетовый [Co(NH3)5Br]SO4 и красно-фиолетовый [Co(NH3)5SO4]Br.
Гидратная изомерия. Обусловлена различным распределением молекул воды во внутренней и внешней сфере: [Co(H2O)5Cl]Cl2·H2O и [Co(H2O)4Cl2]Cl·2H2O.
Связевая изомерия. Некоторые лиганды могут связываться двумя различными способами, тем самым создавая возможность существования изомеров, например: [(CO)5Mn—SCN] и [(CO)5Mn—NCS].
Оптическая изомерия. Оптическими изомерами называются комплексные соединения, одно из которых является зеркальным отражением другого. Оптическая изомерия характеризуется способностью вращать плоскость поляризации плоскополяризованного света. Два изомера отличаются друг от друга направлением вращения плоскости поляризации: один называют правым (d), другой – левым (l) изомером. Правые и левые изомеры оказываются зеркальными изображениями друг друга и не могут быть совмещены в пространстве. Хорошо изучена оптическая изомерия для трис-комплексов [ML3]3+, в которых центральным атомом служит трехвалентный металл (хром, кобальт, родий или иридий), а лигандом - 1,2-этилендиамин.
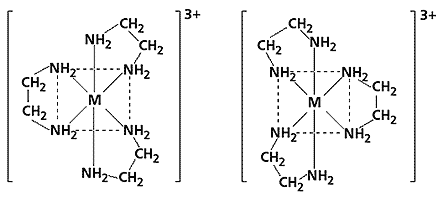
Пример оптических изомеров трис-комплекса. M: Cr(III), Co(III), Rh(III) или Ir(III).
Еще одним примером могут служить оптические изомеры комплекса [Ru(dipy)3]Cl2
