
- •Конспект лекций по курсу «Физико-химические основы технологии редких элементов»
- •Содержание
- •Термодинамический анализ процессов диссоциации и восстановления окислов урана Система уран – кислород
- •Uo2– двуокись урана
- •Тетрагональная фаза (u3o7)
- •U3o8– закись-окись урана
- •Uo3– трехокись урана
- •Фазовые соотношения в системе уран-кислород.
- •Uo2–uo2,25
- •Uo2,25 – uo2,67
- •Uo2,67–uo3
- •Диссоциация окислов урана.
- •Восстановление окислов урана окисью углерода
- •Восстановление трехокиси урана
- •Восстановление закиси – окиси урана
- •ВосстановлениеU4o9
- •Восстановление двуокиси урана (uo2).
- •Восстановление окислов урана водородом.
- •Углетермическое восстановление двуокиси урана.
- •Основы металлотермии Термодинамические основы металлотермического восстановления
- •Механизм металлотермического восстановления
- •Роль побочных реакций образования шлаков
- •Металлотермическое восстановление двуокиси урана
- •Теретические основы плавки металлов в вакууме Растворимость газов в металлах
- •Двухатомные газы
Uo2– двуокись урана
Двуокись урана – вещество темно-коричневого цвета. Она имеет гранецентрированную кубическую решетку типа флюорита. Параметр решетки а=5,4689±0,0008Å. Теоретическая плотность составляет 10,46 г/см3. Экспериментальные значения плотности лежат в пределах от 8,11 до 11,1 г/см3. Двуокись урана является полупроводником. При 27С удельная электропроводность ее меняется от 310-1до 410-8Омсм. Значение электропроводности сильно зависит от степени отклонения от стехиометрического состава, наличие примесей, кажущейся плотности и нарушения правильности кристаллической решетки. Двуокись урана относится к классу дырочных полупроводников. В литературе приводится ряд значений для температуры плавления двуокиси урана. Наиболее вероятным можно считать значение – 2860С.
Зависимость теплоемкости двуокиси урана от температуры выражается уравнением:
Ср = 19,20 + 1,62 * 10-3* Т – 3,95 * 105 * Т2
энтропия S298= 18,63 э.е. Приращение теплосодержания для реакции образования двуокиси из элементов равно
∆Н298= -259,6 ккал/моль, а изменение энтропии
∆S298= - 42,5 э.е.
Исходя из этих значений получаем
∆Z0298= - 246,9 ккал/моль.
Двуокись урана довольно легко окисляется на воздухе. При этом вначале не происходит образования новой фазы и разрушения структуры двуокиси. Получается фаза переменного состава UO2+х.
Было изучено изменение параметра решетки этой фазы в зависимости от состава (рис. 2).
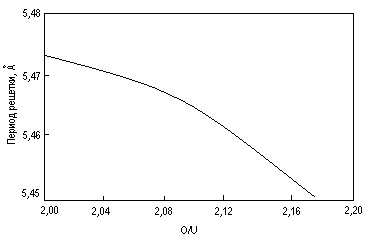
Рис. 2
С увеличением содержания кислорода в твердой фазе параметр решетки уменьшается. Большинство исследователей считает, что фаза UO2+хобразуется путем неупорядоченного внедрения кислорода в кристаллическую решетку UO2. При этом часть ионов U4+переходит в U6+или U5+. А так как радиус урана в шестивалентном состоянии меньше радиуса урана в четырехвалентном, поэтому и наблюдается уменьшение параметра решети с увеличением отношенияO : U.
U4O9
Этот окисел имеет кубическую структуру типа флюорита. Постоянная решетки равна 5,4427 ± 0,002Å. Некоторые исследователи отмечают, что кубическая структура U4O9отличается от структуры UO2, только тем, что в междуузлиях находятся избыточные атомы кислорода. Однако, как подчеркивает Гроннольд, более вероятно небольшое смещение ионов урана из их положений в гранецентрированной решетке двуокиси. Уран в U4O9находится в трех валентных состояниях 4, 5, 6. Теоретическая плотность U4O9составляет 11,30 г/см3. Экспериментальные значения лежат в пределах 11,18 – 11,30 г/см3. По мнению большинства исследователей U4O9является полупроводником с избытком металла, т.е. n - типа.
Теплоемкость U4O9:
Ср = 79,28 + 7,56 * 10-3 – 11,16 * 105 * Т-1
∆Н298= -1061,4 ккал/моль;
∆Z0298= -848,9 ккал/моль;
∆S298= -170 э.е.
Тетрагональная фаза (u3o7)
Эта фаза существует при изменении отношения О : Uот 2,29 до 2,42. При повышении температуры параметры а и с сближаются и при 500С становятся равными. При этой температуре наблюдается переход в кубическую структуру типа CaF2с параметром решетки а = 5,40Å.
Фаза UO2,6(U5O13) – имеет область гомогенности от UО2,55до UO2,65.
