
- •Конспект лекций по курсу «Физико-химические основы технологии редких элементов»
- •Содержание
- •Термодинамический анализ процессов диссоциации и восстановления окислов урана Система уран – кислород
- •Uo2– двуокись урана
- •Тетрагональная фаза (u3o7)
- •U3o8– закись-окись урана
- •Uo3– трехокись урана
- •Фазовые соотношения в системе уран-кислород.
- •Uo2–uo2,25
- •Uo2,25 – uo2,67
- •Uo2,67–uo3
- •Диссоциация окислов урана.
- •Восстановление окислов урана окисью углерода
- •Восстановление трехокиси урана
- •Восстановление закиси – окиси урана
- •ВосстановлениеU4o9
- •Восстановление двуокиси урана (uo2).
- •Восстановление окислов урана водородом.
- •Углетермическое восстановление двуокиси урана.
- •Основы металлотермии Термодинамические основы металлотермического восстановления
- •Механизм металлотермического восстановления
- •Роль побочных реакций образования шлаков
- •Металлотермическое восстановление двуокиси урана
- •Теретические основы плавки металлов в вакууме Растворимость газов в металлах
- •Двухатомные газы
Восстановление закиси – окиси урана
Рассмотрим восстановление закиси – окиси урана.
0,8 U3O8 + CO = 0,6 U4O9 + CO
Поступая аналогично предыдущему, находим, что
![]()
Результаты подсчета по этим уравнениям приведены в табл. 5.
Таблица 5
|
Т 0К |
500 |
1000 |
1500 |
|
lgK2 |
14,24 |
6,81 |
4,41 |
Из таблицы 5 видно, что и для данной реакции К – величина большая. Расчет показывает, что при всех температурах равновесия газовая фаза практически состоит из одной двуокиси углерода. Следовательно, и данная реакция является необратимой и протекает только в сторону восстановления закиси – окиси урана до U4O9.
ВосстановлениеU4o9
U4O9 + CO = 4 UO2 + CO2
Для константы равновесия этой реакции получаем следующее уравнение:
![]()
Значения lgK3приведены в табл. 6.
Таблица 6
|
Т 0К |
1000 |
1500 |
|
lgK3 |
4,65 |
2,87 |
Из этих данных следует, что и данная реакция принадлежит к числу практически необратимых реакций.
Восстановление двуокиси урана (uo2).
0,5 UO2 + CO = 0,5 U + CO2
Получаем:
![]()
Значения lgK4даются в табл. 7.
Таблица 7
|
Т 0К |
1000 |
2000 |
|
lgK3 |
-13,90 |
-6,76 |
Из этой таблицы видно, что при всех температурах К4– величина малая. Если произвести расчет состава равновесной газовой фазы, то получим, что при всех температурах газовая фаза практически состоит из одной окиси углерода.
Поэтому окисью углерода нельзя восстановить двуокись урана до металлического урана.
Суммируя сказанное выше, можно сделать следующие выводы:
Высшие окислы урана термодинамически легко восстанавливаются до двуокиси урана.
Двуокись урана не может быть окислена с помощью двуокиси углерода.
Окисью углерода нельзя восстановить двуокись урана до металлического урана.
Восстановление окислов урана водородом.
Совокупность реакций, протекающих при действии водорода на окислы урана, может быть записана следующим образом:
3 UO3 + H2 = U3O8 + H2O
0,8 U3O8 + H2 = 0,6 U4O9 + H2O
U4O9 + H2 = 4 UO2 + H2O
0,5 UO2 + H2 = 0,5 U + H2O
Константа равновесия для любой из этих реакций
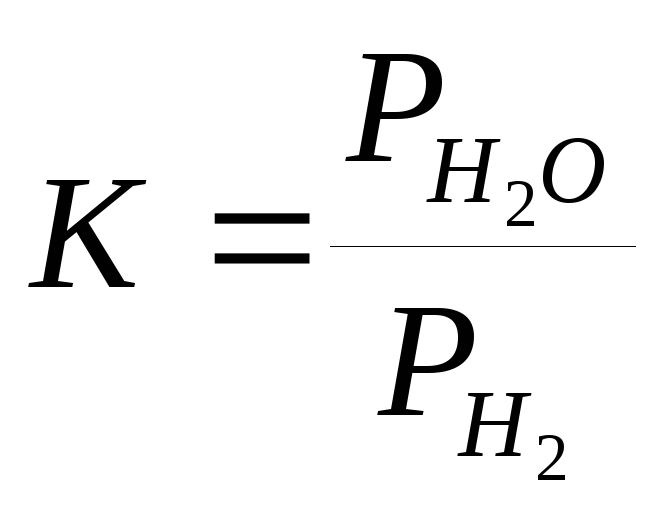
Термодинамический анализ этих реакций осуществляем также, как и в случае восстановления окисью углерода. При этом для реакции:
H2 + 0,5 O2 = H2O
Имеем
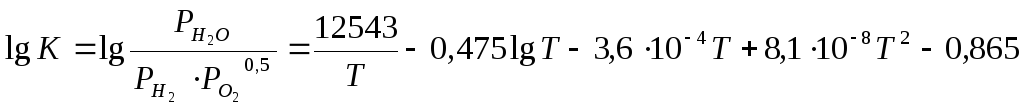
Для реакции восстановления окислов урана водородом получаем:
![]()
![]()
![]()
![]()
Значения констант равновесия, полученные по этим уравнениям, приведены в табл. 8.
Таблица 8
|
lgK |
T 0K | ||
|
500 |
1000 |
1500 | |
|
lgK1 |
17,43 |
9,83 |
7,29 |
|
lgK2 |
11,97 |
6,67 |
4,83 |
|
lgK3 |
7,85 |
4,42 |
3,80 |
|
lgK4 |
- |
-14,12 |
-9,20 |
На основании этих данных можно сделать выводы, аналогичные тем, которые были сделаны при анализе процессов восстановления с помощью окиси углерода, а именно:
Реакции 1, 2, 3 необратимы и протекают только слева направо. Реакция 4 слева направо не протекает.
Аналогичные выводы были сделаны при термодинамическом анализе процессов восстановления окислов урана аммиаком и метаном. Поэтому обобщая, можно сделать следующие выводы:
Косвенное восстановление высших окислов урана термодинамически осуществляется легко; все реакции восстановления этих окислов относятся к числу необратимых и могут протекать только слева – направо. Двуокись урана нельзя окислять двуокисью углерода и водяным паром.
Косвенным путем двуокись урана не восстанавливается до металлического урана. Окисление металлического урана двуокисью углерода и водяным паром протекает только до двуокиси урана.
