
- •Конспект лекций по курсу «Физико-химические основы технологии редких элементов»
- •Содержание
- •Термодинамический анализ процессов диссоциации и восстановления окислов урана Система уран – кислород
- •Uo2– двуокись урана
- •Тетрагональная фаза (u3o7)
- •U3o8– закись-окись урана
- •Uo3– трехокись урана
- •Фазовые соотношения в системе уран-кислород.
- •Uo2–uo2,25
- •Uo2,25 – uo2,67
- •Uo2,67–uo3
- •Диссоциация окислов урана.
- •Восстановление окислов урана окисью углерода
- •Восстановление трехокиси урана
- •Восстановление закиси – окиси урана
- •ВосстановлениеU4o9
- •Восстановление двуокиси урана (uo2).
- •Восстановление окислов урана водородом.
- •Углетермическое восстановление двуокиси урана.
- •Основы металлотермии Термодинамические основы металлотермического восстановления
- •Механизм металлотермического восстановления
- •Роль побочных реакций образования шлаков
- •Металлотермическое восстановление двуокиси урана
- •Теретические основы плавки металлов в вакууме Растворимость газов в металлах
- •Двухатомные газы
Углетермическое восстановление двуокиси урана.
В общем виде реакцию прямого восстановления можно записать так:
МеО(тв) + С(тв) = Ме(тв) + СО(газ)
При термодинамическом анализе считаем, что эта реакция осуществляется через следующие два процесса:
а) МеО(тв)+ СО(газ)= Ме(тв)+ СО2 (газ)
б) С(тв) + СО2 (газ) = 2СО(газ)
а) + б) МеО(тв)+ С(тв) = Ме(тв)+ СО
Для того, чтобы суммарная реакция протекала слева направо, т.е. в сторону восстановления, необходимо чтобы обе промежуточные реакции протекали в этом направлении. Посмотрим при каких же условиях эти реакции будут протекать слева направо. Реакция (а) протекает в строну восстановления только тогда, когда фактическое содержание окиси углерода в газовой фазе больше равновесного по этой реакции. Реакция (б) протекает слева направо тогда, когда фактическое содержание окиси углерода меньше равновесного по данной реакции.
А отсюда следует, что углетермическое восстановление окисла возможно тогда, когда содержание окиси углерода в газовой фазе больше равновесного по реакции косвенного восстановления и меньше равновесного по реакции газификации углерода двуокисью углерода.
Для анализа промежуточных реакций воспользуемся правилом фаз. Реакция (а) протекает без изменения числа газовых молекул. Поэтому
f = K - P + 1, K = 3, P = 3, f = 1.
Система обладает одной степенью свободы – моновариантна. В качестве независимого параметра считаем температуру. Тогда состав равновесной газовой фазы есть функция температуры.
Реакция (б) протекает с изменением числа газовых молекул. Поэтому давление оказывает влияние на равновесные системы и
f = K – P +2, K = 2, P = 2, f = 2.
Данная система биварианта. Следовательно, имеются два независимых параметра: температура и давление. Состав же равновесной газовой фазы является функцией температуры и давления. Посмотрим как меняется состав газовой фазы при постоянной температуре с изменением давления. На основании принципа Ле-Шателье – Вант-Гоффа при увеличении давления равновесие сдвигается справа налево, т.е. в сторону уменьшения общего числа газовых молекул. А отсюда следует, что с повышением давления содержание окиси углерода в газовой фазе уменьшается, а двуокиси углерода увеличивается.
Известно, что реакция газификации углерода (реакция б) протекает с поглощением тепла – реакция эндотермическая. Поэтому при постоянном давлении с повышением температуры содержание окиси углерода возрастает. Сказанное можно проиллюстрировать следующим графиком (рис. 7). Причем Р1< Р2< Р3. Из этого графика следует, что прямое (углетермическое) восстановление становится возможным, начиная с некоторой температуры Т1. Причем чем меньше общее давление в системе, тем ниже эта температура.
Перейдем теперь к рассмотрению углетермического восстановления двуокиси урана
0,5 UO2(тв)+C(тв)= 0,5U(тв)+ СО(газ)
Представим эту реакцию, как сумму двух следующих реакций:
а) 0,5UO2(тв)+ СО(газ)= 0,5U(тв)+ СО2
б) C(тв)+ СО2(газ)= 2 СО(газ)
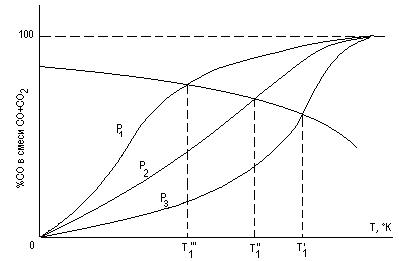
Рис. 7
Тогда:
![]()
К – константа равновесия для реакции углетермического восстановления;
Ка– константа равновесия для реакции косвенного восстановления;
Кб– константа равновесия для реакции газификации углерода двуокисью углерода.
Так как обычно общее давление невелико, то активности твердых фаз равны единице, а активность компонента газовой фазы – парциальному давлению. Поэтому К = РСО.
Зависимость lgKаот температуры была дана выше. Реакция
С + СО2 = 2СО
хорошо изучена экспериментально и для нее дается следующее уравнение
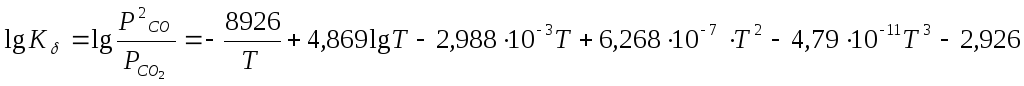
Подсчитанное таким образом значение lgK = lg PCOприводится в табл. 9.
Таблица 9
|
T 0K |
2000 |
2500 |
3000 |
3500 |
|
lgP0 (ат) |
-2,4 |
-1,1 |
0,4 |
2,3 |
|
PCO |
3 мм.рт.ст. |
60 мм.рт.ст. |
2,52 ат. |
- |
Но при изучении углетермического восстановления двуокиси необходимо иметь в виду, что уран образует с углеродом карбиды.
В системе U–Cсуществуют три химических соединения:UC– монокарбид,U2C3– полуторный карбид,UC2– дикарбид.
Карбид уранавпервые был получен Муаосаном и ему была приписана формулаU2C3. Однако в более поздних работах было показано, что эта фаза представляет собой скорееUC2. Наконец, рентгеновскими исследованиями определенно доказано существованиеUC2, а также монокарбидаUC.
Монокарбид урана UC.Пирофорное вещество серого цвета, имеющее кубическую решетку типаNaClс четырьмя молекулами в элементарной ячейке. Параметр решетки а = 4,9605±0,0002Å. Температура плавленияUC, по данным различных авторов, колеблется в пределах 2280 - 2590С.
Как известно, твердые соединения ряда металлов с углеродом входят в своеобразную группу веществ, именуемую фазами внедрения. Монокарбид урана – типичная фаза внедрения. Структура дефектна по углероду.
Проводимость в монокарбида носит металлический характер и осуществляется свободными электронами. Она сильно зависит от дефектности решетки.
U2C3– полуторный карбид урана.В настоящее время считается, чтоU2C3существует в виде устойчивого соединения при температурах ниже 1800С.
U2C3имеет объемноцентрированную кубическую решетку с параметром а=8,088±0,001Å.
В элементарной ячейке содержится восемь молекул. Рентгеновская плотность d=12,88 г/см3.U2C3устойчив до температуры разложения (1730С), не претерпевает никаких полиморфных превращений. Существует в виде стехиометрического соединенияU2C3.
UC2 – дикарбид урана.Существует в виде двух кристаллических модификаций: низкотемпературной и высокотемпературой. Низкотемпературная модификация имеет тетрагональную структуру с постоянными: а=3,517±0,001Å и с=5,987±0,001Å. При прокаливанииUC2до 1820±20С происходит аллотропическое превращение с переходом тетрагональной модификации в кубическую. Тип кубической тетрагональной модификацииUC2точно не установлен.
Рентгеновская плотность дикарбида урана d=11,67 г/см3.
Учитывая наличие карбидов урана, можно ожидать, что восстановление двуокиси урана углеродом будет протекать более вероятно с образованием карбида, а не металлического урана. Рассмотрим возможные при этом реакции. Углетермическое восстановление двуокиси урана с образованием монокарбида урана протекает по реакции:
UO2 + 3C = UC + 2CO
константа равновесия К = Р2СО.
Зависимость равновесного давления окиси от температуры выражается уравнением
![]()
Для интервала температур 1750 – 2080 К Стерлин приводит более простое уравнение
![]()
При 2070 РСО(равн.)= 1 атм.
Рядом исследователей отмечается полное завершение этой реакции при температурах 2070 – 2270 0К.
В некоторых работах указывается, что вначале восстановление UO2углеродом происходит с образованием дикарбида урана по реакции:
UO2 + 4C = UC2 + 2CO
К = Р2СО.
Стандартное изменение изобарного потенциала
∆Z0 = 164500 – 1433*T
при 2214 0К –∆Z0= 0. В дальнейшем восстановление происходит за счет взаимодействия
UO2 + 3UC2 = 4UC + 2CO
для которого:
∆Z0 = 152200 – 6542*T,
при 2325 0К – ∆Z0= 0.
