
- •Ш. А. Пиралишвили, н. А. Мочалова, с. В. Веретенников термодинамика. Технические приложения
- •Рыбинск 2007
- •1.1. Способы задания газовой смеси
- •1.4. Энтропия газовой смеси
- •1.5. Задание для самостоятельного решения
- •1.6. Пример выполнения индивидуального задания
- •2. Процессы смешения
- •2.1. Процессы смешения в постоянном объеме
- •2.2. Задание для самостоятельной проработки
- •2.3. Пример выполнения расчета
- •2.4. Смешение в потоке
- •2.5. Индивидуальные задания по расчету
- •2.6. Пример выполнения индивидуального задания
- •2.7. Смешение при заполнении объема
- •2.8. Индивидуальное задание на расчет процесса смешения при заполнении объема
- •2.9. Пример выполнения индивидуального задания по расчету процесса смешения при заполнении объема
1.1. Способы задания газовой смеси
Под смесью идеальных газов понимается механическая смесь химически обособленных исходных газов, подчиняющихся уравнению состояния идеального газа. Тогда будем считать, что и смесь представляет из себя некоторый самостоятельный идеальный газ, термодинамические свойства которого определяются количественным соотношением входящих в него исходных компонентов, т. е. свойства газовой смеси однозначно определяются ее составом.
Состав газовой смеси определяется количественным соотношением входящих в него компонентов и может быть задан массовыми, объемными или мольными долями.
Пусть Мсм – масса газовой смеси, а тi – масса i-го компонента, входящего в смесь. Согласно закону сохранения массы будем иметь очевидное равенство:
![]() ,
1.1)
,
1.1)
где n – число компонентов смеси.
Под массовой долей i-го компонента будем понимать отношение:
![]() или в процентах
или в процентах
![]() %.
(1.2)
%.
(1.2)
На основании закона сохранения вещества, запишем уравнение баланса массы:
![]() .
(1.3)
.
(1.3)
Если массовые доли заданы в процентах, то
![]() %.
(1.4)
%.
(1.4)
Объемные доли представляют собой отношение парциальных объемов компонентов к объему газовой смеси:
![]() ,
(1.5)
,
(1.5)
где Vi – парциальный объем i-го компонента; Vсм – объем газовой смеси.
Под парциальным
объемом будем понимать тот объем, которым
бы обладал i-й компонент, находясь при
температуре
![]() и давлении
и давлении![]() газовой смеси.
газовой смеси.
Нетрудно показать, что парциальные объемы газов прямо пропорциональны их парциальным давлениям. Парциальным называется давление, которое создавал бы i-й газ смеси, если бы он один занимал весь объем смеси, находясь в нем при температуре смеси. Запишем уравнение Бойля-Мариотта для компонента смеси:
![]() ,
т. е.
(1.6)
,
т. е.
(1.6)
![]() ,
,
![]()
или
![]() ,
,
![]() ,
,
где Pi – парциальное давление i-го компонента; Vi – парциальный объем
i-го компонента.
Сложим почленно левые и правые части закона Бойля-Мариотта для компонентов:
![]() или
или
 .
.
Согласно закону Дальтона
![]() ,
(1.7)
,
(1.7)
тогда
![]() .
(1.8)
.
(1.8)
Объем газовой смеси равен сумме парциальных объемов компонентов, входящих в смесь. Это утверждение равносильно равенству
![]() или
или
![]() %.
(1.9)
%.
(1.9)
Состав газовой смеси может быть задан и числом молей, входящих в нее компонентов
![]() (1.10)
(1.10)
где
![]() – число молей смеси;
– число молей смеси;![]() – число
молей i-го
компонента.
– число
молей i-го
компонента.
Тогда под мольной долей будем понимать отношение
![]() (1.11)
(1.11)
и, согласно закону сохранения количества вещества, будем иметь равенство
![]() или
или
![]() %.
(1.12)
%.
(1.12)
Воспользуемся следствием из закона Авогадро: одинаковые количества различных идеальных газов, находящихся при одинаковых давлениях и температуре, занимают одинаковые объемы.
Запишем
 ,
но
,
но
![]() ,
,
тогда
![]() ,
(1.13)
,
(1.13)
т. е. объемные и мольные доли компонентов смеси равны между собой.
1.2. Термическое уравнение состояния газовой смеси
Запишем уравнение состояния для i-го компонента газовой смеси, если он занимает весь ее объем и находится там при температуре смеси. Тогда его давление равно парциальному:
![]() .
(1.14)
.
(1.14)
Просуммируем полученные зависимости для всех компонентов, входящих в смесь
![]() .
.
Вспоминая, что
![]() и, вводя обозначение
и, вводя обозначение
![]() ,
,
получим уравнение состояния газовой смеси:
![]() ,
(1.15)
,
(1.15)
где Rсм – газовая постоянная смеси. Ее величина может быть рассчитана из соотношения
![]() .
.
Поделив его на массу смеси М, получим соотношение:
![]() ,
но
,
но
![]() ,
,
тогда
![]() .
(1.16)
.
(1.16)
Введение понятия о кажущейся молекулярной массе смеси упрощает расчеты газовых смесей:
![]() .
(1.17)
.
(1.17)
Или после подстановки
выражения (1.17) для
![]() получим с учетом равенства
получим с учетом равенства![]() Дж/(моль∙К)
Дж/(моль∙К)
 .
(1.18)
.
(1.18)
Запишем уравнение состояния для массы газа mi:
![]() или, с учетом
или, с учетом
![]() ;
;
![]() .
.
Последнее выражение преобразуем к виду
![]() .
.
Если записать выражения для каждого компонента смеси, а затем просуммировать, получим
![]() ;
;
![]() ,
,
тогда
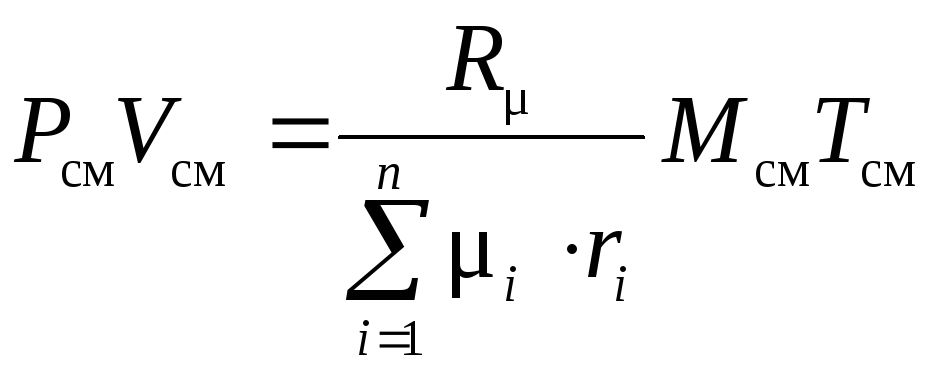 .
.
Таким образом
 ,
а
,
а
![]() .
(1.19)
.
(1.19)
Получим расчетные
зависимости для
![]() и
и![]() ,
если смесь задана массовыми долями
,
если смесь задана массовыми долями![]() .
Запишем уравнение состояния дляМ кг
газовой смеси и для
.
Запишем уравнение состояния дляМ кг
газовой смеси и для
![]() кг
компонентов газов, входящих в смесь,
через их парциальные объемы:
кг
компонентов газов, входящих в смесь,
через их парциальные объемы:
![]() ;
;
![]() .
.
Если записать второе выражение для каждого компонента, а затем их просуммировать, то получим
![]() .
.
Перепишем его в виде
![]() .
.
Поделив последнюю зависимость на уравнение состояния смеси для М кг, получим зависимость для расчета Rсм и см через массовый состав:
![]() ;
;
![]() .
(1.20)
.
(1.20)
Последние выражения позволяют по объемным долям и молекулярным массам компонентов рассчитать газовую постоянную смеси и среднюю молекулярную массу.
Зная соотношения между массовыми и объемными долями газов, можно рассчитать парциальные давления
![]() ;
;
![]() или
или
![]() .
(1.21)
.
(1.21)
Запишем закон Бойля-Мариотта для i-го компонента и всей смеси
![]() ,
,
откуда
![]() ,
,
тогда
![]() или
или
![]() .
(1.22)
.
(1.22)
Приравнивая зависимости (1.21) и (1.22), получим формулы перевода массовых долей в объемные и наоборот:
![]() ;
;
![]() .
(1.23)
.
(1.23)
Плотность газовой смеси:
![]()
![]() ,
,
таким образом,
![]() .
(1.24)
.
(1.24)
Выразим
![]() через массовый состав смеси:
через массовый состав смеси:
 ,
,
следовательно,
 .
.
1.3. Теплоемкость смеси газов
Пусть известны ci – зависимость массовых теплоемкостей компонентов от температуры
![]() .
.
Для одного килограмма газовой смеси массовая теплоемкость может быть рассчитана по формуле
![]() .
(1.25)
.
(1.25)
Или с учетом зависимости теплоемкостей от температуры
![]() .
.
Если задан объемный состав, то удобней пользоваться объемными теплоемкостями:
для 1 м3
компоненты:![]() ,
,
для 1 м3
смеси:
![]() .
(1.26)
.
(1.26)
Или с учетом зависимости от температуры:
![]() .
(1.27)
.
(1.27)
