
- •Ш. А. Пиралишвили, н. А. Мочалова, с. В. Веретенников термодинамика. Технические приложения
- •Рыбинск 2007
- •1.1. Способы задания газовой смеси
- •1.4. Энтропия газовой смеси
- •1.5. Задание для самостоятельного решения
- •1.6. Пример выполнения индивидуального задания
- •2. Процессы смешения
- •2.1. Процессы смешения в постоянном объеме
- •2.2. Задание для самостоятельной проработки
- •2.3. Пример выполнения расчета
- •2.4. Смешение в потоке
- •2.5. Индивидуальные задания по расчету
- •2.6. Пример выполнения индивидуального задания
- •2.7. Смешение при заполнении объема
- •2.8. Индивидуальное задание на расчет процесса смешения при заполнении объема
- •2.9. Пример выполнения индивидуального задания по расчету процесса смешения при заполнении объема
2.2. Задание для самостоятельной проработки
Сосуд,
теплоизолированный от окружающей среды,
разделен адиабатными перегородками на
четыре объема, в каждом из которых
содержится определенный газ. После того
как перегородки убраны, происходит
смешение в постоянном объеме, равным
сумме объемов четырех частей с разными
газами. Состояние газов до смешения
характеризуются параметрами: массой
![]() ,
кг, объемом
,
кг, объемом![]() ,
м3;
температурой
,
м3;
температурой
![]() ,°С,
где (
,°С,
где (![]() ).
Данные для расчета необходимо брать в
табл. 2 Приложения 1 в соответствии с
заданным номером варианта.
).
Данные для расчета необходимо брать в
табл. 2 Приложения 1 в соответствии с
заданным номером варианта.
В процессе работы над индивидуальным домашнем заданием необходимо определить:
– температуру
смеси после завершения процесса смешения
–
![]() ,°С;
,°С;
– давление
газовой смеси –
![]() , МПа;
, МПа;
– газовую постоянную газовой смеси, кДж/(кг·К);
– кажущуюся
молярную массу смеси –
![]() ,
кг/моль;
,
кг/моль;
– состав газовой смеси в массовых долях;
– парциальные
давления компонентов смеси –
![]() ,
МПа;
,
МПа;
– истинную
мольную теплоемкость смеси при
![]() для температуры установившейся после
смешения
для температуры установившейся после
смешения![]() ,
кДж/(кг·К);
,
кДж/(кг·К);
– найти приращение энтропии системы в процессе необратимого смешения, кДж/К;
– рассчитать
эксергию компонентов, газовой смеси и
потери эксергии в процессе смешения:
![]() ,
,![]() ,
,![]() ,
кДж/К;
,
кДж/К;
– построить эксергетическую диаграмму процесса смешения в постоянном объеме.
При выполнении расчета процесса смешения счить компоненты смеси идеальными газами. При определении истинной и средней теплоемкостей, данные брать по табл. 1-5 Приложения 2. При вычислении воспользоваться линейной интерполяцией.
Температуру смеси после окончания процесса смешения найти графически или методом последовательных приближений. При этом начальное приближение для температуры смеси можно вычислить, пологая теплоемкости компонентов смеси равными, по следующей зависимости:
 .
.
Точность вычисления температуры смеси должна быть не менее 1 К. В расчетах использовать систему СИ единиц.
2.3. Пример выполнения расчета
Сосуд разделен перегородкой на две части, объемы которых
V1 = 1,5 м3 и V2 = 1 м3. В первой части содержится азот массой m1 = 10 кг при температуре t1 = 120 °C; в другой части – гелий массой m2 = 5 кг при
t2 = 860 °C. Найти давление, температуру и энтропию смеси после того, как перегородка будет убрана и процесс смешения закончится.
Решение.
Воспользуемся законом сохранения энергии (2.1) и запишем:
![]()
или через удельные энтальпии с учетом выклада каждого из компонентов
![]() ,
,
где массовые доли азота и гелия найдем из выражения
![]() =
=
![]() ;gHe
=
;gHe
=
![]() .
.
Удельную внутреннюю энергию азота находим по табл. 1 Приложения 2, а удельную внутреннюю энергию гелия uHe воспользовавшись положениями молекулярно-кинетической теории. Гелий – одноатомный газ, у которого, имеются три степени свободы. Тогда выражение для удельной внутренней энергии может быть записано в виде
![]() ;
;
![]()
или после подстановки численных значений величин, входящих в зависимость
 кДж;
кДж;
 кДж/кг.
кДж/кг.
Удельная
внутренняя энергия азота из таблиц
![]() кДж/кг
кДж/кг
или если рассчитать по изложенной методике
![]() кДж;
кДж;
![]() кДж/кг.
кДж/кг.
Рассчитаем удельную внутреннюю энергию заданной смеси азота и аргона:
![]() кДж/кг.
кДж/кг.
Для определения средней температуры, используя отмеченную методику, рассчитаем внутреннюю энергию смеси при температурах, находящихся в области предполагаемого численного значения искомой величины. Результаты внесем в табл. 2.1.
По полученным данным, пользуясь интерполяцией или графиком t = f (u), построенным с использованием результатов расчета находим температуру газовой смеси.
По
графику
![]() (рис. 2.3) находим, что температура смеси
составляет ~611°С.
(рис. 2.3) находим, что температура смеси
составляет ~611°С.
|
t, °C |
T, К
|
|
uHe=
|
gN2 uN2, кДж/кг
|
gHe uHe, кДж/кг
|
u = =
кДж/кг |
|
400 500 600 700 800 |
|
500 571 648 722 796 |
2098 2412 2724 3036 3348 |
333 383 432 481 531 |
699 804 908 1012 1016 |
1032 1187 1340 1493 1647 |
Воспользуемся уравнением состояния Клапейрона-Менделеева и найдем парциальные давления компонентов смеси
Рис.
2.3. Зависимость температуры смеси от
ее удельной внутренней энергии

![]()
где
V
– объем газовой смеси
![]() .
.
Парциальное давление азота:
![]()
![]() МПа.
МПа.
Парциальное давление гелия:
![]() МПа.
МПа.
Давление газовой смеси в соответствии с законом Дальтона найдем как сумму парциальных давлений
![]() или
или
![]() МПа.
МПа.
Массовые доли компонентов
![]() ;
;
![]() ;
;
![]()
Газовая постоянная смеси
![]()
Кажущая молярная масса газовой смеси
![]() кг/моль.
кг/моль.
Объемные доли компонентов
![]() ;
;
![]() .
.
Рассчитаем давление смеси
![]() .
.
Парциальные давления компонентов
![]() ;
;
![]()
Давление
смеси
![]()
Рассчитывая
энтропию смеси сделаем предположение
о том, что при
![]() МПа
и
МПа
и![]() °С,
т. е. при нормальных физических
условиях, энтропия газов (
°С,
т. е. при нормальных физических
условиях, энтропия газов (![]() и
и![]() )
равна нулю. Такое допущение правомочно,
т. к. нас интересует не абсолютная
величина энтропии, а ее отклонение от
некоторого уровня, выбранного в
осуществляемом расчете за нулевой.
Энтропия газов до смешения равна сумме
энтропии 10 кг азота и 5 кг гелия.
Для их определения по известным начальным
состояниям азота и гелия выпишем из
таблиц Приложения 2 необходимые при
расчете значения теплоемкостей.
)
равна нулю. Такое допущение правомочно,
т. к. нас интересует не абсолютная
величина энтропии, а ее отклонение от
некоторого уровня, выбранного в
осуществляемом расчете за нулевой.
Энтропия газов до смешения равна сумме
энтропии 10 кг азота и 5 кг гелия.
Для их определения по известным начальным
состояниям азота и гелия выпишем из
таблиц Приложения 2 необходимые при
расчете значения теплоемкостей.
Найдем давления компонентов до смешения, воспользовавшись уравнением Клапейрона-Менделеева
 ;
;
![]() .
.
Теплоемкости компонентов из табл. Приложения 2:
![]()
![]()
Удельная энтропия азота в начальном состоянии
![]()
![]()
Удельная энтропия гелия до смешения
![]()
Энтропия системы азот гелий до смешения равна сумме энтропий подсистем в соответствии с аддитивностью энтропии
![]() ;
;
![]() ;
;
![]()
Рассчитаем энтропию газовой смеси
 .
.
Подставим численные значения
![]() В
расчете не учитывалась зависимость
теплоемкости от температуры.
В
расчете не учитывалась зависимость
теплоемкости от температуры.
Рассчитаем приращение энтропии за счет необратимости процесса смешения
![]()
![]()
Потери эксергии в процессе смешения найдем, воспользовавшись уравнением Гюи-Стодолы:
![]()
Эксергия термодинамической системы из 10 кг азота и 5 кг гелия до смешения
![]() .
.
Энтропию компонентов при параметрах окружающей среды, как было ранее отмечено, будем считать равной нулю. Тогда для начального состояния гелия и азота рассчитаем численные значения внутренней энергии и удельных объемов. Предполагая газы идеальными, воспользуемся зависимостью внутренней энергии от температуры и удельной изохорной теплоемкости
![]()
где
массовая теплоемкость может быть
выражена через мольную теплоемкость и
молярную массу газа
![]() .
.
Мольная теплоемкость газа с использованием молекулярно кинетических основ в рамках классической термодинамики равна:
![]()
где iс – число степеней свободы молекулы газа.
Для
гелия как одноатомного газа
![]()
Для
двухатомного азота
![]()
Тогда удельная внутренняя энергия гелия равна:
![]()
Для азота
![]()
Удельные объемы компонентов до смешения найдем, воспользовавшись исходными данными
![]() м3/кг;
м3/кг;
 м3/кг.
м3/кг.
Удельные объемы компонентов при нормальных условиях найдем, воспользовавшись уравнением Клапейрона-Менделеева
![]() м3/кг;
м3/кг;![]()
![]() м3/кг.
м3/кг.
Рассчитаем суммарную эксергию азота и гелия до процесса смешения

Подставим численные значения
![]()
Удельные
внутренние энергии гелия
![]() и
и
азота
![]() взяты из таблиц Приложения 2.
взяты из таблиц Приложения 2.
Определим эксергию образовавшейся газовой смеси

Из таблиц Приложения 2 найдем удельную внутреннюю энергию гелия и азота в состоянии соответствующим газовой смеси.
![]() ;
;
![]() .
.
После подстановки рассчитаем численное значение эксергии газовой смеси:
![]()
Рис.
2.4. Эксергическая диаграмма смешения
газов в
постоянном объеме
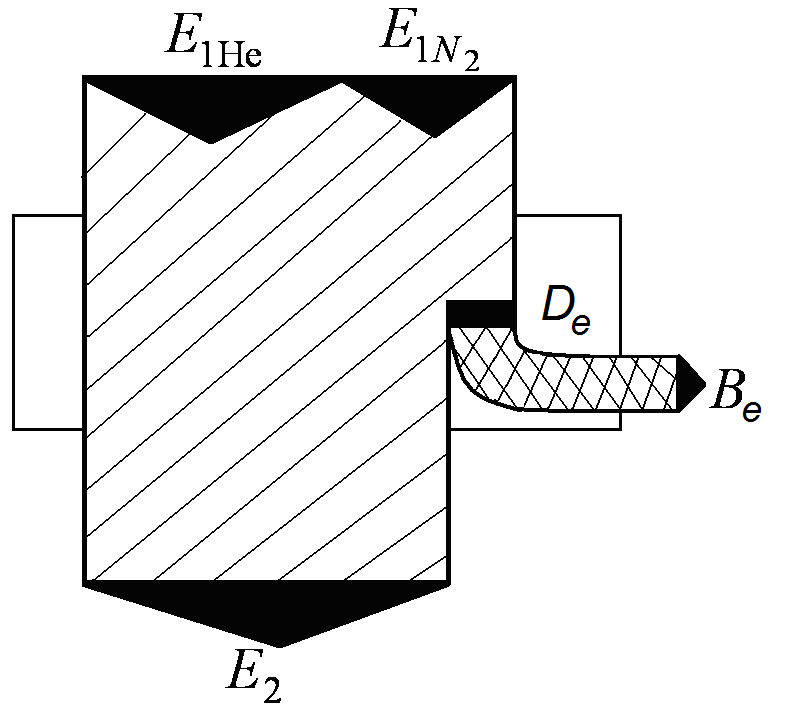
![]()
![]() Дж.
Дж.
Сопоставим результаты
![]() ≈
≈![]()
Полученная точность расчетов вполне удовлетворительна. По рассчитанным значениям построим эксергетическую диаграмму процесса смешения в объеме.
