
Решение задач по органической химии
.pdf
Задача 2. Изобразите распределение электронной плотно-
сти в молекулах следующих соединений: а) 1-пропанол; б) этилборан; в) 2-метилпропеналь; г) 1-бутен; д) 3,3,3- трихлорпропен; е) изопропиллитий; ж) 2-метокси-1-бутен; з) 1-нитро-1-бутен.
В молекулах, не содержащих полярных связей, электронная плотность равномерно распределена между атомами. Если же в молекуле хотя бы одна связь является полярной, диполь этой связи вызывает электронные смещения в других связях. Смещения электронной плотности могут вызываться действием либо индуктивного эффекта заместителя, либо – в случае наличия сопряжения орбиталей – мезомерного эффекта.
Индуктивный эффект – это смещение электронной плотности связи, вызываемое соседней полярной связью. Его обозначают буквой I. Индуктивный эффект связи С-Н произвольно принят равным нулю. Если заместитель, вызывающий смещение электронов связи, притягивает к себе электроны сильнее, чем атом водорода, ему приписывают отрицательный индуктивный эффект (–I). В противном случае, когда заместитель отталкивает от себя электронную плотность сильнее, чем атом водорода, индуктивный эффект положительный (+I).
Мезомерный эффект – это способность заместителя вступать в орбитальное взаимодействие с соседней кратной связью. Заместители, которые предоставляют для взаимодействия р-электроны в виде неподеленной пары (р,π- сопряжение), т.е. способствуют смещению электронной плотности в направлении соседней кратной связи, проявляют +М- эффект. Заместители, имеющие полярную кратную связь, вступают в π,π-взаимодействие (π,π-сопряжение) с кратной связью, отделенной от нее одной простой связью, и смещают электронную плотность на себя. Они обладают –М-эффектом.
Поляризацию и полярных связей, и поляризованных в результате индуктивных и мезомерных эффектов связей указывают частичными зарядами (δ- и δ+) на соответствующих атомах. Кроме того, для простых связей используют стрелки вдоль связей, а для кратных связей – изогнутые стрелки от связи к соответствующему атому (или к простой связи, разделяющей сопряженные кратные связи).
а) 1-пропанол |
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
CH2 |
|
CH211 |
OH |
|
|||||
|
|
||||
http://www.mitht.ru/e-library
–I-эффект
б) этилборан
|
|
|
|
|
CH3 |
|
CH |
|
BH |
|
|
|||
|
|
|||
|
2 |
|
||
|
|
|
2 |
|
+I-эффект
в) 2-метилпропеналь
|
|
|
|
CH2 |
C |
CH |
O |
|
CH3 |
|
|
–I- и –М-эффекты альдегидной группы +I-эффект метильной группы
г) 1-бутен
|
|
|
|
CH2 |
CH |
CH |
CH |
|
|
2 |
3 |
–I-эффект винильной группы
+I-эффект этильной группы
д) 3,3,3-трихлорпропен
|
|
|
Cl |
|
|
|
|
|
Cl C |
CH CH2 |
|
Cl
–I-эффекты трех атомов хлора (–I-эффект группы ССl3)
е) изопропиллитий
|
|
|
|
CH3 |
|
|
|
|
CH |
Li |
12 |
CH3 |
|
|
|
http://www.mitht.ru/e-library

+I-эффект атома лития
ж) 2-метокси-1-бутен
|
|
|
|
CH2 |
C |
CH2 |
CH |
|
|
|
3 |
|
O |
CH3 |
|
|
|
|
|
+I-эффект этильной группы –I- и +М-эффекты метоксигруппы
з) 1-нитро-1-бутен
|
|
|
|
|
|
||||
O N |
CH CH CH2 |
CH3 |
||
 O
O 
–I- и –М-эффекты нитрогруппы, +I-эффект этильной группы
13
http://www.mitht.ru/e-library
Задача 3 . Сравните скорости реакций электрофильного
присоединения к следующим соединениям: этилен, пропен, 3,3,3-трифторпропен, 2-метилпропен.
Скорость реакций электрофильного присоединения к двойной углерод-углеродной связи, или реакционная способность в реакциях АdЕ, зависит от нуклеофильности этой связи. Нуклеофильность, т.е. способность быть донором электронной пары, в свою очередь, пропорциональна величине электронной плотности на этой связи. Поэтому для сравнения скоростей необходимо сравнить влияние заместителей (атомов и групп атомов) на электронную плотность двойной связи, т.е. определить направление и относительную величину их электронных эффектов.
F
CH2 CH2 CH3 CH CH2 CH2 CH
CH CH2 CH2 CH C
C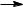 F CH3
F CH3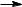 C CH2
C CH2
F CH3
Вмолекуле этилена с атомами углерода двойной связи связаны только атомы водорода, индуктивный эффект которых принят равным 0. Поэтому молекулу этилена можно рассматривать как стандарт, относительно которого можно располагать
вряд все остальные соединения.
Вмолекуле пропена метильная группа проявляет +I-
эффект, т.е. является заместителем, увеличивающим электронную плотность на двойной связи и, следовательно, повышающим реакционную способность пропена в реакциях электрофильного присоединения по сравнению с реакционной способностью этилена.
Еще более реакционноспособным, чем этилен и пропен, является 2-метилпропен, поскольку в его молекуле двойная связь имеет два электронодонорных заместителя.
В молекуле 3,3,3-трифторпропена три атома фтора из-за их большей электроотрицательности по сравнению с атомом углерода проявляют –I-эффекты, которые вызывают на атоме углерода, с которым они связаны большой дефицит электронной плотности. Это делает трифторметильную группу сильным электроноакцептором. Поэтому 3,3,3-трифторпропен дезактивирован к реакциям электрофильного присоединения, т.е. реа-
14
http://www.mitht.ru/e-library
гирует с электрофильными реагентами значительно медленнее, чем этилен.
Таким образом, данные соединения можно расположить в такой ряд по увеличению реакционной способности в реакциях
АdЕ:
3,3,3-трифторпропен ‹ этилен ‹ пропен ‹ 2- метилпропен.
15
http://www.mitht.ru/e-library
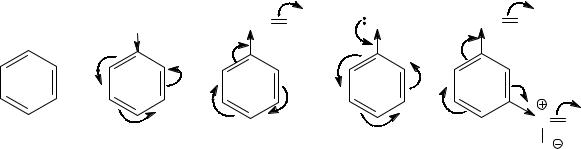
Задача 4. Сравните реакционную способность следующих
соединений в реакциях электрофильного замещения: бензол, толуол, бензальдегид, фенол, мета- нитробензальдегид.
Реакционная способность ароматических соединений в реакциях электрофильного замещения зависит от их нуклеофильности – способности быть донором электронной пары, которая зависит от общей электронной плотности ароматического ядра. Заместители, оказывющие электронодонорное действие на ароматическое ядро, увеличивают электронную плотность на нем и тем самым повышают реакционную способность соединений, т.е. активируют их к электрофильной атаке. Электроноакцепторные заместители, уменьшая электронную плотность ароматического кольца, действуют как дезактивирующие заместители. Поэтому для сравнения реакционной способности необходимо определить характер заместителей, выявить все электронные эффекты, которыми конкретный заместитель влияет на ароматическое ядро.
CH3 |
|
CH |
O |
OH |
|
CH |
O |
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N O |
|
|
|
|
O
В молекуле толуола метильный заместитель проявляет +I-эффект, т.е. является электронодонором. Поэтому толуол по сравнению с бензолом является активированным соединением и реагирует с электрофилами быстрее.
Молекула бензальдегида дезактивирована к электрофильному замещению, поскольку формильная группа является электроноакцепторным заместителем (дезактиватором), проявляя по отношению к бензольному кольцу и –I-, и –М-эффект.
Еще более дезактивированным, чем бензальдегид, является мета-нитробензальдегид, поскольку кроме электроноакцепторной формильной группы в этой молекуле присутствует еще и такой сильный дезактивирующий заместитель, как нитрогруппа (–I- и –М-эффекты).
16
http://www.mitht.ru/e-library
Самым активированным соединением является фенол, гидроксильная группа которого, несмотря на –I-эффект, проявляет сильное общее электронодонорное воздействие на ароматическое ядро благодаря очень эффективному р-π- сопряжению (+М››–I).
Таким образом, данные соединения располагаются в следующий ряд по возрастанию реакционной способности в реакциях электрофильного замещения:
мета-нитробензальдегид ‹ бензальдегид ‹ бензол ‹ толуол ‹ фенол.
17
http://www.mitht.ru/e-library
Задача 5. Сравните кислотные свойства следующих соеди-
нений: а) метан и нитрометан; б) этанол и 2-хлорэтанол; в) метанол и метиламин; г) уксусная кислота и ацетон; д) этанол и фенол. Ответы обоснуйте.
Кислотные свойства согласно теории Бренстеда проявляются в способности соединения вступать в обратимое взаимодействие с акцептором протонов – основанием – с образованием сопряженного основания и сопряженной основанию кислоты и определяются положением этого равновесия. Чем сильнее равновесие смещено вправо, тем сильнее выражены кислотные свойства. Сравнить кислотные свойства разных кислот можно качественно, сравнивая положение кислотно-основных равновесий этих кислот с каким-либо основанием. Положение равновесия зависит от относительной стабильности сопряженных оснований, поэтому для сравнения кислотных свойств различных соединений необходимо оценить устойчивость сопряженных оснований. Чем более устойчиво сопряженное основание,
тем оно слабее, и, следовательно, тем сильнее соответст-
вующая кислота. На устойчивость сопряженных оснований, которые для не имеющих заряда кислот являются отрицательно заряженными частицами – анионами, влияют как внутримолекулярные факторы, так и внешние факторы, как, например, сольватация. Если же растворитель не указан, то рассматривают зависимость устойчивости сопряженных оснований только от внутренних факторов, к которым относятся прежде всего электронные: а именно, способность соседних атомов и групп стабилизировать отрицательно заряженную частицу. Это может быть отрицательный индуктивный эффект заместителя, который уменьшает отрицательный заряд за счет стягивания электронной плотности, или отрицательный мезомерный эффект, обусловливающий делокализацию электронной плотности и отрицательного заряда.
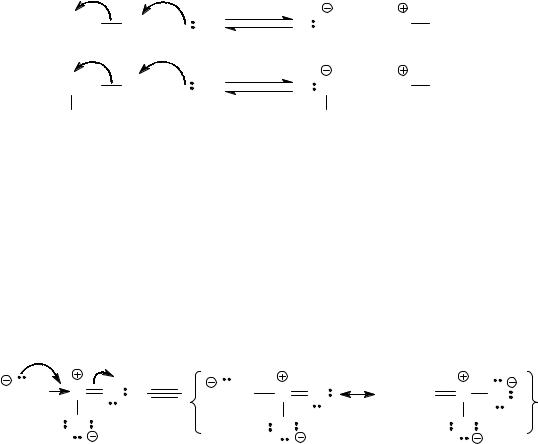
а) метан и нитрометан
Изобразим кислотно-основные равновесия для этих соединений с каким-либо основанием (В).
18
http://www.mitht.ru/e-library
CH3 |
H |
+ |
B |
CH3 |
+ |
B |
H |
CH2 |
H |
+ |
B |
CH2 |
+ |
B |
H |
NO2 |
|
|
|
NO2 |
|
|
|
Сопряженным основанием для метана как кислоты является метил-анион - очевидно крайне нестабильная частица, поскольку никаких стабилизирующих факторов внутри нее нет. Напротив, нитрометил-анион – сопряженное основание нитрометана – отличается от метил-аниона наличием нитрогруппы, которая эффективно стабилизирует эту частицу, не просто уменьшая отрицательный заряд за счет –I-эффекта, но и делокализуя его за счет –М-эффекта.
CH2 N |
O |
CH2 N |
O |
CH2 N |
O |
O |
|
O |
|
O |
|
Следовательно, нитрометил-анион более стабилен, чем метил-анион. Поэтому нитрометан является более сильной кислотой, чем метан. Действительно, нитрометан как кислота более чем на 30 порядков сильнее, чем метан.
б) этанол и 2-хлорэтанол
В молекулах этанола и 2-хлорэтанола имеются разные атомы водорода, но кислотные свойства этих соединений обусловлены наличием гидроксильной группы, поскольку О-Н- кислоты, являются более сильными, чем С-Н-кислоты (способность атомов нести отрицательный заряд зависит от их положения в периодической таблице: в периоде она увеличивается слева направо). Поэтому кислотно-основные равновесия для этих соединений выглядят следующим образом:
19
http://www.mitht.ru/e-library

CH3CH2O H +  B
B 
 CH3CH2O
CH3CH2O + B H
+ B H
CH2CH2O H +  B
B 
 CH2CH2O
CH2CH2O + B H
+ B H
Cl |
Cl |
2-Хлорэтоксид-анион более устойчив, чем этоксид-анион, поскольку атом хлора, проявляющий –I-эффект, стягивает электронную плотность по σ-связям, уменьшая электронную плотность на атоме кислорода и этим ослабляя его основность. Следовательно, 2-хлорэтанол более сильная кислота, чем этанол.
в) метанол и метиламин
О-Н-Кислоты, как и N-Н-кислоты являются более сильными кислотами, чем С-Н-кислоты, поэтому кислотно-основные равновесия для метанола и метиламина выглядят следующим образом:
CH3O H + B |
CH3O + B H |
CH3NH H +
H +  B
B 
 CH3NH + B H
CH3NH + B H
Метоксид-анион является более устойчивой частицей, чем метиламид-анион, поскольку более электроотрицательный атом кислорода легче «держит» отрицательный заряд, чем менее электроотрицательный атом азота. Поэтому метоксиданион является более слабым сопряженным основанием, чем метиламид-анион, а метанол – более сильная кислота, чем метиламин.
г) уксусная кислота и ацетон
Кислотно-основные равновесия для уксусной кислоты и ацетона выглядят следующим образом:
20
http://www.mitht.ru/e-library
