
Решение задач по органической химии
.pdf
O |
+ B |
|
O |
|
CH3 C |
CH3 C |
O |
+ B H |
|
O H |
|
|
|
|
O |
+ B |
|
O |
|
CH C |
CH |
C |
+ B H |
|
3 |
|
3 |
|
|
CH2 |
H |
|
CH2 |
|
О-Н-Кислоты являются более сильными кислотами, чем С- Н-кислоты (см. примеры «б» и «в»). Сравнение устойчивости сопряженных оснований подтверждает это. Действительно, ацетат-анион более устойчив, чем ацетонид-анион, поскольку он более эффективно стабилизирован: две его граничные структуры эквивалентны, в отличие от неэквивалентных граничных структур ацетонид-аниона.
O |
O |
CH3C O |
|
O |
CH3C |
CH3C |
CH C |
||
O |
O |
CH |
3 |
CH2 |
|
|
2 |
|
|
Поэтому ацетонид-анион является более сильным основанием, и, следовательно, ацетон – более слабая кислота.
д) этанол и фенол
CH3CH2O H +  B
B 
 CH3CH2O
CH3CH2O + B H
+ B H
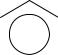
 O H +
O H +  B
B 

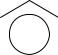
 O
O + B H
+ B H
Этоксид-анион – основание, сопряженное этанолу, - является менее устойчивой частицей, чем феноксид-анион, в котором заряд делокализован в результате сопряжения р- электронной пары атома кислорода с π-системой бензольного кольца. Ниже приведен набор граничных структур, показывающий эту делокализацию.
21
http://www.mitht.ru/e-library
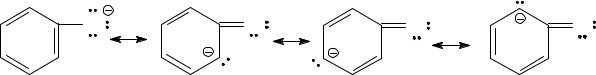
O |
O |
O |
O |
Такая делокализация сильно стабилизирует феноксиданион и понижает его основность по сравнению с этоксиданионом, поэтому фенол является более сильной кислотой, чем этанол.
22
http://www.mitht.ru/e-library
Задача 6. Определите, в какую сторону смещены следую-
щие равновесия: а)
CH3CH2ONa + CH3COOH  CH3CH2OH + CH3COONa
CH3CH2OH + CH3COONa
б)
ONa |
OH |
OH |
ONa |
+ |
|
NO2 |
+ |
NO2 |
|
|
|
в) |
|
|
|
CH3C C H + CH3 |
MgBr |
CH3C C |
MgBr + CH4 |
Данные равновесия представляют собой кислотноосновные взаимодействия, поэтому следует сравнить по силе участвующие в них кислоты и основания. Равновесие будет смещено в ту сторону, в которой находятся более слабые кислота и основание.
а)
CH3CH2ONa + CH3COOH  CH3CH2OH + CH3COONa
CH3CH2OH + CH3COONa
Это равновесие смещено вправо, поскольку в этой части равновесия находятся более слабая кислота – этанол – и более слабое основание – ацетат натрия. Этанол является более слабой кислотой, чем уксусная кислота, т.к. его сопряженное основание – этоксид-анион – менее устойчив и, следовательно, более основен, чем сопряженное уксусной кислоте основание – ацетат-анион. Устойчивость ацетат-аниона обусловлена делокализацией электронной плотности и отрицательного заряда в результате р-π-сопряжения.
O |
O |
O |
|
CH3C |
CH3C |
CH3C |
|
O |
|||
O |
O |
В этоксид-анионе такой делокализации нет, поэтому он менее устойчив и более основен, чем ацетат-анион.
23
http://www.mitht.ru/e-library

б)
ONa |
OH |
OH |
ONa |
NO2 |
+ |
NO2 |
+ |
|
|
Данное равновесие смещено влево, т.к. в этой части располагаются более слабая кислота – фенол – и более слабое основание – орто-нитрофеноксид-анион. орто-Нитрофенол является более сильной кислотой, чем фенол, поскольку его сопряженное основание – орто-нитрофеноксид-анион – более устойчив и, следовательно, менее основен в результате участия нитро-группы (–М-эффект) в делокализации отрицательного заряда. Ниже для краткости приведены только две (из пяти) граничные структуры орто-нитрофеноксид-аниона с локализацией отрицательного заряда на фенольном кислороде и на нитро-группе.
O |
|
O |
O |
|
N |
O |
N O |
N |
O |
O |
|
O |
O |
|
в) |
|
|
|
|
CH3C C H |
+ CH3 MgBr |
CH3C |
C MgBr |
+ CH4 |
Равновесие смещено вправо. Метан по сравнению с пропином является более слабой кислотой. Его сопряженное основание – метилмагнийбромид – сильнее, чем сопряженное основание пропина, т.к. легче отдает пару электронов связи угле- род-магний для образования связи с протоном (электроотрицательность sp3-гибридизованного атома углерода меньше, чем электроотрицательность sp-гибридизованного атома углерода). Поэтому в правой части равновесия расположены и более слабое основание, и более слабая кислота.
24
http://www.mitht.ru/e-library
Задача 7. Сравните следующие соединения по основ-
ности: а) метанол и метиламин; б) этанол и фенол; в) этилат натрия и ацетат натрия; г) анилин и пара-нитроанилин.
Основность по Бренстеду – это способность частицы выступать донором электронной пары для образования ковалентной связи с протоном при взаимодействии с кислотой. Эта способность зависит от природы атома, дающего пару электронов для образования связи, от величины электронной плотности на этом атоме, от степени локализации заряда, если частица заряжена. Кроме того, основность зависит от кислоты, с которой основание вступает в кислотно-основное взаимодействие. Поэтому сравнение основности разных оснований можно проводить только в зависимости от внутренних факторов, влияющих на это свойство.
а) метанол и метиламин
Эти соединения проявляют основные свойства, поскольку гетероатомы (атомы кислорода и азота) имеют неподеленные пары электронов, которые могут быть предоставлены для образования связи с протоном.
H
CH3OH + H A 
 CH3OH +
CH3OH +  A
A
H
CH3NH2 + H A 
 CH3NH2 +
CH3NH2 +  A
A
Атом азота менее электроотрицателен, чем атом кислорода, поэтому в метиламине азот легче предоставляет пару электронов для образования связи с протоном, чем атом кислорода в метаноле. Следовательно, метиламин более основен, чем метанол.
б) этанол и фенол
 OH
OH
CH3CH2OH
Основные свойства этих соединений обусловлены наличием неподеленной пары электронов на атомах кислорода. В отличие от этанола, в котором эта пара локализована на атоме
25
http://www.mitht.ru/e-library
кислорода, в молекуле фенола имеется р-π-сопряжение, в результате которого неподеленная пара становится делокализованной. Это приводит к уменьшению электронной плотности на атоме кислорода в результате ее смещения в сторону ароматического кольца, что в свою очередь вызывает ослабление основности фенола по сравнению с этанолом.
в) этилат натрия и ацетат натрия
O
CH3CH2O Na |
CH3C |
O 
 Na
Na
В этих соединениях основаниями являются анионы, в которых отрицательный заряд находится на атоме кислорода. В этоксид-анионе он локализован, поэтому основность этой частицы велика, в то время как в ацетат-анионе заряд делокализован в результате р-π-сопряжения, и поэтому как основание аце- тат-анион значительно слабее.
г) анилин и пара-нитроанилин
 NH2
NH2  NH2
NH2

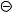 N
N
 O O
O O
Нитрогруппа как электроноакцептор ( –I- и –М-эффекты) уменьшает электронную плотность на атоме азота аминогруппы в молекуле пара-нитроанилина, и, следовательно, основность этого соединения по сравнению с анилином уменьшается.
26
http://www.mitht.ru/e-library
Задача 8. Изобразите конформационное равновесие двух
наиболее устойчивых конформаций следующих соединений: а) 1,2-пропандиол; б) транс-1-изопропил-3- метилциклогексан; в) цис-2-фенил-1-метилциклогексан. Укажите самую стабильную конформацию. Ответ обоснуйте.
а) (R)-1,2-пропандиол
CH2CHCH3
OH OH
Наиболее устойчивыми конформациями ациклических соединений являются заторможенные конформации. Из двух заторможенных конформаций (R)-1,2-пропандиола, находящихся в равновесии при вращении вокруг связи С(1)—С(2), более устойчивой является конформация с гош-расположением гидроксильных групп, т.к. в ней по сравнению с конформацией, в которой гидроксильные группы находятся в анти-положении, может реализоваться внутримолекулярная водородная связь, стабилизирующая эту конформацию.
|
|
|
|
|
|
OH |
|
H |
|
|
|
O |
||
H |
CH3 |
H |
||
O |
||||
|
|
H |
|
|
H |
H |
H |
H |
|
|
OH |
|
CH3 |
б) транс-1-изопропил-3-метилциклогексан
CH3
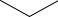

 CHCH3
CHCH3
CH3
27
http://www.mitht.ru/e-library
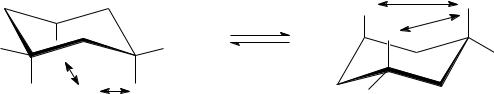
Наиболее устойчивыми конформациями циклогексана и большинства его замещенных производных являются конформации «кресла», в которых отсутствуют заслонения, т.е. заслоненные конформации по каким-либо связям в цикле (в отличие от конформации «ванны»). Поэтому для ответа на поставленный вопрос необходимо изобразить две конформации кресла, в которых у атомов С(1) и С(3) находятся два заместителя – изопропил и метил, причем в транс-конфигурации, т.е. по разные стороны от средней плоскости цикла. В первой конформации («кресло» I) изопропил расположим на аксиальной связи. Тогда метильную группу необходимо расположить на экваториальной связи (при расположении ее на аксиальной связи получилась бы цис-конфигурация, поскольку оба заместителя оказались бы по одну сторону средней плоскости цикла). При инверсии «кресла» I образуется конформация «кресла» II, при этом все связи, которые в «кресле» I были аксиальными, становятся экваториальными, а экваториальные связи становятся аксиальными. Поэтому в «кресле» II изопропил оказывается экваториальным, а метил аксиальным.
|
|
H |
CH3 |
|
|
|
|
H |
CH3 |
|
H |
|
H |
||
H |
|
|
|
CH(CH3)2 H |
|
(CH3)2CH |
|
«кресло» I |
|
«кресло» II |
|
Для сравнения устойчивости двух изображенных конформаций необходимо учесть 1,3-диаксиальные взаимодействия (показаны обоюдоострыми стрелками). Чем они сильнее, тем менее устойчива конформация. В «кресле» I в этих взаимодействиях участвует более объемная изопропильная группа, поэтому конформация «кресла» II более устойчива.
28
http://www.mitht.ru/e-library
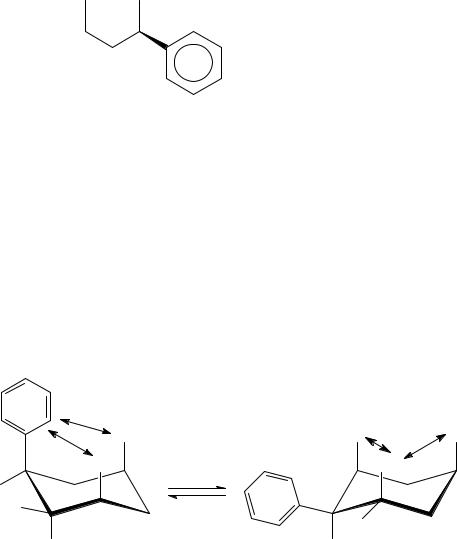
б) цис-1-метил-2-фенилциклогексан
 CH3
CH3
Для изображения цис-конфигурации необходимо один из заместителей расположить на аксиальной связи, тогда второй заместитель должен быть экваториальным (в противном случае, когда второй заместитель также аксиален, получится расположение заместителей по разные стороны от средней плоскости цикла, т.е. транс-конфигурация). Из двух кресловидных конформаций более устойчивой будет та, в которой 1,3- диаксиальные взаимодействия слабее. Поэтому фенил, как более объемный заместитель по сравнению с метилом, должен располагаться на экваториальной связи, т.е. более устойчивой конформацией является «кресло» II.
H |
H |
H |
H |
CH3 |
|
H |
|
|
CH3 |
H |
|
|
|
|
H |
H |
|
«кресло» I |
«кресло» II |
|
29
http://www.mitht.ru/e-library
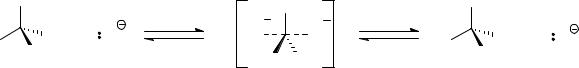
Задача 9. Сравните скорости бимолекулярного нуклео-
фильного замещения для следующих соединений: метилбромид, трет-бутилбромид, этилбромид, изопропилбромид. Ответ обоснуйте.
Бимолекулярное нуклеофильное замещение происходит с синхронным разрывом связи углерод-галоген и образованием связи углерод-нуклеофил. Поэтому скорость реакции определяет, кроме других факторов, энергия переходного состояния. Чем ниже энергия этого состояния, тем выше скорость реакции.
|
R' |
|
R' |
|
R' |
|
R" + Y |
|
|
R" + X |
|
R |
Y |
X |
R |
||
X |
R |
R" |
X |
||
|
|
|
|
переходное состояние
Энергия переходного состояния зависит от несвязанных взаимодействий атомов и групп, координированных с реакционным центром. Следовательно, чем больше эффетивный объем заместителей в субстрате, тем больше энергия переходного состояния, и, следовательно, тем меньше скорость реакции. В переходном состоянии реакции трет-бутилбромида реакционный центр связан с тремя метильными группами, в случае изопропилбромида – с двумя, в случае этилбромида – только с одной. Самой низкой энергией обладает переходное состояние реакции метилбромида, т.к. в нем реакционный центр связан с тремя атомами водорода, имеющими значительно меньший объем, чем метильная группа. Поэтому метилгалогениды наиболее реакционноспособны в реакциях SN2, а для третичных алкилгалогенидов скорость бимолекулярного нуклеофильного замещения чрезвычайно мала, и этот механизм для них практически маловероятен.
На основании всего вышесказанного можно составить ряд увеличения скорости реакций SN2:
трет-бутилбромид ‹ изопропилбромид ‹ этилбромид ‹ метилбромид.
30
http://www.mitht.ru/e-library
