
- •1. Основные определения и понятия термодинамики
- •2. Параметры состояния и уравнения состояния.
- •3.Термодинамическая и потенциальные работы, координаты p-V
- •4. Теплоемкость. Определение теплоемкости веществ.
- •5. Математическое выражение 1го начала термодинамики
- •6.Первое начало термодинамики по балансу рабочего тела
- •7. Аналитическое выражение первого начала термодинамики
- •8. Первое начало термодинамики для идеального газа.
- •9. Принцип существования энтропии идеального газа.
- •10. Процессы изменения состояния (изобара, изохора, изотерма и адибата)
- •11. Политропа с постоянным показателем.
- •12. Работа в термодинамических процессах простых тел (изобара, изохора, изотерма и адиабата)
- •13. Теплообмен в термодинамических процессах простых тел (изобара, изохора, изотерма и адиабата)
- •14. Процессы изменения состояния идеальных газов.
- •15. Работа и теплообмен в политропных процессах идеальных газов.
- •16. Круговые процессы. Кпд и холодильный коэффициент.
- •17. Обратимый цикл Карно.
- •18. Математическое выражение второго начала термостатики. Основные следствия.
- •19. Математическое выражение второго начала термодинамики. Основные следствия.
- •20. Смеси жидкостей, паров и газов, расчет характеристик смеси веществ. Схемы смещения.
- •21. Истечение жидкостей и газов. Основные расчётные соотношения.
- •22.Особенности истечения сжимаемой жидкости. Кризис истечения. Режимы истечения.
- •23.Переход через критическую скорость (сопло Лаваля).
- •24. Особенности истечения через каналы переменного сечения, сопло и диффузор.
- •25. Дросселирование. Эффект Джоуля-Томсона. Основные понятия
- •26. Процессы парообразования, определение параметров насушенного пара, диаграмма h-s.
- •27. Термодинамические циклы и кпд гту.
- •28.Термодинамические циклы и кпд поршневых двс.
- •29. Теплопроводность. Закон Фурье. Коэффициент теплопроводности
- •30. Дифференциальное уравнение теплопроводности. Условия однозначности
- •31. Теплопроводность через однослойные стенки (плоские, цилиндрические).
- •32 Теплопроводность через многослойные стенки (плоские, цилиндрические)
- •33.Теплоотдача. Закон Ньютона-Рихмана. Коэффициент теплоотдачи. Критериальные уравнения.
- •34. Теплообмен излучением. Основные законы.
- •35. Теплообмен излучением между телами.
- •36. Теплопередача. Основное уравнение теплопередачи. Коэффициент теплопроводности.
- •37. Теплопередача через плоскую однослойную и многослойную плоскую стенку
- •38. Теплопередача через криволинейные однослойные и многослойные стенки.
- •39.40. Оптимизация процессов теплопередачи. Способы интенсификации теплопередачи.
- •41,43. Теплопередача при переменных температурах. Средняя разность температур.
- •44. Расчет теплообменный аппаратов первого рода.
- •45. Расчет теплообменный аппаратов второго рода.
- •46. Паросиловые установки, цикл Ренкина, методы повышения кпд.
- •48. Воздушные холодильные машины.
- •49. Рабочий процесс двухтактного и четырехтактного двигателя внутреннего сгорания.
- •50. Индикаторные и эффективные характеристики двигателей внутреннего сгорания
- •51. Рабочий процесс и характеристики гту.
6.Первое начало термодинамики по балансу рабочего тела
![]() =
=
![]() +
+
![]() .
(1.52)
.
(1.52)
Уравнение (1.52) является математическим выражением первого начала термодинамики по внешнему балансу.
Работа
необратимых потерь
![]() ,
связанная с затратами энергии на
преодоление сил трения, удары и завихрения,
превращается в теплоту внутреннего
теплообмена (
,
связанная с затратами энергии на
преодоление сил трения, удары и завихрения,
превращается в теплоту внутреннего
теплообмена (![]() )
)
![]() =
=
![]() .
(1.53)
.
(1.53)
Следовательно,
полное количество теплоты
![]() ,
полученное
телом, равно сумме теплоты, подведенной
извне
,
полученное
телом, равно сумме теплоты, подведенной
извне
![]() ,
и теплоты
внутреннего теплообмена
,
и теплоты
внутреннего теплообмена
![]()
![]() =
=
![]() +
+
![]() .
(1.54)
.
(1.54)
Подставив
значение
![]() и
и
![]() в
исходное уравнение (1.52), получим следующие
соотношения:
в
исходное уравнение (1.52), получим следующие
соотношения:
![]()
![]() ;
(1.55)
;
(1.55)
![]() .
(1.56)
.
(1.56)
Уравнения (1.55) и (1.56) называются уравнениями первого начала термодинамики по балансу рабочего тела, и справедливы для реальных процессов.
Первое
начало термодинамики по балансу рабочего
тела:
![]() ,
где
,
где![]() - полный или приведённый теплообмен.
- полный или приведённый теплообмен.
Полное
количество теплоты
![]() ,
полученное
телом, равно сумме теплоты, подведенной
извне
,
полученное
телом, равно сумме теплоты, подведенной
извне
![]() ,
и
теплоты внутреннего теплообмена
,
и
теплоты внутреннего теплообмена
![]()
Первое начало термодинамики по балансу рабочего тела справедливо для любых процессов протекающих в системе.
В
условиях обратимого процесса, то есть
![]() ,
первое начало термодинамики по балансу
рабочего тела переходит в первое начало
термодинамики по внешнему балансу. Для
использования этого уравнения нужно
уметь его интегрировать. При интегрировании
получится:
,
первое начало термодинамики по балансу
рабочего тела переходит в первое начало
термодинамики по внешнему балансу. Для
использования этого уравнения нужно
уметь его интегрировать. При интегрировании
получится:![]() для необратимых процессов и
для необратимых процессов и![]() для обратимых процессов.
для обратимых процессов.
7. Аналитическое выражение первого начала термодинамики
Значения удельных внутренней энергии и энтальпии простого тела однозначно определяются двумя независимыми переменными и могут быть представлены следующим образом:
![]() ;
;
![]() .
.
Изменения внутренней энергии и энтальпии простого тела, как функций состояния, в элементарных процессах являются полными дифференциалами и определяются соотношениями
![]() ;
(1)
;
(1)
![]() .
(2)
.
(2)
Для
изохорного процесса (![]() )
частная производная внутренней энергии
по температуре равна истинной изохорной
теплоемкости
)
частная производная внутренней энергии
по температуре равна истинной изохорной
теплоемкости
![]() ,
(3)
,
(3)
а для
изобарного процесса (![]() )
частная производная энтальпии по
температуре равна истинной изобарной
теплоемкости
)
частная производная энтальпии по
температуре равна истинной изобарной
теплоемкости
![]() .
(4)
.
(4)
В
результате подстановки выражений (1) и
(2) в уравнение![]() и разделения переменных получим:
и разделения переменных получим:
![]() .
(5)
.
(5)
Данное соотношение (5) называется первым началом термодинамики для простых тел в аналитической форме.
В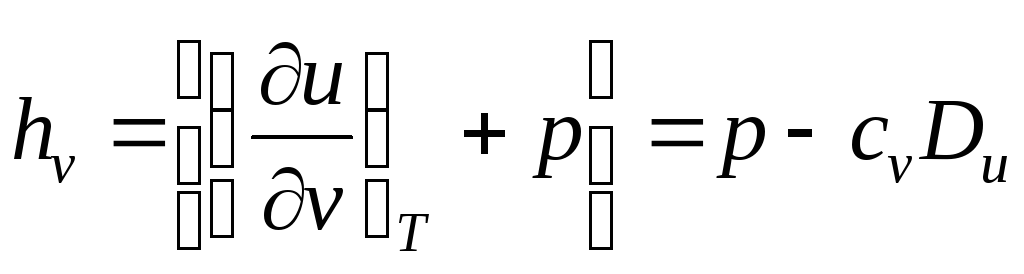 ыражения
в квадратных скобках в литературе часто
называют калорическими коэффициентами,
ыражения
в квадратных скобках в литературе часто
называют калорическими коэффициентами,
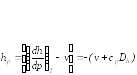
![]()
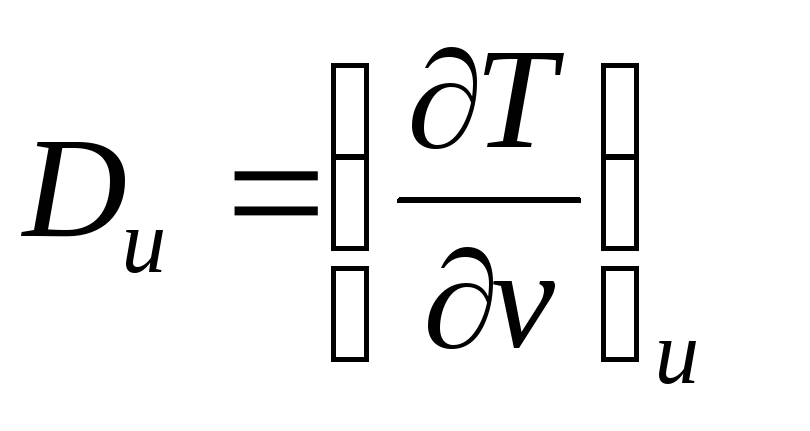
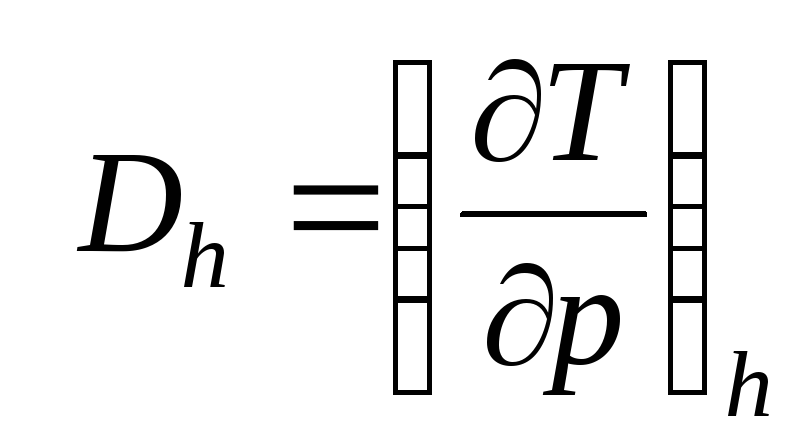
– коэффициент Джоуля – Гей Люссака,
![]()
– коэффициент Джоуля-Томсона,
Коэффициенты Джоуля – Гей Люссака и Джоуля-Томсона реальных газов определяются по таблицам термодинамических свойств.
