
- •1. Основные определения и понятия термодинамики
- •2. Параметры состояния и уравнения состояния.
- •3.Термодинамическая и потенциальные работы, координаты p-V
- •4. Теплоемкость. Определение теплоемкости веществ.
- •5. Математическое выражение 1го начала термодинамики
- •6.Первое начало термодинамики по балансу рабочего тела
- •7. Аналитическое выражение первого начала термодинамики
- •8. Первое начало термодинамики для идеального газа.
- •9. Принцип существования энтропии идеального газа.
- •10. Процессы изменения состояния (изобара, изохора, изотерма и адибата)
- •11. Политропа с постоянным показателем.
- •12. Работа в термодинамических процессах простых тел (изобара, изохора, изотерма и адиабата)
- •13. Теплообмен в термодинамических процессах простых тел (изобара, изохора, изотерма и адиабата)
- •14. Процессы изменения состояния идеальных газов.
- •15. Работа и теплообмен в политропных процессах идеальных газов.
- •16. Круговые процессы. Кпд и холодильный коэффициент.
- •17. Обратимый цикл Карно.
- •18. Математическое выражение второго начала термостатики. Основные следствия.
- •19. Математическое выражение второго начала термодинамики. Основные следствия.
- •20. Смеси жидкостей, паров и газов, расчет характеристик смеси веществ. Схемы смещения.
- •21. Истечение жидкостей и газов. Основные расчётные соотношения.
- •22.Особенности истечения сжимаемой жидкости. Кризис истечения. Режимы истечения.
- •23.Переход через критическую скорость (сопло Лаваля).
- •24. Особенности истечения через каналы переменного сечения, сопло и диффузор.
- •25. Дросселирование. Эффект Джоуля-Томсона. Основные понятия
- •26. Процессы парообразования, определение параметров насушенного пара, диаграмма h-s.
- •27. Термодинамические циклы и кпд гту.
- •28.Термодинамические циклы и кпд поршневых двс.
- •29. Теплопроводность. Закон Фурье. Коэффициент теплопроводности
- •30. Дифференциальное уравнение теплопроводности. Условия однозначности
- •31. Теплопроводность через однослойные стенки (плоские, цилиндрические).
- •32 Теплопроводность через многослойные стенки (плоские, цилиндрические)
- •33.Теплоотдача. Закон Ньютона-Рихмана. Коэффициент теплоотдачи. Критериальные уравнения.
- •34. Теплообмен излучением. Основные законы.
- •35. Теплообмен излучением между телами.
- •36. Теплопередача. Основное уравнение теплопередачи. Коэффициент теплопроводности.
- •37. Теплопередача через плоскую однослойную и многослойную плоскую стенку
- •38. Теплопередача через криволинейные однослойные и многослойные стенки.
- •39.40. Оптимизация процессов теплопередачи. Способы интенсификации теплопередачи.
- •41,43. Теплопередача при переменных температурах. Средняя разность температур.
- •44. Расчет теплообменный аппаратов первого рода.
- •45. Расчет теплообменный аппаратов второго рода.
- •46. Паросиловые установки, цикл Ренкина, методы повышения кпд.
- •48. Воздушные холодильные машины.
- •49. Рабочий процесс двухтактного и четырехтактного двигателя внутреннего сгорания.
- •50. Индикаторные и эффективные характеристики двигателей внутреннего сгорания
- •51. Рабочий процесс и характеристики гту.
12. Работа в термодинамических процессах простых тел (изобара, изохора, изотерма и адиабата)
Удельная термодинамическая и потенциальная работы в изобарном процессе определяются из соотношений
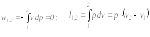
![]()
Для идеального газа
В изохорном процессе определяются из соотношений
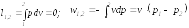
![]()
Для идеального газа
В изопотенциальном процессе определяются из следующих соотношений:
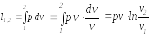
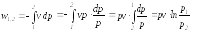
Поэтому, в изопотенциальном процессе численные значения термодинамической и потенциальной работ равны между собой.
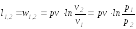
Для идеального газа pv=RT=idem
изотермический:
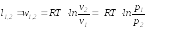
Выражения
конечных (интегральных) величин
термодинамической и потенциальных
работ в политропных процессах можно
получить при сопоставлении их элементарных
значений: ![]() ;
;
![]() .
.
После
подстановки выражения для показателя
политропы
![]()
![]() ,
или
,
или ![]() .
.
Интегрируя последнее выражение с учетом того, что процесс подчиняется уравнению политропы с постоянным показателем (n=idem), получаем следующее соотношение для определения удельной термодинамической работы в конечном процессе (1-2)
![]() .
.
13. Теплообмен в термодинамических процессах простых тел (изобара, изохора, изотерма и адиабата)
Теплообмен в любом термодинамическом процессе изменения состояния простых тел может быть выражен в зависимости от величины термодинамической или потенциальной работы процесса. При этом термодинамический процесс в общем случае рассматривается как политропа с переменным показателем.
Расчетное выражения теплообмена для простых тел выводится на основе рассмотрения выражения первого начала термодинамики
![]()
Количество теплоты, подведенной к рабочему телу или отведенной от него в изобарном процессе, определяется из выражения первого начала термодинамики
![]()

Для идеального газа
И![]() зохорный
процесс:
зохорный
процесс:
Д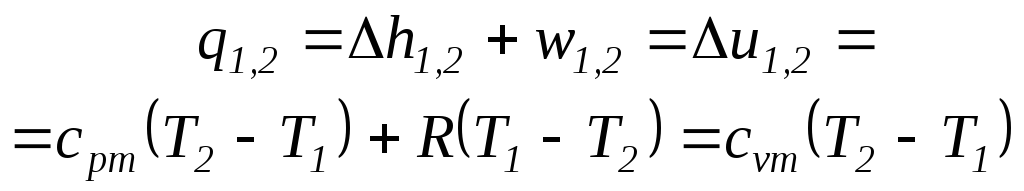 ля
идеального газа
ля
идеального газа
К![]() оличество
теплоты, подведенной к рабочему телу
или отведенной от него в изопотенциальном
процессе определяется из выражения
первого начала термодинамики по балансу
рабочего тела
оличество
теплоты, подведенной к рабочему телу
или отведенной от него в изопотенциальном
процессе определяется из выражения
первого начала термодинамики по балансу
рабочего тела
Для идеалного газа du=0; dh=0
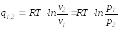
Адиабатный процесс - термодинамический процесс изменения состояния системы, при котором отсутствует теплообмен и в силу обратимости процесса энтропия остается величиной постоянной.
Удельная внутренняя энергия для простых тел может быть представлена в виде функции любых двух независимых параметров состояния. Примем, что u =и (p, v). Тогда дифференциал внутренней энергии запишется в следующем виде:
![]() .
или
.
или
![]() .
.
Пусть
![]() ;
;
![]() ,
тогда
,
тогда
![]() .
=>
.
=>
![]()
1. Изоэнергетический процесс (u = idem, du = 0). Для этого процесса показатель политропы принимает значение n = nu.
Так
как в изоэнергетическом процессе
![]() ,
то
,
то
![]()
2. Адиабатный процесс ( q = 0). n = k (показателем адиабаты).
В
адиабатном процессе
![]() ,
=>
,
=>
![]() .
.
![]() ,
,
![]() .
.
С учетом полученных соотношений для определения av и ap, находим выражения для расчета удельных значений изменения внутренней энергии и теплообмена в элементарном процессе:
![]() ,
,
![]() .
.
Соотношения для расчета удельных значений изменения внутренней энергии и теплообмена в конечном процессе имеют следующий вид:
![]() ,
,
![]() .
.
