
- •Северный государственный медицинский университет
- •Лабораторная работа № 1
- •3. Литература
- •2. Методические указания «Анализ неорганических лекарственных веществ по наличию катионов и анионов и органических лекарственных веществ по функциональным группам».
- •Вопросы для самоподготовки
- •Информационный блок
- •5. Определение иона кальция
- •19. Анионы органических кислот
- •Лабораторная работа №2
- •5. Информационный блок
- •5.1. Функциональные группы
- •6.2. Реакции окисления
- •7. Идентификация фенольного гидроксила
- •7.1. Реакция с железа (III) хлоридом
- •7.2. Реакции окисления (индофеноловая проба)
- •7.3. Реакции конденсации с альдегидам.
- •7.4. Сочетание с солями диазония
- •7.5. Реакции замещения (с бромной водой и азотной кислотой
- •8. Идентификация альдегидной группы
- •9. Идентификация кето-группы.
- •10. Идентификация оксиацетильной группы
- •11.Идентификация карбоксильной группы
- •12.Идентификация сложноэфирной группы
- •12.1. Реакция кислотного или щелочного гидролиза
- •12.2. Гидроксамовая проба
- •13. Обнаружение лактонов
- •14. Идентификация простой эфирной группы
- •15. Идентификация первичной ароматической аминогруппы
- •15.1. Реакция образования азокрасителя
- •15.2. Реакции окисления
- •15.3. Реакции конденсации с альдегидами
- •16. Идентификация первичной алифатической аминогруппы
- •16.1. Нингидриновая проба
- •17. Идентификация вторичной аминогруппы
- •18. Идентификация третичной аминогруппы
- •19. Идентификация амидной и n-замещенной амидной группы
- •19.1. Щелочной гидролиз
- •19.2. Реакция образования комплексных солей с металлами
- •20. Идентификация азометиновой группы
- •21. Идентификация гидразидной группы
- •22. Идентификация ароматической нитрогруппы
- •22.1. Реакция восстановления
- •23. Идентификация сульфгидрильной группы
- •24. Идентификация сульфамидной группы
- •24.1. Реакция образования солей с тяжелыми металлами
- •24.2. Реакция минерализации
- •27. Идентификация соединений, содержащих
Информационный блок
Анализ неорганических веществ основан на взаимодействии отдельных ионов. Определенный катион с одним и тем же анионом дают одинаковый продукт реакции независимо от того, в составе какого соединения они были до реакции. Это свойство позволяет установить подлинность катионов или анионов в различных неорганических лекарственных веществах по характерным для них реакциям.
Количество вещества, необходимое для определения иона рассчитывают по формуле:
![]()
Mr – молярная масса лекарственного вещества;
F – минимальное содержание определяемого иона, г;
Ar – атомная масса определяемого иона.
Например, для обнаружения иона натрия следует взять на анализ 1 мл раствора соли, содержащей 0,01-0,03 г иона натрия, подкислить разведенной уксусной кислотой, прибавить 0,5 мл раствора цинк-уранил-ацетата.
Рассчитываем содержание соли натрия, например, натрия хлорида в граммах:
![]()
Т.к. 0,025 г катиона натрия должно содержаться в 1 мл раствора, 0,25 г натрия хлорида растворяем в 10 мл воды очищенной.
К 1 мл полученного раствора, прибавляем 2-3 капли раствора кислоты уксусной разведенной и 0,5 мл раствора цинк-уранил-ацетата. Образуется желтый кристаллический осадок.
Определение иона натрия
а) Отмеривают 1 мл 10%-ного раствора натрия сульфата, подкисляют разведенной уксусной кислотой, если необходимо, фильтруют, затем прибавляют 0,5 мл раствора цинк-уранил-ацетата; образуется желтый кристаллический осадок:
NaCl+Zn[(UO2)3(CH3COO)8] +CH3COOH+9H2O→NaZn[(UO2)3(CH3COO)9]∙9H2O↓+HCl
б)Соль натрия, внесенная в бесцветное пламя, окрашивает его в желтый цвет.
Определение иона калия
а) К 1 мл 10%-ного раствора калия иодида прибавляют 1 мл раствора винной кислоты, 1 мл раствора ацетата натрия, 0,5 мл спирта этилового 95% и встряхивают. Постепенно выпадает белый кристаллический осадок:
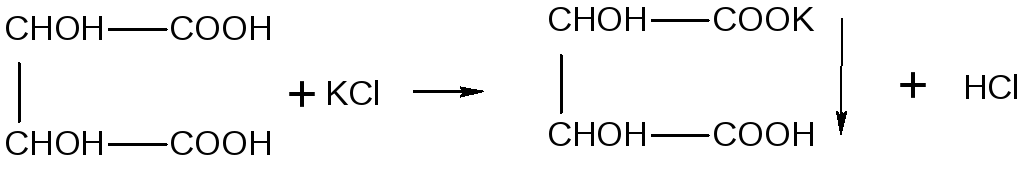
Осадок растворяется в разведенных минеральных кислотах и растворах едких щелочей.
б) К 1 мл 10%-ного раствора калия иодида прибавляют 0,5 мл разведенной уксусной кислоты, 0,5 мл раствора кобальтинитрита натрия; образуется желтый кристаллический осадок:
Na3[Co(NO2)6] + 2KCl → K2Na[Co(NO2)6]↓ + 2NaCl
в) Соль калия, внесенная в бесцветное пламя горелки окрашивает его в фиолетовый цвет.
3.Определение иона серебра
а) К 1 мл 2%-ного раствора серебра нитрата прибавляют 2-3 капли разведенной хлористоводородной кислоты или раствора хлорида натрия; образуется белый творожистый осадок, нерастворимый в азотной кислоте, растворимый в растворе аммиака:
AgNO3 +NaCl→NaNO3 +AgCl↓
AgCl+ 2NH4OH→ [Ag(NH3)2]Cl+ 2H2O
б) К 1 мл 2%-ного раствора серебра нитрата прибавляют раствор аммиака до растворения образующегося вначале осадка, затем 2-3 капли раствора формальдегида и нагревают. На стенках пробирки образуется блестящий налет металлического серебра:
2AgNO3 + 2NH4OH → Ag2O↓ + 2NH4NO3 + H2O
CH2O + Ag2O → 2Ag↓ + HCOOH
4.Определение иона магния
К 1 мл 5% раствора магния сульфата прибавляют 1 мл раствора хлорида аммония, 0,5 мл раствора гидрофосфата натрия и 1 мл раствора аммиака. Образуется белый кристаллический осадок, растворимый в уксусной кислоте:
MgSO4+Na2HPO4+NH4OH
![]() MgNH4PO4↓
+Na2SO4+H2O
MgNH4PO4↓
+Na2SO4+H2O
