
- •Общая и неорганическая химИя Свойства элементов главных подгрупп
- •Введение
- •Лабораторная работа № 1. Свойства элементовIа группы
- •Водород Общие сведения
- •Выполнение работы
- •Щелочные металлы Общие сведения
- •Выполнение работы
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 2. Свойства элементовIiа группы
- •Общие сведения
- •Выполнение работы
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 3. Свойства бора и алюминия
- •Бор Общие сведения
- •Выполнение работы
- •Алюминий Общие сведения
- •Выполнение работы
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 4. Свойства элементовIv а группы
- •Углерод Общие сведения
- •Выполнение работы
- •Кремний Общие сведения
- •Выполнение работы
- •Олово, свинец Общие сведения
- •Выполнение работы Олово
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 5. Свойства элементов V а группы
- •Азот Общие сведения
- •Выполнение работы
- •Фосфор Общие сведения
- •Выполнение работы
- •Сурьма и висмут Общие сведения
- •Выполнение работы
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 6. Свойства элементов VI а группы
- •Кислород Общие сведения
- •Выполнение работы
- •Сера Общие сведения
- •Выполнение работы
- •Реакции сульфит-иона.
- •Свойства тиосульфата натрия.
- •Свойства серной кислоты и сульфатов.
- •Содержание отчета по лабораторной работе
- •Литература
- •Содержание
Фосфор Общие сведения
Свободный фосфор чрезвычайно активен. Он взаимодействует со многими простыми веществами с выделением большого количества теплоты. Легче всего фосфор соединяется с кислородом, галогенами, серой и со многими металлами.
К важнейшим оксидам фосфора принадлежат P2O3иP2O5. Оба проявляют кислотный характер. Оксид фосфора (III) или фосфористый ангидрид получается при медленном окислении фосфора или при его сгорании при недостатке кислорода. При действии холодной воды на оксид фосфора (III) образуется фосфористая кислота. Как и оксид фосфора (III), фосфористая кислота является сильным восстановителем.
Оксид фосфора (V), или фосфорный ангидридP2O5образуется при горении фосфора на воздухе или при избытке кислорода. Оксид фосфора (V) крайне гигроскопичное вещество. На воздухе притягивает влагу и быстро превращается в метафосфорную кислотуHPO3, которая еще впитывает воду и превращается в ортофосфорную кислоту с известной формулойH3PO4. Ортофосфорная кислота, как трехосновная, образует три ряда фосфатов. Все однозамещенные фосфаты растворимы в воде, из двух- и трехзамещенных фосфатов растворимы только соли щелочных металлов.
Кроме фосфористой и фосфорной кислот, фосфор образует фосфорноватую H4P2O6фосфорноватистуюH3PO2кислоты, для которых ангидриды не известны.
Для кислородных кислот фосфора характерны следующие структурные формулы.
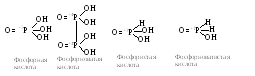
Во всех кислородных кислотах фосфора валентность одинакова и равна пяти. При переходе от одной кислоты к другой меняется степень окисления фосфора.
Выполнение работы
Фосфорная кислота и ее соли.
Опыт 1. Получение гидрофосфата кальцияВнести в пробирку по 4–5 капель растворов хлорида кальция и гидрофосфата натрия Na2HPO4. Отметить цвет выпавшего осадка. Написать уравнение реакции в молекулярной и ионной форме.
Опыт 2. Осаждение фосфата железа и алюминия в присутствии ацетата натрия. В две пробирки внести по 3–4 капли растворов солей: в первую – хлорида железа (III), во вторую –сульфата алюминия. Добавить в каждую из пробирок по 2–3 капли растворов ацетата натрия и гидрофосфата натрия Na2HPO4. Отметить цвета выпавших осадков.
В данном случае в растворах солей алюминия и железа (III), буферированных ацетатом натрия, получаются средние фосфаты этих металлов, нерастворимые в уксусной кислоте:
![]() .
.
Написать уравнения реакций в молекулярной и ионной форме.
Опыт 3. Гидролиз ортофосфатов натрия
В отдельные пробирки налить по 3–4 капли растворов ортофосфата, гидрофосфата и дигидрофосфата натрия. Добавить по 1–2 капли лакмуса и записать в таблицу окраску каждого из растворов этих солей. Вылить содержимое пробирок, промыть их дистиллированной водой и вновь налить указанные выше растворы. Добавить по 1–2 капли фенолфталеина и записать окраску растворов. Исследовать рН растворов фосфатов натрия при помощи универсальной индикаторной бумаги.
Результаты опыта оформить в виде таблицы:
Таблица 1.
|
№ |
Формула соли |
Окраска лакмуса |
Окраска фенол-фталеина |
рН раствора по универсальной индикатороной бумаге |
Характер раствора |
|
1 |
|
|
|
|
|
|
2 |
|
|
|
|
|
|
3 |
|
|
|
|
|
Составить уравнения реакций гидролиза. Вычислить степень гидролиза для каждой реакции в расчете на 0,1 М растворы.
На увеличение концентрации каких ионов указывает изменение окраски лакмуса при растворении фосфата натрия и дигидрофосфата натрия?
Кислотность
раствора NaH2PO4обусловлена
тем, что из двух реакций:![]() и
и![]() .
Диссоциация иона
.
Диссоциация иона![]() протекает более интенсивно, чем его
гидролиз, так как сопровождается
образованием более слабого электролита
протекает более интенсивно, чем его
гидролиз, так как сопровождается
образованием более слабого электролита![]() по сравнению с Н3РО4–
доказать сравнением констант диссоциации
и гидролиза.
по сравнению с Н3РО4–
доказать сравнением констант диссоциации
и гидролиза.
Опыт 4. Фосфорноватистая кислота Н3РО2 и гипофосфиты
Налейте в три пробирки 3–4 капли раствора гипофосфита натрия NаH2PO2 и добавить в первую из них 1–2 капли раствора нитрата серебра, во вторую – столько же нитрата ртути (II), а в третью – по 1–2 капли разбавленной серной кислоты и раствораKMnO4.
Отметьте наблюдения и напишите уравнения реакций. Какие свойства характерны для фосфорноватистой кислоты?
