
- •11. Первичная, вторичная, третичная структура днк.
- •12. Первичная, вторичная, третичная структура рнк. Типы рнк.
- •17. Процессы превращения а/к в кишечнике под влиянием гнилостных бактерий. Обезвреживание ядовитых продуктов.
- •19. Биосинтез белков. Роль нуклеиновых кислот.
- •20. Биосинтез днк. Повреждение и репарация днк.
- •21. Транскрипция, генетический код, процессинг рнк.
- •24. Дезаминирование, трансаминирование, декарбоксилирование.
- •25. Связь трансаминирования и дезаминирования. Непрямое дезаминирование.
- •27. Процессы образования конечных продуктов обмена простых белков.
- •28. Обмен тиоаминокислот.
- •30. Переваривание нуклеопротеидов в жкт. Распад пуриновых и пиримидиновых нуклеотидов. Подагра.
- •31.Распад пуриновых и пиримидиновых нуклеотидов. Подагра.
- •32. Биосинтез пуриновых нуклеотидов.
- •33. Биосинтез пиримидиновых нуклеотидов.
- •35. Синтез гемоглобина. Обмен железа.
- •54. Взаимосвязь всех обменов.
- •64. Окисление высших жирных кислот. Последовательность реакций окисления. Связь окисления жирных кислот с цитратным циклом и дыхательной цепью. Энергетический эффект окисления.
- •92,93. Витамины. Классификация, участие в обмене веществ, а- гипо- гипер- витаминозы.
- •104. Гормоны, классификация, механизм действия.
- •110. Физико-химические свойства крови.
- •112. Ферменты плазмы крови.
- •113. Буферные системы крови. Кислотно-основное состояние.
- •114. Гемоглобин.
- •115-118. Нервная ткань.
- •119. Мышечная ткань.
- •121 И 122. Биохимия молока.
- •123. Роль воды в организме.
- •124. Минеральные вещества, роль гормонов в регуляции обмена солей.
- •128. Содержание глюкозы в крови, возрастные особенности.
- •129. Содержание белков в плазме крови, возрастные особенности.
- •130. Содержание остаточного азота в крови.
- •131. Возрастные особенности состава крови (белки, остаточный азот, глюкоза).
- •132. Электрофорез белков сыворотки крови.
- •133. Минеральные вещества крови.
- •134. Кальций и фосфор в плазме крови.
- •135. Изменение содержания белков, остаточного азота, глюкозы при заболеваниях.
- •136,137. Желудочный сок, формы кислотности.
- •138. Физико-химические показатели мочи, возрастные особенности.
- •139. РН мочи в норме и при патологии.
- •140. Пигменты мочи и их происхождение.
- •141. Органические вещества мочи.
- •142. Азотсодержащие вещества мочи.
- •143. Индикан мочи.
- •144. Парные соединения мочи.
- •145 Минеральные вещества мочи.
- •146. Определение белка в моче.
- •147. Реакция на патологические составные части мочи.
- •148. Глюкозурия.
- •149. Определение глюкозы в моче.
- •150. Кетонурия.
- •151. Креатинурия.
- •152. Протеинурия.
- •153. Гематурия, гемоглобинурия.
- •154. Фенилкетонурия, алкаптонурия.
- •156.Мочевые осадки и камни.
64. Окисление высших жирных кислот. Последовательность реакций окисления. Связь окисления жирных кислот с цитратным циклом и дыхательной цепью. Энергетический эффект окисления.
Свободная жирная кислота независимо от длины углеводородной цепи является метаболически инертной и не может подвергаться никаким биохимическим превращениям, в том числе окислению, пока не будет активирована. Активация жирной кислоты протекает на наружной поверхности мембраны митохондрий при участии АТФ, коэнзима A (HS-KoA) и ионов Mg2+. Реакция катализируется ферментом ацил-КоА-синтетазой. В результате реакции образуется ацил-КоА, являющийся активной формой жирной кислоты. Переносчиком активированных жирных кислот с длинной цепью через внутреннюю митохондриальную мембрану служит карнитин. После прохождения ацилкарнитина через мембрану митохондрий происходит обратная реакция – расщепление ацилкарнитина
Внутримитохондриальное окисление жирных кислот.Ацил-КоА под действием Ацил-КоА дегидрогеназы превращается в Еноил-КоА→под действ. Еноил-КоА-гидратазы в 3-гидроксиацил-КоА →3-оксиацил-КоА →Ацил-КоА и .ацетил-КоА. Образовавшийся ацетил-КоА подвергается окислению в цикле трикарбоновых кислот, а ацил-КоА, укоротившийся на два углеродных атома, снова многократно проходит весь путь β-окисления вплоть до образования бутирил-КоА, который в свою очередь окисляется до 2 молекул ацетил-КоА.
При каждом цикле β-окисления образуются одна молекула ФАДН2 и одна молекула НАДН. Последние в процессе окисления в дыхательной цепи и сопряженного с ним фосфорилирования дают: ФАДН2 – 2 молекулы АТФ и НАДН – 3 молекулы АТФ, т.е. в сумме за один цикл образуется 5 молекул АТФ. При окислении пальмитиновой кислоты образуется 5 х 7 = 35 молекул АТФ. В процессе β-окисления пальмитиновой кислоты образуется 8 молекул ацетил-КоА, каждая из которых, «сгорая» в цтк, дает 12 молекул АТФ, а 8 молекул ацетил-КоА дадут 12 х 8 = 96 молекул АТФ.
65.Биосинтез жирных кислот, последовательность реакций. Физиологическое значение. Синтез жирных кислот протекает в цитоплазме клетки. В митохондриях в основном происходит удлинение существующих цепей жирных кислот.
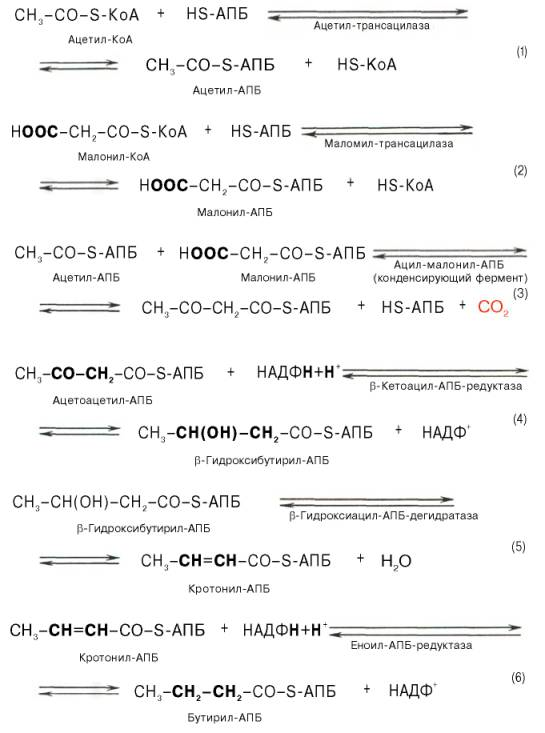
Далее цикл реакций повторяется.
66. Биосинтез триглицеридов, последовательность реакций. Физиологическое значение. В почках, а также в стенке кишечника, где активность фермента глицеролкиназы высока, глицерин фосфорилируется за счет АТФ с образованием глицерол-3-фосфата.
В жировой ткани и мышцах вследствие очень низкой активности глицеролкиназы образование глицерол-3-фосфата в основном связано с процессами гликолиза и гликогенолиза. Образовавшийся глицерол-3-фосфат последовательно ацилируется двумя молекулами КоА-производного жирной кислоты(т.е. «активными» формами жирной кислоты – ацил-КоА). В результате образуется фосфатидная кислота . Далее фосфатидная кислота гидролизуется фосфатидат-фосфогидро-лазой до 1,2-диглицерида. Затем 1,2-диглицерид ацилируется третьей молекулой ацил-КоА и превращается в триглицерид (триацилглицерол). Эта реакция катализируется диацилглицерол-ацилтрансферазой.
67.Биосинтез глицерофосфолипидов. Роль цитидинтрифосфорной кислоты. Биосинтез фосфолипидов интенсивно происходит в печени, стенке кишечника, семенниках, яичниках, молочной железе и других тканях. Наиболее важные фосфолипиды синтезируются главным образом в эндоплазма-тической сети клетки.
Центральную роль в биосинтезе фосфолипидов играют 1,2-диглицериды (в синтезе фосфатидилхолинов и фосфатидилэтаноламинов), фосфатидная кислота (в синтезе фосфатидилинозитов) и сфингозин (в синтезе сфин-гомиелинов). Цитидинтрифосфат (ЦТФ) участвует в синтезе практически всех фосфолипидов. В качестве примера рассмотрим синтез отдельных представителей фосфолипидов.
Цитидинтрифосфат — высокоэнергетичная молекула сходная с аденозинтрифосфатом (АТФ), но ее роль в организме более специфична. Она используется как источник энергии и как кофермент в метаболических реакциях, таких как синтез глицерофосфолипидов и гликозилирование белков. Цитидинтрифосфат участвует в синтезе практически всех фосфолпидов.
68.Биосинтез холестерина, последовательность реакций до образования мевалоновой кислоты, представление о дальнейших этапах. 3 основные стадии: I – превращение активного ацетата в мевалоновую кислоту, II – образование сквалена из мевалоновой кислоты, III – циклизация сквалена в холестерин. Рассмотрим стадию превращения активного ацетата в мевалоновую кислоту. Начальным этапом синтеза мевалоновой кислоты из ацетил-КоА является образование ацетоацетил-КоА посредством обратимой тиолазной реакции.
Затем при последующей конденсации ацетоацетил-КоА с 3-й молекулой ацетил-КоА при участии гидроксиметилглутарил-КоА-синтазы (ГМГ-КоА-синтаза) образуется β-гидрокси-β-метилглутарил-КоА. Далее β-гидрокси-β-метилглутарил-КоА под действием регуляторно-го фермента НАДФ-зависимой гидроксиметилглутарил-КоА-редуктазы (ГМГ-КоА-редуктаза) в результате восстановления одной из карбоксильных групп и отщепления HS-KoA превращается в мевалоновую кислоту.
69.Липопротеиды, холестерин, их связь с развитием атеросклероза. Атеросклероз») — хроническое заболевание артерий эластического и мышечно-эластического типа, возникающее вследствие нарушения липидного обмена и сопровождающееся отложением холестерина и некоторых фракций липопротеидов в интиме сосудов. Отложения формируются в виде атероматозных бляшек. Последующее разрастание в них соединительной ткани (склероз), и кальциноз стенки сосуда приводят к деформации и сужению просвета вплоть до облитерации (закупорки). теория липопротеидной инфильтрации — первично накопление липопротеидов в сосудистой стенке.
70.Регуляция липидного обмена. Роль печени в обменен липидов. Обмен липидов регулируется ЦНС. Кора большого мозга оказывает трофическое влияние на жировую ткань либо через нижележащие отделы ЦНС – симпатическую и парасимпатическую системы, либо через эндокринные железы. Адреналин и норадреналин увеличивают скорость липолиза в жировой ткани; в результате усиливается мобилизация жирных кислот из жировых депо. Не подлежит сомнению, что секрет передней доли гипофиза, в частности соматотропный гормон, оказывает влияние на липидный обмен. Гипофункция железы приводит к отложению жира в организме, наступает гипофизарное ожирение. Напротив, повышенная продукция СТГ стимулирует липолиз, и содержание жирных кислот в плазме крови увеличивается.
71-80. Значение ферментов. Общая характеристика ферментативных реакций. Ферменты – это обширный класс белковоспецифических молекул, катализирующие многие реакции в организме, их роль очень велика. Есть ферменты простые, а есть сложные. Они состоят из белковой части (апофермент) и небелковой части – кофактора, который делится на кофермент – где связь рыхлая – витамины и простерическую группу – связь прочная - ФАД, ФМН.
Структура фермента: 1) активный цент – формируется на уровне третичной структуры, в его образовании участвуют 10-15 а\к. а) якорная или контактная площадка, которая обеспечивает сродство фермента к субстрату, участвует в формировании S-E комплекса б) каталитические участки 2) аллостерический участок необходим для присоединения низкомолекулярных соединений (гормонов), эффекторов, в итоге активация или ингибирования активного центра.
Схема ферментативной реакции: E + S ES ES1 EP E + P
Активность фермента определяется по убыли субстрата или по нарастанию продукта. Методы определения активности: оптические – основаны на изменении спектра поглощения, спектрофолометрические, колориметрические, флюрореметрические методы.
1 моль субстрата / мл жидкости крови / час сек мин МЕ в стандартных условиях при t = 250С.
За единицу активности фермента принимается такое количество энергии, которое катализирует превращение 1 мкмоль субстрата в 1 минуту при 25 С. Удельная активность – число единиц ферментативной активности в расчете на 1 мг белка. Молярная активность – указывает сколько молекул субстрата превращается 1 молекулой фермента в 1 секунду.
Механизмы образования ES комплекса: 1) теория жесткой матрицы, в этом случае фермент подходит к субстрату как ключ к замку 2) теория Кошланда или индуцированного соответствия – при связывании Е с S, аллостерические участки фермента изменяют пространственную структуру субстрата, после чего они подходят друг к другу как ключ к замку.
Любая химическая реакция может идти тогда, когда большинство молекул будут обладать энергией достаточной для преодоления энергетического барьера. Энергетический барьер - это количество энергии, которое необходимо молекуле для вступления в химическую реакцию. Чтобы преодолеть Е барьер молекулы должны быть активированы либо путем нагревания, либо путем введения катализатора.
Энергия активации – это энергия, необходимая для превращения всех молекул одного моля субстрата в активное состояние при данной температуре. Фермент снижает энергию активации, увеличивает количество столкновений, делает субстраты более чувствительными к ферментам, таким образом увеличивается число реагирующих молекул путем снижения энергетического барьера.
Факторы, влияющие на скорость ферментативных реакций: 1) температура – скорость ферментативной реакции максимальна при t = 370С, разумные пределы протекания реакции от 25 до 450С – при этом скорость реакции снижается в 2 раза, если температура больше или меньше на 10 градусов - реакция не идет, например происходит денатурация при 470С. 2) рН – оптимум рН для большинства ферментов 7,3 – 7,4. но есть ферменты, которые имеют оптимум рН в кислой среде – пепсин 1,5-2.5, в щелочной среде - щелочная фосфотаза 10-12, трипсин 3) концентрация фермента – чем больше концентрация фермента, тем реакция протекает быстрее 4) концентрация субстрата – концентрация субстрата, при которой скорость реакции равна половине мах, то это соответствует константе Михаэлиса (точка В). Когда фермент насытился субстратом, скорость мах и уже не зависит от концентрации субстрата (точка С). а точка А – V реакции прямопропорционально зависит от концентрации субстрата.
Специфичность действия ферментов: 1) абсолютная субстратная специфичность – 1 фермент катализирует превращение 1 единственного фермента (оргиназа и уреаза) 2) относительная субстратная специфичность – цитохром Р450 осуществляет гидроксилирование различных субстатов 3) абсолютная групповая специфичность – фермент катализируеи превращение сходной группы субстратов - фермент алкагольдегидрогеназа окисляет этанол и другие спирты 4) относительная групповая специфичность – расщепление пептидной связи, которая образована разными а/к (трипсин между лизином и аргинином).
Изоферменты – это ферменты, которые катализируют одну и туже реакцию, но в различных тканях. Например, ЛДГ катализирует превращение лактата в ПВК, но эта реакция обратима. ЛДГ1 и 2 находятся в сердечной мышце и катализирует эту реакцию в сторону ПВК, а ЛДГ 4 и 5 мышечной ткани катализируют в сторону образования лактата. ЛДГ состоит из Н и М субъединиц: ЛДГ 1 и 2 Н3М, а ЛДГ 4 и 5 МН3. Креатинкиназа – ММ мышечный тип, МВ сердечный тип, ВВ мозговой тип.
Определение активности ферментов с диагностической целью: 1) активность ЛДГ 1 и 2 увеличивается при инфаркте миокарда, а ЛДГ 4 и 5 при миопатиях 2) АлАТ при гепатите, АсАТ при инфаркте миокарда 3) глюкозо6фосфатдегидрогеназа – гемолитическая анемия, дефицит по этому ферменту; окислительная ветвь не работает. Не образуется НАДФН, глутатион, нарушается целостность эритроцитов 4) креатинкиназа – инфаркт миокарда.
В роли кофактора могут выступать витамины. Например, кофактором АлАТ и АсАТ является витамин В6. витамин В1 –входит в состав мультиферментного комплекса, таким образом участвует в реакции окислительного декарбоксилирования ПВК и альфакетоглутарата. Витамин РР входит в состав НАД – никотинамидалениндинуклеотида, а витамин В2 в состав ФМН – флавин6мононуклеотида.
Регуляция действия ферментов: 1) частичный протеолиз – пепсиноген в пепсин под действием HCl, трипсиноген в трипсин под действием энтерокиназы, химотрипсиноген в химотрипсин под действием трипсина 2) ковалентная модификация – фосфорилирование (присоединение остатка фосфорной кислоты) и дефосфорилирование – пример – 2 фосфорилаза Б не активная + 4 АТФ 1 фосфорилаза А – Рн + 4 АДФ. И может быть все наоборот. Гликогенсинтетаза активная + АТФ гликогенсинтетаза – Рн не активная + АДФ. Адреналин повышает уровень глюкозы в крови и активируется фосфорилаза и расщепляется гликоген.
Активаторы ферментов: ионы Ме с 19 по 30 в системе Менделеева, восстановленные формы соединений НАДН2 ФАДН2, аллостерические активаторы, гормоны – адреналин, инсулин.
Ингибирование ферментов: 1) обратимое: а) конкурентное – когда ингибитор похож на субстрат (аллопуринол) б) не конкурентное – аллостерическое (ретроингибирование) и уменьшение доли субстрата
2) необратимое: а) специфическая – СО на цитохромы б) не специфическая – денатурация при t0С.
Классификация ферментов 1961 год – 5 международный конгресс в Москве: 1) оксидоредуктазы (имеют 5 подклассов) в основе ОВР; 2) трансферазы –перенос амино и метильной групп; 3) гидролазы – все ферменты пищеварительного тракта; расщепление с участием воды; 4) лиазы – расщепление связей без участия воды; 5) изомеразы – превращение глюкозо6фосфат в фруктозо6фосфат - реакции изомеризации; 6) лигазы (синтетазы) – синтез органических веществ с затратой энергии распада АТФ.
81. Энергетический обмен, катаболизм, источники восстановленных эквивалентов. Совокупность окислительных реакций, происходящих в живых организмах и обеспечивающих их энергией и метаболитами, необходимыми для осуществления процессов жизнедеятельности, называется биологическим окислением. Функции биологического окисления: 1) энергетический обмен, поддержание t тела, мышечная активность, осмотическая работа, транспорт, биосинтез 2) окисление ксенобиотиков 3) окисление токсических продуктов обмена 4) синтез ключевых метаболитов. Основными источниками энергии для организма являются белки, липиды и углеводы, поступающие с пищей. Три стадии катаболизма: 1) специфическое превращение в мономеры – аминокислоты, моносахариды, глицерин, жирные кислоты. 2) образование унифицированных продуктов – ПВК и АцКоА (моносахариды через ПВК). 3) АцКоА в ЦТК образуется СО2, вода; 3НАДН, которые в дых цепи дают воду и 3 АТФ; ФАД Н2, который в дых цепи дает воду и 2 АТФ. Источники восстановленных эквивалентов это ЦТК, все окислительно-восстановительные реакции, бета-окисление жирных кислот. В дых цепь поступает 3НАДН и ФАДН2, они образуются в следующих реакциях: НАДФН+НАДНАДФ+НАДН (трансдегидрогеназа).
82.Митохондриальная цепь окисления водорода. трансмембранный электрохимический потенциал. Перенос 2х протонов из матрикса в межмембранное пространство сопряжен с образованием градиента концентраций протонов водорода (дельта МюН). Именно в этом месте возникает пункт сопряжения, окисления и фосфорилирования. Трансмембранный электрохимический потенциал – это разница протонов между матриксом и наружной частью. Образуется АТФ (АДФ+Фн) путем фосфорилирования с использованием энергии окисления водорода.
83. НАД-зависимые дегидрогеназы – это сложные ферменты, относящиеся к классу оксидоредуктаз и состоящие из белковой и небелковой части. Небелковая часть представлена коферментами НАД или НАДФ. НАД – никотинамидадениндинуклеотид, в его структуре два мононуклеотида, соединенные фосфоэфирной связью. В состав одного мононуклеотида входит амид никотиновой кислоты (витамин ниацин), рибоза и остаток фосфорной кислоты. Второй мононуклеотид представлен аденином, Д-рибозой и также остатком фосфорной кислоты. НАД-зависимые дегидрогеназы акцептируют от субстрата два атома водорода, первый присоединяется к НАД с образованием НАДН, второй выделяется в виде протона. Изоцитрат под действием изоцитратдегидрогеназы образуется альфа-кетоглуторат СО2 НАДН+Н+. Источники НАДН: изоцитратдегидрогеназа, малатдегидрогеназа, мультиферментный комплекс окислительного декарбоксилирования альфа-кетоглутората, бета-окисление жирных кислот.
84. Флавиновые ферменты – это сложные ферменты, состоящие из белковой и небелковой части, небелковой частью представлена простерическая группа ФМН – флавинмононуклеотид или ФАД – флавинадениндинуклеотид. ФМН состоит из витамина В2, пятиатомного спирта ретибола, остатка фосфорной кислоты; в структуре ФАД два мононуклеотида, соединенных фосфоэфирной связью. В состав одного мононуклеотида входит витамин В2, пятиатомный спирт ретибол, остаток фосфорной кислоты. Второй мононуклеотид представлен АМФ – Аденин, рибоза, остаток фосфорной кислоты. Источники ФАДН2 – сукцинатдегидрогеназа и бета-окисление жирных кислот.
85. Дыхательная цепь, железо-серопротеины, цитохромы. Железо-серопротеины относят к негемовым железопротеинам. Известно три вида FeS-белков: 1) один атом железа тетраэдрически связан с сульфгидрильными группами четырех остатков цистеина; 2) (Fe2S2) содержит 2 атома железа и 2 неорганических сульфида, присоединенных к четырем остаткам цистеина; 3) (Fе4S4) содержит четыре атома железа, четыре сульфгидридные группы и четыре остатка цистеина. Атом железа в этих комплексах может находиться в восстановленном (Fe++) и окисленном (Fe+++) состояниях. НАДН-дегидрогеназа содержит второй и третий типы железо-серопротеинов. Цитохромы – это ферментные гемопротеины, транспортирующие только электроны. В качестве простетической группы они содержат гем. В дых цепи располагаются 5 цитохромов, отличающихся по строению простетических групп и имеющих разные спектры поглощения. В цитохроме b гем нековалентно связан с белковой частью, в то время как в цитохромах с и с1 – связь с белковой частью ковалентная. Цитохромы а и а3 имеют иную простетическую группу, называемую гемом-а. Она отличается от простетической группы цитохромов с и с1 наличием формильной группы вместо одной из метильных групп и углеводородной цепью вместо одного из остатков винила. В составе цитохромов а и а3 находятся два атома меди. Простетической группой цитохромов в, с1 и с служит протопорферин 1Х. Цитохром с имеет ковалентно связанный гем и выполняет челночные функции – передает электроны цитохрома с1 к цитохромоксидазе.
86. образование макроэргических связей в дыхательной цепи. Коэффициент Р/О. Разобщение дыхания и фосфорилирования в дыхательной цепи. Коэффициент Р/О – это количество АТФ, которое образовалось в дых цепи. Р/О может быть равно 3 или 2 АТФ. Три АТФ образуется при участии НАДН, две АТФ при участии ФАДН2.
В окислительном фосфорилировании не образуется дельта МюН, т.к. есть вещества, которые принимают протоны на себя. В окислительном фосфорилировании не происходит образования АТФ и энергия выделяется в виде тепла. Это такие вещества как динитрофенилгидрозин или ДНФГ, пестициды, гербициды, алкоголь.
87. Окислительное субстратное фосфорилирование в процессе биологического окисления. Образование АТФ в процессе метаболизма идет двумя путями – окислительного и субстратного фосфорилирования. Основными источниками поставляющими энергию являются: 1) дых цепь 2) ЦТК 3) гликолиз. Возникновение макроэргической связи в момент окисления субстрата с дальнейшей активацией неорганического фосфата и его переносом на АДФ с образованием АТФ называют субстратным фосфорилированием. В данном случае окисление субстрата связано с фосфорилированием АДФ. Примерами реакций субстратного фосфорилирования являются две реакции гликолиза – окисление 3-фосфоглицеринового альдегида в 1,3-дифосфоглицериновую кислоту, и окисление 2-фосфоглицериновой кислоты в 2-фосфоэнолпировиноградную кислоту; а также одна реакция ЦТК - окисление сукцинил-КоА в янтарную кислоту. Посредством реакций субстратного фосфорилирования образуется небольшое количество энергии. Основная масса АТФ образуется путем окислительного фосфорилирования. В процессе окислительного фосфорилирования окисляемый субстрат участия не принимает, а активирование неорганического фосфата сопряжено с переносом электронов и протонов водорода с коферментов дегидрогеназ (принимающих участие в окислении субстрата) к молекулярному кислороду. Сопряжение окисления с фосфорилированием АДФ и последующим образованием АТФ называют окислительным фосфорилированием. Процессы сопряжения окисления и фосфорилирования идут в дых цепи.
88. Образование СО2 в процессе биологического окисления. СО2 в организме образуется двумя путями – путем прямого и окислительного декарбоксилирования. Основная масса СО2 образуется в ЦТК. Первая молекула СО2 образуется путем прямого декарбоксилирования изоцитрата, при этом изоцитратдегидрогеназа обладает декарбоксилирующим эффектом. Вторая молекула СО2 путем окислительного декарбоксилирования альфа-кетоглутората. Одна молекула СО2 образуется в результате окислительного декарбоксилирования ПВК. Человек за сутки выделяет около 500 мл СО2.
89. Виды декарбоксилирования в ЦТК. В ЦТК есть только два типа декарбоксилирования – прямое и окислительное. 1) Прямое декарбоксилирование изоцитрата под действием изоцитратдегидрогеназы, которая обладает декарбоксилирующим эффектом, превращается в альфа-кетоглуторат и НАДН, который является источником водорода для дыхательной цепи, окисление которого приводит к образованию 3х АТФ и воды. Кроме того в этой реакции образуется СО2. 2) Окислительное декарбоксилирование альфа-кетоглутората происходит под действием альфа-кетоглуторатдегидрогеназного комплекса, который включает три фермента и пять кофакторов – ТДФНSКоА, НАД, ФАД, липоевая кислота. Продуктом реакции является образование макроэргического соединения – сукцинил-КоА. В результате этой реакции образуется еще одна молекула восстановительного эквивалента НАДН и СО2.
90. Микросомальное окисление также как митохондриальное, происходит в митохондриях. Но в микросомальном окислении кислород используется с пластической целью, он включается в субстрат. Примерами микросомального окисления являются – окисления ксенобиотиков, синтез стероидных гормонов, активных форм витаминов, жирных кислот, холестерина. Источником водорода в микросомальном окислении служит НАДФН. При микросомальном окислении энергии не образуется.
91. Пути использования, токсичность кислорода, механизмы защиты. 1) митохондриальные окисления – образование воды – оксидазный способ. 2) в микросомальным окислением с пластической целью – оксигеназный способ. 3) для образования Н2О2 – пероксидазный способ. Токсичность кислорода связано с тем, что в ходе окислительных реакций кислород может принимать дополнительный электрон и превращаться в супероксидный радикал (анион). Присоединение двух дополнительных электронов к супероксидному аниону (О2-) ведет к образованию пероксидных анионов (О2-2). О2-+е+2Н+Н2О2; О2-е+О2. В результате реакции дисмутации, катализируемой супероксиддисмутазой (СОД), образуется перикись водорода: О2-+О2-+2Н+Н2О2+О2. Такие формы кислорода имеют высокую химическую активность, реагируют со многими веществами в организме, в том числе с нуклеиновыми кислотами, белками, липидами, оказывая повреждающее действие. Активные формы кислорода запускают цепные реакции перекисного окисления липидов. В процессе ПОЛ образуются органические перекиси. ПОЛ приводит к повреждающему воздействию мембран клеток. Активные формы кислорода образуются в организме и в реакциях неферментативного окисления ряда веществ. В связи с тем, что образование активных форм кислорода ведет к повреждающему эффекту, можно говорить о токсичности кислорода и механизмах защиты. Имеется два способа защиты: 1) ферментативные пути – активируют пероксидаза и каталаза. Пероксиды выступают в роли акцепторов водорода, донорами которых являются органические субстраты. 2Н2О22Н2О+О2 (катализирует каталаза). 2) неферментативные пути – используются препараты-ловушки активных форм О2 – витамин Е, К, различные хиноны.
