
- •Глава 4 Строение атома. Химическая связь.
- •4.1. Периодический закон д.И.Менделеева.
- •4.2. Строение атома
- •4.2.1. Электронная структура атома
- •Максимальное число электронов на квантовых уровнях и подуровнях
- •2Валентность I
- •2 Валентность в основном
- •4.2.2. Основное и возбужденное состояние атома
- •2Валентность II
- •2Валентность I
- •2Валентность II
- •2Валентность IV
- •1 P Валентность II
- •4.2.3. Строение атома и химические свойства элементов
- •Увеличение энергии сродства к электрону
- •4.3. Периодическая система химических элементов д.И. Менделеева
- •Основной амфотерный кислотный
- •4.4.1. Водородная связь.
- •4.5. Описание строения некоторых молекул
- •Метод валентных связей (вс)
- •4.6. Представление о гибридизации атомных орбиталей.
- •4.7. Кристаллические решетки твердых тел.
- •4.8. Вопросы для самоконтроля.
- •4.9. Тесты для контроля знаний по теме «Строение атома» Вариант № 1
- •Вариант № 2
- •1) IV группа, главная подгруппа, 2) VI группа, главная подгруппа, 3) VI группа, побочная подгруппа, 4) IV группа, побочная подгруппа, 5) V группа, главная подгруппа.
- •Вариант № 3
- •4.10. Вопросы и упражнения для самоподготовки по теме «Строение атома. Химическая связь».
- •1) BaCl2, 2) kCl, 4) h2, 8) o2, 16) h2o, 32) so3?
- •1) H2so4, hClO4, 2) f2o, co2, 3) so2, h2so4, 4) co2, so3?
- •1) Этан, 2) этен, 3) этин, 4) бензол.
- •1) Sp, 2) sp2, 3) sp3, 4) атомные орбитали не гибридизованы?
Глава 4 Строение атома. Химическая связь.
4.1. Периодический закон д.И.Менделеева.
В 1869 году Д.И. Менделеев формулирует открытый им периодический закон:
«свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величин атомных весов элементов».
В настоящее время вместо понятия «атомный вес» используется понятие «атомная масса».
Дальнейшее развитие естествознания, особенно учения о строении атома, показало, что индивидуальность химического элемента определяется зарядом его ядра, а химические свойства элементов и их соединений, периодическая повторяемость их у разных элементов определяютсястроением электронной оболочки атома, которая, в свою очередь, зависит от заряда ядра атома.
Современная формулировка периодического закона Д.И. Менделеева гласит:
«Свойства химических элементов, а также свойства и форма образуемых ими соединений, находятся в периодической зависимости от заряда их атомов и определяются периодически повторяющимися однотипными электронными конфигурациями их атомов».
Таким образом, для того, чтобы понять причину периодичности свойств соединений химических элементов, надо обратиться к изучению строения атома.
4.2. Строение атома
Атом – это наименьшая частица химического элемента, входящая в состав простых и сложных веществ.
По современным представлениям атомэто электронейтральная частица, состоящая из положительно заряженного ядра и компенсирующих его заряд электронов.
В свою очередь ядро атома состоит из протонов, нейтронов (общее название нуклоны)и большого числа других частиц. Электроны атома образуют его электронную оболочку, строение которой определяет многие химические свойства элемента.
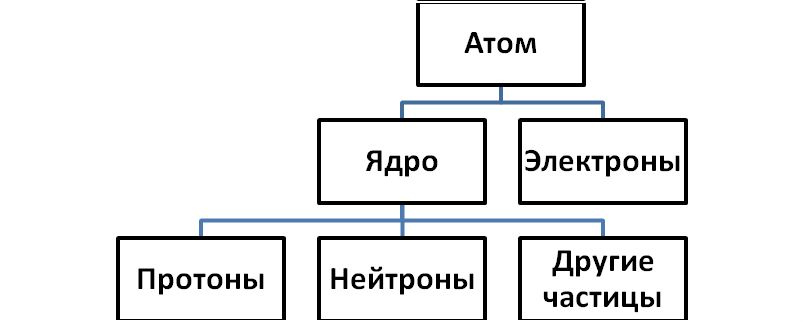
Рис. 4.1. Схема строения атома элемента.
Протон ![]() положительно
заряженная микрочастица с зарядом
+1,6·1019К, условно принятым за единицу
положительного зарядаqр= +1. Масса протона близка к 1 а.е.м. Общее
число протоновNp,
входящих в состав ядра, определяет общий
заряд ядра атома и его порядковый номер
в Периодической системе элементов Д.И.
Менделеева.
положительно
заряженная микрочастица с зарядом
+1,6·1019К, условно принятым за единицу
положительного зарядаqр= +1. Масса протона близка к 1 а.е.м. Общее
число протоновNp,
входящих в состав ядра, определяет общий
заряд ядра атома и его порядковый номер
в Периодической системе элементов Д.И.
Менделеева.
Нейтрон
![]() электронейтральная
микрочастица входящая в состав ядра
атома. Его масса, как и масса протона,
близка к 1 а.е.м.
электронейтральная
микрочастица входящая в состав ядра
атома. Его масса, как и масса протона,
близка к 1 а.е.м.
Нуклоны (от лат. nucleus – ядро, зерно, косточка) – собирательное названиепротонов и нейтронов– основных частиц, образующих атомные ядра.
Электронēотрицательно заряженная микрочастица, входящая в состав атома и несущая наименьший электрический заряд1,61019Кл. Для удобства величина этого «элементарного» заряда принята за единицуqe=1. Так как атом в целом электронейтрален, то число электронов равно заряду ядра этого атома.
Например, заряд ядра атома натрия 11Naравен +11. Вокруг ядра размещается 11 электронов с общим отрицательным зарядом –11.
Основная масса атома (m)сосредоточена в его ядре, так как масса
электронов мала и не вносит существенного
вклада в массу всего атома. Масса
электрона составляет лишь![]() от массы протона или нейтрона.
от массы протона или нейтрона.
Масса атома, таким образом, фактически складывается исходя из масс всех протонов (Np) и нейтронов (Nn) и характеризуетсямассовым числом (А).
Массовое число атома какого-либо элемента (А) численно равно сумме масс общего числа протонов (Np) и общего числа нейтронов (Nn):
A = Np + Nn.
Например, у атома калия
![]() (порядковый номер в таблице Менделеева
19, массовое число равно 39) в ядре находится
19 протонов и 20 нейтронов, у атома бария
(порядковый номер в таблице Менделеева
19, массовое число равно 39) в ядре находится
19 протонов и 20 нейтронов, у атома бария![]() (порядковый номер 56, массовое число 137)
в ядре 56 протонов и 71 нейтрон.
(порядковый номер 56, массовое число 137)
в ядре 56 протонов и 71 нейтрон.
