
- •Глава 4 Строение атома. Химическая связь.
- •4.1. Периодический закон д.И.Менделеева.
- •4.2. Строение атома
- •4.2.1. Электронная структура атома
- •Максимальное число электронов на квантовых уровнях и подуровнях
- •2Валентность I
- •2 Валентность в основном
- •4.2.2. Основное и возбужденное состояние атома
- •2Валентность II
- •2Валентность I
- •2Валентность II
- •2Валентность IV
- •1 P Валентность II
- •4.2.3. Строение атома и химические свойства элементов
- •Увеличение энергии сродства к электрону
- •4.3. Периодическая система химических элементов д.И. Менделеева
- •Основной амфотерный кислотный
- •4.4.1. Водородная связь.
- •4.5. Описание строения некоторых молекул
- •Метод валентных связей (вс)
- •4.6. Представление о гибридизации атомных орбиталей.
- •4.7. Кристаллические решетки твердых тел.
- •4.8. Вопросы для самоконтроля.
- •4.9. Тесты для контроля знаний по теме «Строение атома» Вариант № 1
- •Вариант № 2
- •1) IV группа, главная подгруппа, 2) VI группа, главная подгруппа, 3) VI группа, побочная подгруппа, 4) IV группа, побочная подгруппа, 5) V группа, главная подгруппа.
- •Вариант № 3
- •4.10. Вопросы и упражнения для самоподготовки по теме «Строение атома. Химическая связь».
- •1) BaCl2, 2) kCl, 4) h2, 8) o2, 16) h2o, 32) so3?
- •1) H2so4, hClO4, 2) f2o, co2, 3) so2, h2so4, 4) co2, so3?
- •1) Этан, 2) этен, 3) этин, 4) бензол.
- •1) Sp, 2) sp2, 3) sp3, 4) атомные орбитали не гибридизованы?
Максимальное число электронов на квантовых уровнях и подуровнях
|
Энергети-ческий уровень |
Энергети-ческий подуровень |
Возможные значения магнитного квантового числа m |
Число орбиталей на |
Максимальное число электронов на | ||
|
подуровне |
уровне |
подуровне |
уровне | |||
|
K (n=1) |
s (l=0) |
0 |
1 |
1 |
2 |
2 |
|
L (n=2) |
s (l=0) p (l=1) |
0 –1, 0, 1 |
1 3 |
4 |
2 6 |
8 |
|
M (n=3) |
s (l=0) p (l=1) d (l=2) |
0 –1, 0, 1 –2, –1, 0, 1, 2 |
1 3 5 |
9 |
2 6 10 |
18 |
|
N (n=4) |
s (l=0) p (l=1) d (l=2) f (l=3) |
0 –1, 0, 1 –2, –1, 0, 1, 2 –3, –2, –1, 0, 1, 2, 3 |
1 3 5 7 |
16 |
2 6 10 14 |
32 |
Последовательность заполнения электронами орбиталей осуществляется в соответствии с принципом наименьшей энергии.
Согласно прнципу наименьшей энергии электроны заполняют орбитали в порядке повышения их энергии.
Очередность заполнения орбиталей определяется правилом Клечковского: увеличение энергии и, соответственно, заполнение орбиталей происходит в порядке возрастания суммы главного и орбитального квантовых чисел (n + l), а при равной сумме (n + l) – в порядке возрастания главного квантового числа n.
Например, энергия электрона на подуровне 4sменьше, чем на подуровне 3d, так как в первом случае суммаn+l= 4 + 0 = 4 (напомним, что дляs-подуровня значение орбитального квантового числаl = = 0), а во второмn+l= 3 + 2= 5 (dподуровень,l = 2). Поэтому, сначала заполняется подуровень 4s, а затем 3d(см. рис. 4.8).
На подуровнях 3d(n= 3,l= 2) , 4р(n= 4,l= 1) и 5s(n= 5,l= 0) сумма значенийпиlодинаковы и равны 5. В случае равенства значений суммnиl сначала заполняется подуровень с минимальным значениемn, т.е. подуровень 3d.
В соответствии с правилом Клечковского энергии атомных орбиталей возрастает в ряду:
1s < 2s < 2р < 3s < 3р < 4s < 3d < 4р < 5s < 4d < 5p < 6s < 5d
4f< 6p< 7s….
В зависимости от того, какой подуровень в атоме заполняется в последнюю очередь, все химические элементы делятся на 4 электронных семейства: s-, p-, d-, f-элементы.
 4f
4f
4 4d
4p
3d
3 4s
3p
3s
2 2p
2s
1
1s
Уровни Подуровни
Рис. 4.8. Энергия атомных орбиталей.
Элементы, у атомов которых в последнюю очередь заполняется s-подуровень внешнего уровня, называютсяs-элементами. Уs-эле-ментов валентными являютсяs-электроны внешнего энергетического уровня.
У р-элементовпоследним заполняется р-подуровень внешнего уровня. У них валентные электроны расположены наp- иs-под-уровнях внешнего уровня. Уd-элементов в последнюю очередь заполняетсяd-подуровень предвнешнего уровня и валентными являютсяs-электроны внешнего иd-электроны предвнешнего энергетического уровней.
У f-элементовпоследним заполняетсяf-подуровень третьего снаружи энергетического уровня.
Порядок размещения электронов в пределах одного подуровня определяется правилом Гунда:
в пределах подуровня электроны размещаются таким образом, чтобы сумма их спиновых квантовых чисел имела бы максимальное значение по абсолютной величине.
Иными словами, орбитали данного подуровня заполняются сначала по одному электрону с одинаковым значением спинового квантового числа, а затем по второму электрону с противоположным значением.
Например, если в трех квантовых ячейках необходимо распределить 3 электрона, то каждый из них будет располагаться в отдельной ячейке, т.е. занимать отдельную орбиталь:

В этом случае сумма спиновых квантовых чисел максимальна:
∑ms= ½ + ½ + ½ = 3/2.
Эти же 3 электрона не могут быть расположены иначе, так как ∑msбудет меньше, например:
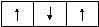
∑ms= ½ – ½ + ½ = ½.
Порядок распределения электронов по энергетическим уровням и подуровням в оболочке атома называется его электронной конфигурацией, или электронной формулой. Составляя электронную конфигурациюномерэнергетического уровня(главное квантовое число) обозначают цифрами 1, 2, 3, 4…, подуровень (орбитальное квантовое число) – буквамиs,p,d,f. Число электронов на подуровне обозначается цифрой, которая записывается вверху у символа подуровня.
Электронная конфигурация атома может быть изображена в виде так называемой электронно-графической формулы. Эта схема размещения электронов в квантовых ячейках, которые являются графическим изображением атомной орбитали. В каждой квантовой ячейке может быть не более двух электронов с различными значениями спиновых квантовых чисел.
Чтобы составить электронную или электронно-графическую формулу любого элемента следует знать:
1. Порядковый номер элемента, т.е. заряд его ядра и соответствующее ему число электронов в атоме.
2. Номер периода, определяющий число энергетических уровней атома.
3. Квантовые числа и связь между ними.
Так, например, атом водорода с порядковым номером 1 имеет 1 электрон. Водород элемент первого периода, поэтому единственный электрон занимает находящуюся на первом энергетическом уровнеs-орбиталь, имеющую наименьшую энергию. Электронная формула атома водорода будет иметь вид:
1Н 1s1.
Электронно-графическая формула водорода будет иметь вид:
1 H
1s
H
1s
Электронная и электронно-графическая формулы атома гелия:
2Не 1s2
2 Не
1s
Не
1s
отражают завершенность электронной оболочки, что обусловливает ее устойчивость. Гелий – благородный газ, характеризующийся высокой химической устойчивостью (инертностью).
Атом лития 3Liимеет 3 электрона, это элементIIпериода, значит, электроны расположены на 2-х энергетических уровнях. Два электрона заполняютsподуровень первого энергетического уровня и 3-й электрон расположен наsподуровне второго энергетического уровня:
3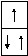 Li
1s22s1
Li
1s22s1
