
- •Глава 4 Строение атома. Химическая связь.
- •4.1. Периодический закон д.И.Менделеева.
- •4.2. Строение атома
- •4.2.1. Электронная структура атома
- •Максимальное число электронов на квантовых уровнях и подуровнях
- •2Валентность I
- •2 Валентность в основном
- •4.2.2. Основное и возбужденное состояние атома
- •2Валентность II
- •2Валентность I
- •2Валентность II
- •2Валентность IV
- •1 P Валентность II
- •4.2.3. Строение атома и химические свойства элементов
- •Увеличение энергии сродства к электрону
- •4.3. Периодическая система химических элементов д.И. Менделеева
- •Основной амфотерный кислотный
- •4.4.1. Водородная связь.
- •4.5. Описание строения некоторых молекул
- •Метод валентных связей (вс)
- •4.6. Представление о гибридизации атомных орбиталей.
- •4.7. Кристаллические решетки твердых тел.
- •4.8. Вопросы для самоконтроля.
- •4.9. Тесты для контроля знаний по теме «Строение атома» Вариант № 1
- •Вариант № 2
- •1) IV группа, главная подгруппа, 2) VI группа, главная подгруппа, 3) VI группа, побочная подгруппа, 4) IV группа, побочная подгруппа, 5) V группа, главная подгруппа.
- •Вариант № 3
- •4.10. Вопросы и упражнения для самоподготовки по теме «Строение атома. Химическая связь».
- •1) BaCl2, 2) kCl, 4) h2, 8) o2, 16) h2o, 32) so3?
- •1) H2so4, hClO4, 2) f2o, co2, 3) so2, h2so4, 4) co2, so3?
- •1) Этан, 2) этен, 3) этин, 4) бензол.
- •1) Sp, 2) sp2, 3) sp3, 4) атомные орбитали не гибридизованы?
4.4.1. Водородная связь.
Атом водорода, соединенный в молекуле вещества с атомом сильно электроотрицательного элемента (F,O,N), способен к образованию еще одной химической связи с другим сильно электроотрицательным атомом этой же (внутримолекулярная) или другой молекулы (межмолекулярная водородная связь).
Например, в молекуле фтороводорода HF атом с большой электроотрицательностью фтор смещает на себя электронное облако, приобретая значительный эффективный отрицательный заряд, а ядро атома водорода (протон) практически лишается электронного облака и приобретает эффективный положительный заряд. Между протоном атома водорода и отрицательно заряженным атомом фтора соседней молекулы возникает электростатическое притяжение, что и приводит к образованию водородной связи (см. рис. 4.12).

 Fδ― Н+δFδ― Н+δ
Fδ― Н+δFδ― Н+δ

H+δ водородная связь между молекулами фтороводорода
|
F–δ
Рис. 4.12. Схема образования водородных связей между молекулами фтороводорода.
Водородные связи, хотя и слабее ковалентныхсвязей, тем не менее играет очень важную роль во внутри- и межмолекулярных взаимодействиях. Наличие водородной связи способствует процессу ассоциации молекул (объединению вдимерыилиполимеры), обусловливающим повышенной вязкость, аномально высокие температуры плавления и кипения таких веществ, каквода(см. рис. 4.13),фтороводород,аммиак.
Атом водорода

 Водородная
связь
Водородная
связь


 Атом
кислорода
Атом
кислорода
Рис. 4.13. Возникновение водородной связи в молекуле воды
Водородная связь, в значительной мере, определяет свойства спиртов, карбоновых кислот, сложных эфиров, белков и некоторых других органических веществ.
4.5. Описание строения некоторых молекул
Для объяснения строение и свойств молекул с ковалентной связью используются два метода: метод валентных связей (ВС)иметод молекулярных орбиталей (ММО). Рассмотрим один из них.
Метод валентных связей (вс)
1. По методу ВС химическая связь между двумя атомами возникает в результате перекрывания атомных орбиталей (АО) с образованием общих электронных пар.
2. Возникающая при этом зона повышенной электронной плотности локализована между двумя атомами. Такая связь является двухцентровой и двухэлектронной.
3. Связь может образоваться только при взаимодействии электронов с различными значениями спиновых квантовых чисел (антипараллельными спинами).
4. Характер перекрывания атомных орбиталей определяют такие параметры химической связи, как энергия связи, длина связи, полярность, валентные углы между связями.
5. Ковалентная связь направлена в сторону максимального перекрывания атомных орбиталей взаимодействующих атомов.
В образовании ковалентной связи могут принимать участие АО как одинаковой, так и различной симметрии.
При перекрывании АО вдоль линии соединения центров атомов образуется -связь(рис. 4.144.16).

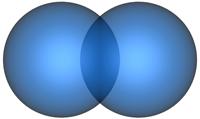

Рис. 4.14. Образование -связи при перекрывании двух s-атомных орбиталей
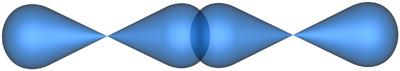

Рис. 4.15. Образование -связи при перекрывании двух p-атомных орбиталей


Рисунки орбиталей с сайта http://w.w.w.hybridation.ru/site/htm
Рис. 4.16. Образование -связи при перекрывании двух d атомных орбиталей
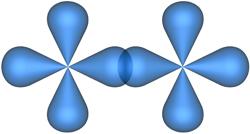
Если при перекрывании атомных орбиталей зона повышенной электронной плотности возникает по обе стороны от линии соединения центров атомов, то образуется -связь(рис. 4.17 и рис. 4.18).
Две зоны повышенной
электронной плотности



Рис. 4.17. Образование -связи при перекрывании двух p-атомных орбиталей.
Две зоны повышенной
электронной плотности


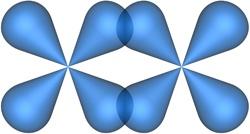
Рис. 4.18. Образование -связи при перекрывании двух d-атомных орбиталей.
Если между двумя атомами в молекуле возникают кратные связи (двойные или тройные), одна из связей будет -связью, т.е образована перекрыванием электронных облаков вдоль оси, соединяющей центры атомов, а все остальные-связями, т.е образованы перекрыванием электронных облаков по обе стороны оси, соединяющей центры атомов.
В молекуле этилена С2Н4между атомами углерода имеется двойная связь СН2=СН2. Одна из них, более прочная, является σ-связью, вторая, менее прочная, является-связью.
В линейной молекуле ацетилена Н- С≡ С-Н (имеются σ-связи между атомами углерода и водорода. Атомы углерода связаны одной σ-связью и двумя π-связями. Следует заметить, что энергия двойной и тройной связей больше, чем энергия одинарной связи, а длина, соответственно, меньше.
