
- •Глава 4 Строение атома. Химическая связь.
- •4.1. Периодический закон д.И.Менделеева.
- •4.2. Строение атома
- •4.2.1. Электронная структура атома
- •Максимальное число электронов на квантовых уровнях и подуровнях
- •2Валентность I
- •2 Валентность в основном
- •4.2.2. Основное и возбужденное состояние атома
- •2Валентность II
- •2Валентность I
- •2Валентность II
- •2Валентность IV
- •1 P Валентность II
- •4.2.3. Строение атома и химические свойства элементов
- •Увеличение энергии сродства к электрону
- •4.3. Периодическая система химических элементов д.И. Менделеева
- •Основной амфотерный кислотный
- •4.4.1. Водородная связь.
- •4.5. Описание строения некоторых молекул
- •Метод валентных связей (вс)
- •4.6. Представление о гибридизации атомных орбиталей.
- •4.7. Кристаллические решетки твердых тел.
- •4.8. Вопросы для самоконтроля.
- •4.9. Тесты для контроля знаний по теме «Строение атома» Вариант № 1
- •Вариант № 2
- •1) IV группа, главная подгруппа, 2) VI группа, главная подгруппа, 3) VI группа, побочная подгруппа, 4) IV группа, побочная подгруппа, 5) V группа, главная подгруппа.
- •Вариант № 3
- •4.10. Вопросы и упражнения для самоподготовки по теме «Строение атома. Химическая связь».
- •1) BaCl2, 2) kCl, 4) h2, 8) o2, 16) h2o, 32) so3?
- •1) H2so4, hClO4, 2) f2o, co2, 3) so2, h2so4, 4) co2, so3?
- •1) Этан, 2) этен, 3) этин, 4) бензол.
- •1) Sp, 2) sp2, 3) sp3, 4) атомные орбитали не гибридизованы?
4.2.1. Электронная структура атома
По своей природе электрон имеет двойственный характер: наряду с корпускулярными свойствамиматериальной частицы он также, подобно фотонам света, имеетволновыесвойства, например, обладает способностью к дифракции.
В настоящее время описание состояния электрона в атоме дается квантовой механикой, изучающей движение и взаимодействие элементарных частиц.
Электрон в атоме не имеет траектории движения. Следует рассматривать, так называемое, электронное облако,характеризующее вероятность нахождения электрона в трехмерном пространстве вокруг ядра.
Область пространства вокруг ядра, в которой нахождение электрона наиболее вероятно, называется орбиталью.
В пределах орбитали заключается ~ 90 % электронного облака. Орбитали имеют различные размеры и форму. Если электрон находится на орбитали меньшего размера, то он сильнее притягивается ядром, чем электрон, занимающий орбиталь большего размера.
Энергия электрона имеет целочисленное значение и может изменяться лишь целыми, точно определенными порциями - квантами энергии.
Энергетическое состояние электрона в атоме характеризуется четырьмя квантовыми числами: главным, орбитальным, магнитными спиновым.
Главное квантовое число n связано с номером энергетического уровня,характеризует общую энергию электрона на данном уровне и его удаленность от ядра.
Главное квантовое число принимает значения от 1 до ∞. Для известных химических элементов, когда атомы находятся в невозбужденном состоянии, главное квантовое число может принимать положительные целочисленные значения от 1 до 7.
Совокупность электронов с одинаковым значением nназывается энергетическим уровнем. Наименьшую энергию имеют электроны первого от ядра энергетического уровня (n= 1). С увеличениемnэнергия электрона и его удаленность от ядра возрастают.
Число заполняемых энергетических уровней в атоме численно равно номеру периода, в котором находится элемент.
Так, все электроны элементов I периода имеют один энергетический уровень с главным квантовым числом равным единице (n= 1). У атомов элементовIIпериода главное квантовое число равно двум (n= 2) и т.д.
Максимальное число электронов на данном энергетическом уровне определяется уравнением:
N= 2n2,
где Nчисло электронов на данном энергетическом уровне,nномер уровня (номер периода, главное квантовое число).
Следовательно, на первом энергетическом уровне может находиться не более 2 электронов, на втором не более 8, на третьем – не более 18, на четвертом не более 32.
Энергетические уровни обозначают буквами.
Числовое значение уровня n1 2 3 4 5 6 7
Буквенное обозначение K L M N O P Q.
Орбитальное (побочное) квантовое число l характеризует различное энергетическое состояние электронов, находящихся на конкретном энергетическом уровне.
Орбитальное (побочное) квантовое число определяет форму электронного облака, т.е. пространственную область наиболее вероятного нахождения электрона. Значение орбитального квантового числа lзависит от значения главного квантового числаn. Оно принимает значения 0, 1, 2, 3… (n–1), т.е. от 0 до (n–1).
Совокупность электронов, характеризующихся одинаковым значением орбитального квантового числа l, называетсяэнергетическим подуровнем. Подуровни обозначают буквами:
Значение орбитального квантового числаl0 1 2 3
Обозначение энергетического подуровняs p d f.
Каждому значению lсоответствует определенный энергетический подуровень и определеннаяформа орбитали.Количество таких подуровней совпадает с номером уровня или со значением главного квантового числаn.
Таким образом, при l= 0, 1, 2, 3 электроны находятся соответственно наs-,p-,d-,f-подуровнях. При данном значении главного квантового числаnнаименьшую энергию имеют электроныs-подуровня, затемp-,d-,f-подуровней. Электроны различных подуровней называютs-,p-,d-,f-электронами или электронами, находящимися наs-,p-,d-,f-атомных орбиталях.
Число энергетических подуровней в уровне не должно быть больше главного квантового число n. Так, первый уровень (n= 1) имеет один подуровень (s), второй уровень (n= 2) – два подуровня (sиp), третий (n= 3) – три (s,p,d), четвертый (n= 4) – четыре (s,p,d,f). В оболочках атомов ныне известных элементов электроны застраивают на каждом уровне не более четырех подуровней.
При l= 0 (s– подуровень) электронное облако имеет сферическую форму.


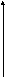
Рис. 4.2. Форма s-орбитали
При l= 1 (р– подуровень) орбиталь имеет форму гантели.


Рис. 4.3. Форма p-орбитали
Орбитали dиfимеют более сложную форму (см. рис. 4.5.).
Магнитное квантовое число m характризует пространственную ориентацию орбиталей данного подуровня относительно внешнего магнитного поля.
Магнитное квантовое число mможет принимать значения любых целых чисел от –lдо +lвключая 0, т.е. всего 2l+ 1 значение. Таким образом, (2l+ 1) число атомных орбиталей, на которых могут находиться электроны данного подуровня.
Например, для s-подуровняl= 0 и потомуmимеет единственное значение:m= 0. Таким образом, наs-подуровне имеется единственнаяs-орбиталь, которая имеет форму сферы, расположенной симметрично относительно ядра атома.
р-орбиталь(«гантель») в магнитном поле может ориентироваться в пространстве в трех различных положениях, т.е. приl= 1, может принимать три значения: +1, 0, –1. Поэтомуp– атомные орбитали ориентированы в пространстве по трем координатным осям (х,у,z).
Соответственно, р-орбитали обозначаютсярх,ру ирz. (рис. 4.4).
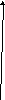
![]()




py px pz
Рис. 4.4. Ориентация в пространстве px, py и pz орбиталей.
d-подуровень(l= 2) имеет пять значений магнитного квантового числаm: –2, –1, 0, 1, 2 и, следовательно, пятьd-орбиталей, которые ориентированы по пяти разным направлениям.

![]()




Рис. 4.5. Возможные формы d-орбиталей.
f-подуровень (l= 3) имеет семь значений магнитного квантового числа (ml: –3, –2, –1, 0, 1, 2, 3,) т.е. семь различныхf-орбиталей. Число ориентацийf-орбиталей равно семи.
У словно
атомные орбитали (АО) обозначают в виде
квадрата (квантовой ячейки) Error: Reference source not found
словно
атомные орбитали (АО) обозначают в виде
квадрата (квантовой ячейки) Error: Reference source not found
С оответственно,
дляs-подуровня имеется
одна АО Error: Reference source not found
оответственно,
дляs-подуровня имеется
одна АО Error: Reference source not found
д ляp‑подуровня – три
АО
ляp‑подуровня – три
АО
д ляd-подуровня – пять АО
Error: Reference source not found,
ляd-подуровня – пять АО
Error: Reference source not found,

для f‑подуровня – семь АО
Таким образом, электроны в атоме располагаются по энергетическим уровням, удаленность этих уровней от ядра характеризуется значением главного квантового числа n. Энергетические уровни состоят из подуровней, число подуровней для каждого уровня не превышает значениеn. Подуровни, в свою очередь, состоят из орбиталей, форма которых определяется значением орбитального квантового числаl, а количество задается числом значений магнитного квантового числаm.
Если рассматривать электрон как частицу, то кроме движения вокруг ядра, он вращается вокруг собственной оси. Это движение получило название «спин».
Спиновое квантовое число msхарактеризует два возможных направления вращения электрона вокруг собственной оси (по часовой стрелке или против).
Спиновое квантовое число ms принимает два значения:
ms= +1/2 и ms= –1/2.
Электроны, характеризующиеся спиновым квантовым числом
ms = +1/2, принято обозначать стрелкой, направленной вверх:

Электроны, характеризующиеся спиновым квантовым числом
ms= –1/2, обозначают стрелкой, направленной вниз:

неспаренный электрон
Электроны с различными значениями спиновых квантовых чисел обычно обозначаются противоположно направленными стрелками:

спаренные электроны
Если на орбитали находится один электрон, то он называется неспаренным,а если два – то этоспаренные электроны.
Четыре квантовых числа n, l, m, ms полностью характеризуют энергетическое состояние электрона в атоме.
Рассматривая строение электронной оболочки многоэлектронных атомов различных элементов, необходимо учитывать три основных положения:
принцип Паули,
принцип наименьшей энергии,
правило Гунда.
Согласно принципу Паули в атоме не может быть двух электронов с одинаковыми значениями всех четырех квантовых чисел.
Принцип Паули определяет максимальное число электронов на одной орбитали, уровне и подуровне. Так как АО характеризуется тремя квантовыми числами n,l,m, то электроны данной орбитали могут различаться только спиновым квантовым числомms. Но спиновое квантовое числоms может иметь только два значения +1/2и –1/2. Следовательно, на одной орбитали может находиться не более двух электронов с различными значениями спиновых квантовых чисел.

Рис. 4.6. Максимальная емкость одной орбитали – 2 электрона.
Максимальное число электронов на энергетическом уровне определяется как 2n2, а на подуровне – как 2(2l+ 1). Максимальное число электронов, размещающихся на различных уровнях и подуровнях, приведено в табл. 4.1.
Таблица 4.1.
