
- •Глава 4 Строение атома. Химическая связь.
- •4.1. Периодический закон д.И.Менделеева.
- •4.2. Строение атома
- •4.2.1. Электронная структура атома
- •Максимальное число электронов на квантовых уровнях и подуровнях
- •2Валентность I
- •2 Валентность в основном
- •4.2.2. Основное и возбужденное состояние атома
- •2Валентность II
- •2Валентность I
- •2Валентность II
- •2Валентность IV
- •1 P Валентность II
- •4.2.3. Строение атома и химические свойства элементов
- •Увеличение энергии сродства к электрону
- •4.3. Периодическая система химических элементов д.И. Менделеева
- •Основной амфотерный кислотный
- •4.4.1. Водородная связь.
- •4.5. Описание строения некоторых молекул
- •Метод валентных связей (вс)
- •4.6. Представление о гибридизации атомных орбиталей.
- •4.7. Кристаллические решетки твердых тел.
- •4.8. Вопросы для самоконтроля.
- •4.9. Тесты для контроля знаний по теме «Строение атома» Вариант № 1
- •Вариант № 2
- •1) IV группа, главная подгруппа, 2) VI группа, главная подгруппа, 3) VI группа, побочная подгруппа, 4) IV группа, побочная подгруппа, 5) V группа, главная подгруппа.
- •Вариант № 3
- •4.10. Вопросы и упражнения для самоподготовки по теме «Строение атома. Химическая связь».
- •1) BaCl2, 2) kCl, 4) h2, 8) o2, 16) h2o, 32) so3?
- •1) H2so4, hClO4, 2) f2o, co2, 3) so2, h2so4, 4) co2, so3?
- •1) Этан, 2) этен, 3) этин, 4) бензол.
- •1) Sp, 2) sp2, 3) sp3, 4) атомные орбитали не гибридизованы?
4.3. Периодическая система химических элементов д.И. Менделеева
Периодическая система, как графическое изображение Периодического закона Д.И. Менделеева,состоит из периодов и групп. Все периоды начинаются сs-элемента и заканчиваютсяp-элементом первого периодаs-элементом). Малые периоды содержат 2 и 8 элементов, большие периоды – 18 и 32 элемента, седьмой период остается незавершенным. Число элементов в периодах 2-8-18-32 соответствует максимально возможному числу электронов на соответствующих энергетических уровнях: на первом – 2, на втором – 8, на третьем – 18, на четвертом – 32 электрона. В периодах слева направо ослабевают металлические и усиливаются неметаллические свойства и кислотный характер соединений.
По вертикали в таблице расположено 8 групп, в которых один под другим размещены элементы, имеющие сходные свойства.
Атомы элементов одной и той же группы имеют одинаковое число валентных электронов.
Количество валентных электронов в оболочке атома, как правило, равно номеру группы, в которой находится элемент, и определяет высшую степень окисления элемента. Группы делятся на подгруппы –главные и побочные. Подгруппы включают в себя элементы с аналогичными электронными структурами (элементы-аналоги). В главных (А) подгруппах расположеныs-элементы (I,IIгруппы) иp-элементы (IIIVIIIгрупп).
В атомах элементов главных подгрупп валентные электроны находятся на s- и р-подуровнях внешнего энергетического уровня и общее их число равно номеру группы.
В главных подгруппах при переходе сверху вниз усиливаются металлические свойства, основной характер соединений и их устойчивость в низшей степени окисления. Например, для элементов IVА-группы возможные степени окисления +2 и +4. Для углерода наиболее характерна степень окисления +4, поэтому четырехвалентные соединения углерода устойчивы и не проявляют окислительных свойств. У свинца металлические свойства выражены сильнее, чем у углерода и для него характерна степень окисления +2, вследствие чего соединения свинца со степенью окисления +4 являются окислителями.
В побочных (В) подгруппах располагаются d- иf-элементы.Валентные электроны в атомах d-элементов находятся на s-под-уровне внешнего и d-подуровне предвнешнего энергетических уровней.В побочных подгруппах, кроме подгруппы скандия, при переходе сверху вниз металлические свойства ослабевают, а кислотный характер соединений и их устойчивость в высшей степени окисления усиливаются.
d-элементы побочных подгрупп склонны проявлять переменную степень окисления. Характер образуемых ими соединений зависит от степени окисления элемента.
Если элементы образуют несколько соединений, то соединения, в которых элемент находится в низшей степени окисления, имеют основной характер, в высшей степени окисления – кислотный, а в промежуточной – чаще всего амфотерный.
Например, хром проявляет степени окисления +2, +3, +6 и характер образуемых им оксидов следующий:
Cr+2O
![]() Cr+6O3
Cr+6O3
Основной амфотерный кислотный
Элементы главных и побочных подгрупп сильно отличаются по своим свойствам. Общими для элементов главных и побочных подгрупп являются формулы высших оксидов и образуемых ими гидроксидов.
У высших оксидов и соответствующих им гидроксидов элементов I–IIIгрупп (кроме бора) преобладают основные свойства,IV–VIIгрупп – кислотные (табл. 4.2).
Таблица 4.2
Формулы и характер кислородных соединений элементов
(оксидов и гидроксидов)
|
Группа |
I |
II |
III |
IV |
V |
VI |
VII |
|
Формула высшего оксида |
|
|
|
|
|
|
|
|
Формула гидроксида |
ЭОН |
Э(ОН)2 |
Э(ОН)3 |
Н2ЭО3 |
НЭО3 |
Н2ЭО4 |
НЭО4 |
|
Характер гидроксида |
Основания |
Кислоты | |||||
Для элементов главных подгрупп общими являются формулы водородных соединений – гидридов (табл. 4.3).
Таблица 4.3
Формулы и агрегатное состояние водородных соединений элементов
|
Подгруппа |
I A |
II A |
III A |
IV A |
V A |
VI A |
VII A |
|
Формула гидрида |
|
|
|
|
|
|
|
|
Агрегатное состояние |
Твердые |
Газообразные | |||||
4.4. Химическая связь.
Химическая связь состояние взаимодействующих атомов, обусловленное перекрыванием электронных облаков их валентных электронов и сопровождающееся уменьшением полной энергии системы.
Химическая связьудерживает атомы или группы атомов друг около друга. Строение и свойства молекул или других частиц ха-рактеризуются рядом параметров химической связи –энергией связи, длиной связи (межатомные расстояния),валентным углом(угол между воображаемыми прямыми, проходящими через ядра атомов).
Количество энергии, выделяющееся при образовании химической связи, называется энергий связи и измеряется в кДж/моль.
Энергия связи является мерой ее прочности: чем выше энергия связи, тем прочнее молекула.
Различают несколько видов химической связи:
ковалентную(полярную и неполярную),
ионную,
металлическую,
водородную.
Ковалентная связь это связь, возникающая за счет перекрывания электронных облаков взаимодействующих атомов (образования общих электронных пар возникающих при объединении валентных электронов разных атомов).
Количество электронов, которое атом может использовать для образования химических связей, определяется валентностью элемента. Номер группы, в которой находится элемент, обычно совпадает с максимальным количеством валентных электронов. Исключение азот, кислород, фтор, гелий, неон.
У элементов главных подгрупп все валентные электроны расположены на внешнем энергетическом уровне. У элементов побочных подгрупп валентные электроны расположены на внешнем и частично на предвнешнем энергетическом уровнях.
Существуют два механизма образования ковалентной связи – обычный (обменный) механизм и донорно-акцепторный механизм.
Обычный механизмобразования ковалентной связи заключается в том, что по одному неспаренному электрону двух разных атомов образуют общее электронное облако, которое окружает ядра обоих атомов. Эти электроны должны иметь различное значение квантовых чисел.
Графически это можно представить по-разному.
1) с помощью записи внешних электронов в виде точек, окружающих химический знак элемента (так называемая электронно-точечная формула).
Например, молекула хлора Cl2образуется из двух атомов хлора, имеющих следующее строение электронных оболочек:

1
Cl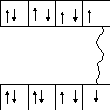 7Сl
(1s22s22p6
3s23p5)
7Сl
(1s22s22p6
3s23p5)

1
Cl
В результате обобществления валентных электронов, каждый из атомов получает устойчивую восьмиэлектронную оболочку:
О бщая
бщая
э
 лектронная
лектронная
пара
2) Строение молекулы можно отображать с помощью так называемых структурных формул. Каждая химическая связь, символизирующая общую электронную пару, изображается в виде черточки:
Н — Н
3) Химическую связь можно обозначить с помощью условного обозначения атомных орбиталей,на которых находятся электроны, участвующие в образовании химической связи:
Атомные орбитали
 Н Н 1s
1sН
Н Н 1s
1sН
Молекулярная орбиталь
Более низкое расположение молекулярной орбитали с двумя элект-ронами, по сравнению с отдельными атомными орбиталями, указывает на то, что общее электронное облако имеет меньшую «потенциаль-ную» энергию. Волнистая линия изображает спаривание электронов.
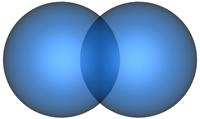
4) Химическую связь часто изображают с помощью рисунка, показывающего перекрывание атомных орбиталей валентных электроноввзаимодействующих атомов (см рис. 4.10).
Связь между атомами может быть образована и несколькими электронными парами, и при увеличении числа общих электронных пар прочность ее увеличивается.
Н Н Cl Cl





s s p p
Зоны повышенной электронной плотности
Рис. 4.10. Образование молекул водорода и хлора при перекрывании двух сферических s и двух гантелеобразных р атомных орбиталей.
Так, атом азота ( 7N…2s22p3) имеет 3 неспаренных электрона:
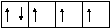
2
s p
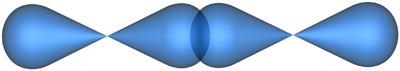
Тогда в молекуле азота N2между двумя атомами элемента азота будет три пары общих электронов или произойдет перекрывание трех атомных орбиталей:


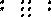 NNэлектронно-точечная
формула молекулы азота
NNэлектронно-точечная
формула молекулы азота
 NNструктурная формула
молекулы азота
NNструктурная формула
молекулы азота
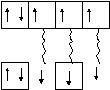 2
2


Перекрывающиеся атомные орбитали
в молекуле азота
2
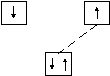
При образовании ковалентной связи по другому (донорно-акцепторному) механизму один атом предоставляет в общее пользование пару электронов, а другой «втягивает» ее на свою свободную атомную орбиталь.
Спаренные электроны атома донора
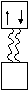
Свободная орбиталь атома акцептора
Атом, предоставляющий электронную пару, называется донором, а принимающий ее на свою свободную орбитальакцептором.
Примером возникновения ковалентной связи по донорно-акцепторному механизму является образование иона аммония из молекулы аммиака и иона водорода:
NH3 + H+ → NH4+.
В молекуле аммиака 3 неспаренных электрона атома азота образуют три валентных связи с тремя атомами водорода по обычному механизму образования ковалентной связи. Неподеленная электронная пара 2sатома азота (донор) заняла свободную орбиталь иона водорода (акцептор), образующегося при диссоциации молекулы кислоты, например,HCI.
2s2p
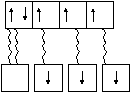 N
N
донорно-акцепторный обычный механизм
механизм образования образования химической
х

 имической
связи
связи
имической
связи
связи
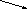
1s
H+HHH
Рис. 4.11. Образование иона аммония по донорно-акцепторному механизму.
Таким образом, в ионе аммония у азота 4 общие электронные пары с четырьмя атомами водорода, все четыре связи ковалентные, но одна возникла по донорно-акцепторному механизму.
По донорно-акцепторному механизму также
образуется тетрафторборат aнион![]() и некоторые другие.
и некоторые другие.
По характеру распределения общего электронного облака относительно ядер двух атомов ковалентную связь подразделяют на:
ковалентную неполярную,
ковалентную полярную,
ионную(часто ионную связь рассматривают как крайний случай ковалентной полярной связи).
Ковалентной неполярной называется связь, образуемая электронным облаком, симметрично расположенным относительно ядер обоих атомов.
Очевидно, что такие атомы должны быть одинаковыми, т.е. иметь одинаковую величину электроотрицательности и характеризоваться одинаковой способностью смещать на себя электронную плотность. Разность относительных электроотрицательностей (см. табл. 14 приложения) в этом случае будет равна нулю.
Если ∆ОЭО = 0, то связь является ковалентной неполярной.
В первую очередь ковалентную неполярную связь имеют атомы в молекулах, состоящих из одинаковых атомов (молекулы типа А2):
H2, O2, CI2 и т.д.
При образовании ковалентной полярнойсвязи общее электронное облако смещено к более электроотрицательному атому. Атом с большей электроотрицательностью сильнее притягивает к себе пару электронов связи, и его истинный заряд становится отрицательным. При этом, атом с меньшей электроотрицательностью приобретает такой же по величине положительный заряд. В этом случае разница в величинах относительных электоотрицательностей атомов (ΔОЭО), образующих химическую связь, должна иметь значение больше нуля, но меньше 1,7 (по Поллингу).
Если 0 > ∆ОЭО < 1,7, то связь является ковалентной полярной.
Обычно ковалентная полярная связь возникает между двумя неметаллами, например в соединениях:
Н2О, NH3, CH4, СО2, НСl.
Ковалентная связь характеризуется насыщаемостьюинаправленностью. Направленность выражается значениями валентных углов, определяемых расположением атомных орбиталей в пространстве.
Насыщаемость определяется количеством электронов, способных участвовать в образовании связи.
Ионная связь химическая связь, образующаяся между атомами, характеризующимися большой разницой в величинах относительныхэлектроотрицательностей.При этом общаяэлектронная пара(общая электронная плотность) практически полностью переходит к атому с большей электроотрицательностью и образуются ионы, между которыми возникает электростатическое притяжение:
А+В А+[:В].
Разница в величинах относительных электоотрицательностей атомов (ΔОЭО), образующих ионную химическую связь, обычно имеет значение больше 1,7 (по Поллингу).
Если ∆ОЭО > 1,7, то связь считается ионной (степень ионности составляет более 50 %).
Обычно ионная связь возникает между типичными металлами (малая величина относительной электроотрицательности) и типичными неметаллами (большая величина относительной электроотрицательности).
На самом деле, ионная связь между атомами в чистом виде практи-чески не реализуется, а химическая связь, считающаяся ионной, фактически носит частично ионный, а частично ковалентный характер.
Например, в соединении цезия с фтором CsF:
ΔОЭО = ОЭО (F) – ОЭО (Cs) = 4,0 – 0,7 = 3,3.
Cтепень ионности составляет 97 %.
Электростатическое взаимодействие между ионами не направлено в пространстве и поэтому ионная связь, в отличие от ковалентной связи, характеризуется ненаправленостью и ненасыщаемостью.
