
- •Глава 4 Строение атома. Химическая связь.
- •4.1. Периодический закон д.И.Менделеева.
- •4.2. Строение атома
- •4.2.1. Электронная структура атома
- •Максимальное число электронов на квантовых уровнях и подуровнях
- •2Валентность I
- •2 Валентность в основном
- •4.2.2. Основное и возбужденное состояние атома
- •2Валентность II
- •2Валентность I
- •2Валентность II
- •2Валентность IV
- •1 P Валентность II
- •4.2.3. Строение атома и химические свойства элементов
- •Увеличение энергии сродства к электрону
- •4.3. Периодическая система химических элементов д.И. Менделеева
- •Основной амфотерный кислотный
- •4.4.1. Водородная связь.
- •4.5. Описание строения некоторых молекул
- •Метод валентных связей (вс)
- •4.6. Представление о гибридизации атомных орбиталей.
- •4.7. Кристаллические решетки твердых тел.
- •4.8. Вопросы для самоконтроля.
- •4.9. Тесты для контроля знаний по теме «Строение атома» Вариант № 1
- •Вариант № 2
- •1) IV группа, главная подгруппа, 2) VI группа, главная подгруппа, 3) VI группа, побочная подгруппа, 4) IV группа, побочная подгруппа, 5) V группа, главная подгруппа.
- •Вариант № 3
- •4.10. Вопросы и упражнения для самоподготовки по теме «Строение атома. Химическая связь».
- •1) BaCl2, 2) kCl, 4) h2, 8) o2, 16) h2o, 32) so3?
- •1) H2so4, hClO4, 2) f2o, co2, 3) so2, h2so4, 4) co2, so3?
- •1) Этан, 2) этен, 3) этин, 4) бензол.
- •1) Sp, 2) sp2, 3) sp3, 4) атомные орбитали не гибридизованы?
4.6. Представление о гибридизации атомных орбиталей.
Рассмотрим строение молекулы соединения бериллия с водоро-дом BeH2(гидрид бериллия), в котором водород имеет валентностьI, а бериллий валентностьII.
Графическое изображение молекулы BeH2:
HI ― BeII― HI.
В этом соединении атом водорода 1H1s1 , в котором единственный электрон расположен на сферической атомной орбитали, соединяется с атомом бериллия.

Электронно-графическая формула атома водорода :
Форма орбитали атома водорода:

Электронная формула атома бериллия: 4Bе 1s22s2

Электронно-графическая
формула
и форма орбитали
атома
бериллия: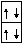
Как видно из электронно-графической формулы, атом бериллия не имеет неспаренных электронов и валентность бериллия в основном состоянии равна нулю. Валентность, равную двум, атом бериллия, проявляет в возбужденном состоянии 4Bе٭ 1s22s1 2р1:
Электронно-графическая
формула атома бериллия
в возбужденном
состоянии:
Валентность
II 2

1
s
Таким образом, у атома бериллия в образовании химической связи должны были бы участвовать электроны, находящиеся на двух разных атомных орбиталях 2sи 2pи имеющих различную форму и различную энергию. Однако, энергии каждой из двух связей в мо-лекулеBeH2имеют одинаковые значения. Выравнивание энергий различных атомных орбиталей обусловлено явлениемгибридиза- ции.
Гибридизация это явление, при котором из двух или большего числа атомных орбиталей различных энергий и различной формы образуется такое же число видоизмененных орбиталей, обладающих одинаковой энергией.
В нашем случае, в гибридизации участвуют атомные орбитали одного s- и одногоp-электроновsp-гибридизация (рис. 4.19).
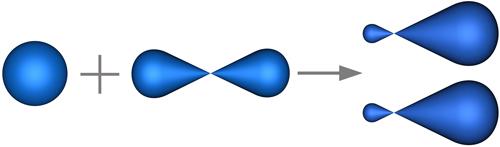
s-орбиталь p-орбиталь две sp-гибридных орбитали
Рис. 4.19. Формы исходных и гибридизованных орбиталей атома бериллия.
При такой гибридизации образуются 2 гибридные орбитали, которые расположены на одной оси и ориентированы друг к другу под углом 180° (рис. 4.20).
 1800
1800


Рис. 4.20. Расположение двух и sp- гибридизованных орбиталей в пространстве.
Такое расположение гибридных орбиталей определяет линейную форму молекулы. Две сферических орбитали двух атомов водорода перекрываются с двумя sp-гибридными орбиталями бериллия (рис. 4.21).


Рис. 4.21. Перекрывание атомных орбиталей в молекуле BeH2
Примеры химических
соединений, для которых характерна
sp-гибридизация: BeCl2, BeH2,CO,CO2,HCN.
Такжеsp-гибридизация наблюдается
во всех ацетиленовых углеводородах
(алкинах) и некоторых других органических
соединениях.
В sp2-гибридизацииучаствуют атомные орбитали одногоs- и двухp-электронов (рис. 4.22).
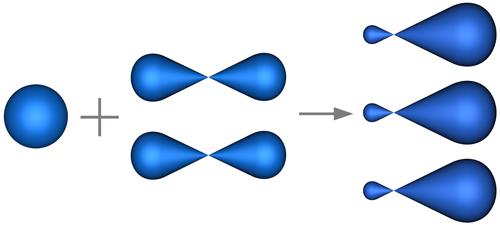
s-орбиталь две p- орбитали три sp2-гибридных орбитали
Рис. 4.22. Формы орбиталей при sp2-гибридизации.
В результате гибридизации образуются
три гибридныеsp2-орби-тали,
расположенные в одной плоскости под
углом 120° друг к другу (рис. 4.23).
результате гибридизации образуются
три гибридныеsp2-орби-тали,
расположенные в одной плоскости под
углом 120° друг к другу (рис. 4.23).

1200
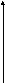

Рис. 4.23. Расположение орбиталей в пространстве при sp2- гибридизации.
Форма молекулы, имеющей три гибридные sp2-орбитали представляет собой плоский треугольник. Такую форму имеет, например, молекула хлорида алюминияAlCl3. Схема перекрывания электронных орбиталей в этой молекулы показана на рис. 4.24.
Примерами других соединений, в которых
имеет место sp2-гиб-ридизация,
являются молекулы:BCl3,SO3,BF3и ионы:![]() ,
,![]() .
Кроме того,sp2-гибридизация
характерна для всех этиленовых
углеводородов (алкенов), карбоновых
кислот, ароматических углеводородов
(аренов) и других органических соединений.
.
Кроме того,sp2-гибридизация
характерна для всех этиленовых
углеводородов (алкенов), карбоновых
кислот, ароматических углеводородов
(аренов) и других органических соединений.



Рис. 4.24. Перекрывание атомных орбиталей в молекуле AlCl3
Например в молекуле этилена (C2H4), оба атома углерода, находящиеся в возбужденном состоянии (sp2-гибридизация) связаны друг с другом двойными химическими связями, образуя одну σ-связь и одну π-связь. Еще по две σ-связи каждый атом углерода образует при соединении с атомами водорода.
В sp3-гибридизациипринимают участие однаs- и триp- атомные орбитали (рис.4.25).
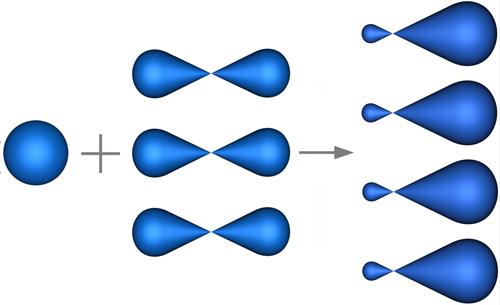

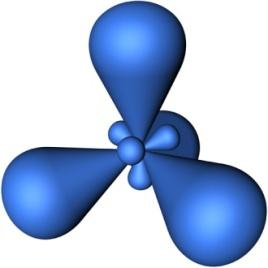
Рис. 4.25. Образование sp3-гибридных орбиталей.
Из четырех обычных атомных орбиталей образуется такое же число видоизмененных гибридных орбиталй, которые симметрично ориентированны в пространстве под углом 109°28'. Пространственная конфигурация молекулы, центральный атом которой образован sp3-гибридными орбиталями – тетраэдр.
Схема перекрывания электронных облаков в молекуле метана (CH4), в которой атом углерода находится вsp3-гибридизации представлена на рис. 4.26.
Примеры соединений, для которых характерна sp3-гибридизация:NH3, POCl3, SO2F2, SOBr2, NH4+, H3O+. Такжеsp3-гибридизация наблюдается во всех предельных углеводородах (алканы, циклоалканы), некоторых других органических соединениях.
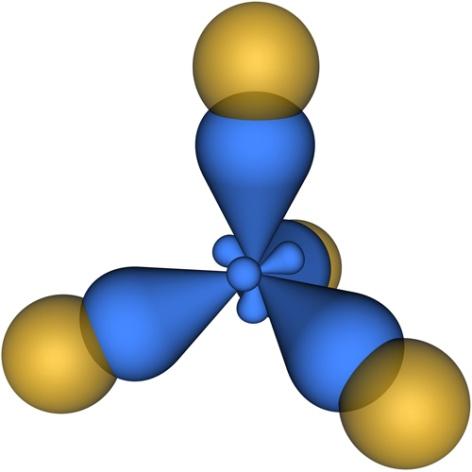
Рис. 4.26. Схема перекрывания электронных облаков в молекуле метана CH4
Следует иметь в виду, что не всегда пространственная конфигурация молекулы, имеющей sp3тип гибридизации соответствует тетраэдру.
Например, в молекуле аммиака (NH3) валентность атома азота равна III и его пять электронов внешнего уровня занимают четыре орбитали (однуsи триp). Все они принимают участие в гибридизации (тип гибридизации –sp3), но только три орбитали (р-орбитали) принимают участие в образовании химической связи. Тетраэдр без одной вершины превращается в пирамиду. Поэтому у молекулы аммиака форма молекулы пирамидальная, угол связи искажается до 107°30′. Аналогичные рассуждения о строении молекулы воды (H2O) приводят нас к тому, что кислород находится вsp3гибридном состоянии, а форма молекулы угловая, угол связи составляет 104°27′.
