
- •Глава 4 Строение атома. Химическая связь.
- •4.1. Периодический закон д.И.Менделеева.
- •4.2. Строение атома
- •4.2.1. Электронная структура атома
- •Максимальное число электронов на квантовых уровнях и подуровнях
- •2Валентность I
- •2 Валентность в основном
- •4.2.2. Основное и возбужденное состояние атома
- •2Валентность II
- •2Валентность I
- •2Валентность II
- •2Валентность IV
- •1 P Валентность II
- •4.2.3. Строение атома и химические свойства элементов
- •Увеличение энергии сродства к электрону
- •4.3. Периодическая система химических элементов д.И. Менделеева
- •Основной амфотерный кислотный
- •4.4.1. Водородная связь.
- •4.5. Описание строения некоторых молекул
- •Метод валентных связей (вс)
- •4.6. Представление о гибридизации атомных орбиталей.
- •4.7. Кристаллические решетки твердых тел.
- •4.8. Вопросы для самоконтроля.
- •4.9. Тесты для контроля знаний по теме «Строение атома» Вариант № 1
- •Вариант № 2
- •1) IV группа, главная подгруппа, 2) VI группа, главная подгруппа, 3) VI группа, побочная подгруппа, 4) IV группа, побочная подгруппа, 5) V группа, главная подгруппа.
- •Вариант № 3
- •4.10. Вопросы и упражнения для самоподготовки по теме «Строение атома. Химическая связь».
- •1) BaCl2, 2) kCl, 4) h2, 8) o2, 16) h2o, 32) so3?
- •1) H2so4, hClO4, 2) f2o, co2, 3) so2, h2so4, 4) co2, so3?
- •1) Этан, 2) этен, 3) этин, 4) бензол.
- •1) Sp, 2) sp2, 3) sp3, 4) атомные орбитали не гибридизованы?
2Валентность I
1
s
У атома лития электрон, находящийся на 2 s-подуровне, менее прочно связан с ядром, чем электроны первого энергетического уровня, поэтому в химических реакциях атом лития может легко отдавать этот электрон, превращаясь в ионLi+ (ион электрически заряженная частица). В этом случае ион лития приобретает устойчивую завершенную оболочку благородного газа гелия:
3Li+ 1s2.
Следует заметить, что, число неспаренных (одиночных) электронов определяет валентность элемента, т.е. его способность образовывать химические связи с другими элементами.
Так, атом лития имеет один неспаренный электрон, что обусловливает его валентность, равную единице.
Электронная формула атома бериллия:
4 Bе 1s2 2s2.
Электронно-графическая формула атома бериллия:
2 Валентность в основном
состоянии равна 0
1
s
Легче других у бериллия отрываются электроны подуровня 2s2, образуя ионBe+2:
4 Bе+2 1s2.
Можно заметить, что атом гелия и ионы лития 3Li+ и бериллия4Bе+2имеют одинаковое электронное строение, т.е. характеризуютсяизоэлектронным строением.
4.2.2. Основное и возбужденное состояние атома
Состояние атома, при котором его электроны находятся на таких энергетических уровнях, что их суммарная энергия является минимальной, называется основнымилиневозбужденным.Состояния с более высокими значениями энергии называютсявозбужденными.
При сообщении атому дополнительной энергии электроны могут переходить на обладающие большей энергией орбитали. Эти переходы с подуровня на подуровень возможны только в пределах одного внешнего энергетического уровня. Происходящее при этом распаривание электронов приводит к возрастанию у атома числа неспа-ренных электронов, т.е. к появлению новых валентных возможностей.
Например, при возбуждении у атома бериллия один электрон с внешнего подуровня 2sпереходит на обладающий большей энергией и ранее свободный (вакантный) подуровень 2р. При этом валентность атома бериллия становится равной 2.
Электронная формула атома бериллия в возбужденном состоянии будет иметь вид:
4 Bе٭ 1s2 2s1 2р1.
Электронно-графическая формула атома бериллия в возбужденном состоянии:


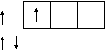
2Валентность II
1p
s
Электронная формула атома бора в нормальном состоянии:
5B 1s22s22p1.
Электронно-графическая формула атома бора имеет вид:
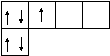
2Валентность I
1p
s
На втором энергетическом уровне у атома бора 3 электрона, поэтому он образует ион В+3.
Электронная и электронно-графические формулы атома углерода 6С в нормальном состоянии имеют вид:
6С 1s22s22р2.



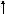


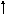
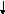
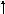
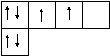
2Валентность II
1р
s
В возбужденном состоянии атом углерода 6С٭ за счет перехода электрона с орбитали 2sна орбиталь 2рбудет иметь следующие электронные и электронно-графические формулы:
Электронная формула:
6С٭ 1s22s12р3
Электронно-графическая формула:

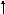
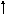

2Валентность IV
1р
s
Поэтому, углерод в своих соединениях может быть либо двух-, либо четырехвалентен.
Следует обратить внимание на то, что при возбуждении могут распариваться электроны только внешнего электронного уровня, если на нем есть свободные орбитали.
У атома углерода внешний энергетический уровень наполовину заполнен, поэтому возможна и отдача 4-х электронов с образованием иона С+4 (1s2 2s2 2р0) и присоединение электронов для максимального заполненияp-подуровня второго энергетического уровня с образованием иона С-4 (Is22s22р6).
Атом кислорода 8О 1s22s22р4имеет на внешнем энергетическом уровне два неспаренных электрона, что обусловливает его валентность, равную двум. Это видно из электронно-графической формулы атома кислорода в нормальном состоянии:
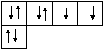
2
