
- •Рецензенты:
- •Оглавление
- •Предисловие
- •Введение
- •Глава 1. Основныепонятияи определения измерительной техники
- •Основные понятия и определения метрологии
- •Единицы физических величин
- •Классификация и методы измерений
- •Классификация средств измерений
- •Метрологические характеристики средств измерений
- •Классификация погрешностей
- •Модели измерительного процесса
- •Систематические погрешности
- •Случайные погрешности
- •Обработка результатов измерений
- •Суммирование погрешностей
- •Формы записи результатов измерений
- •Глава 2. Технические средства измерений электрических величин
- •Электромеханические измерительные приборы
- •Электромагнитные измерительные приборы
- •Электродинамические измерительные приборы
- •Ферродинамические измерительные приборы
- •Электростатические измерительные приборы
- •Индукционные измерительные приборы
- •Электромеханические приборы с преобразователями
- •Измерительные трансформаторы тока и напряжения
- •Измерительные трансформаторы переменного тока
- •Измерительные трансформаторы напряжения
- •Основными параметрами трансформатора напряжения
- •Электронные измерительные приборы
- •Электронные вольтметры постоянного тока
- •Электронные вольтметры переменного тока
- •Электронный вольтметр среднего значения
- •Амплитудный электронный вольтметр (диодно- конденсаторный)
- •Электронный вольтметр действующего значения.
- •Электронный омметр
- •Цифровые измерительные приборы
- •Измерительные мосты и компенсаторы
- •Компенсаторы постоянного тока
- •Компенсаторы переменного тока
- •Автоматические компенсаторы постоянного тока
- •Мосты переменного тока
- •Глава 3. Общие сведения об измерении неэлектрических величин
- •Схемы включения преобразователей в мостовые схемы
- •Динамические свойства преобразователей
- •Классификация измерительных преобразователей
- •Глава 4. Параметрические преобразователи
- •Фотоэлектрические преобразователи
- •Емкостные преобразователи
- •Тепловые преобразователи
- •Погрешности термоанемометра
- •Погрешности газоанализатора.
- •Ионизационные преобразователи
- •Реостатные преобразователи
- •Тензорезистивные преобразователи
- •Индуктивные преобразователи
- •Магнитоупругие преобразователи
- •Погрешности магнитоупругих преобразователей
- •Применение магнитоупругих преобразователей
- •Генераторные преобразователи
- •Гальванические преобразователи
- •Глава 5. Классификация ацп, методыпреобразования и построения ацп
- •Аналого-цифровое преобразование сигналов
- •Классификация ацп
- •Классификация ацп по методам преобразования
- •Метод последовательного счета
- •Метод поразрядного уравновешивания
- •Метод одновременного считывания
- •Построение ацп
- •Сравнительные характеристики ацп различной архитек- туры
- •Параметры ацп и режимы их работы
- •Максимальная потребляемая или рассеиваемая мощность
- •Глава 6. Измерительные информационные системы
- •Стадии проектирования иис:
- •Роль информационных процессов
- •Виды и структуры измерительных информационных систем
- •Основные компоненты измерительных информационных систем
- •Математические модели и алгоритмы измерений для измерительных информационных систем
- •Нет Корректировка алгоритма измерения Измерение
- •Разновидности измерительных информационных систем
- •Многоточечные (последовательно-параллельного дей- ствия) ис
- •Аппроксимирующие измерительные системы (аис).
- •Телеизмерительные системы
- •Системы автоматического контроля
- •Системы технической диагностики
- •Системы распознавания образов
- •Особенности проектирования измерительных информационных систем
- •Интерфейсы информационно-измерительных систем
- •Заключение
- •Список литературы
- •Основные и производные единицы Основные единицы измерения
- •Приборы для измерения электрической мощности и количества электричества
- •Приборы для измерения электрического сопротивления, емкости, индуктивности и взаимной индуктивности
- •И угла сдвига фаз
- •Прочие электроизмерительные приборы
- •Электронные измерительные приборы и устройства
- •Средства измерений и автоматизации
- •ГосТы, осТы и нормативные документы иис
Гальванические преобразователи
Гальванические преобразователи применяются в основном для анализа состава водных растворов. Принцип действия их основан на зависимости ЭДС гальванической цепи от концентрации ионов в электролите. Для анализа водных растворов используют зависи- мость активности водородных ионов от концентрации раствора.
Вода, обладающая наибольшей по сравнению с другими веще- ствами диэлектрической проницаемостью (εн2о=81), хорошо спо- собствует диссоциации растворяемого вещества на ионы и сама несколько диссоциирует по схеме Н2О↔Н+ + ОН-, чем обусловле- на вполне определенная, хотя и малаяэлектропроводность воды.
2
![]() Так
как молекулы
воды
при ионизации
образуют
ионы
водо-
рода и
гидроксила
в равном
количестве,
то
Так
как молекулы
воды
при ионизации
образуют
ионы
водо-
рода и
гидроксила
в равном
количестве,
то
| Н+ |=| ОН- |=
1014 107 .
Растворы, в которых число ионов |Н+| и |ОН 5 одинаково, называются нейтральными.
Если в воде растворить кислоту, то концентрация ионов |Н+|
в растворе станет больше, если же растворить щелочь, то наобо- рот, больше станет ионов | ОН- |. Таким образом, у кислых рас- творов |Н+| >10-7, а у щелочных |Н+|<10-7, и в зависимости от это- го можно охарактеризовать растворы как кислые, щелочные или нейтральные.
На практике концентрацию водородных ионов численно харак- теризуют отрицательным логарифмом концентрации – водородным показателем рН = -lg |Н+|. Например, если |Н+| = 10-3, то рН = 3.
Приборы для измерения показателя рН получили название рН-метров. Наиболее точным и универсальным методом измере- ния рН является электрометрический метод, суть которого за- ключается в следующем.
Если в раствор какого-либо вещества внести электрод из этого же вещества, то на границе электрод–раствор возникает погра-
ничный электрический потенциал (так называемый электродный потенциал), величина которого зависит от степени концентрации раствора.
Гальванические преобразователи, являющиеся датчиками рН- метров, в качестве входной величины имеют значение концентра- ции водородных ионов, выраженное в единицах рН, а в качестве выходной величины – гальваническое напряжение, равное разности электродных потенциалов. Так как практически потенциал одного электрода измерить невозможно, то гальванический преобразова- тель всегда состоит из двух полуэлементов: измерительного элек- трода, помещенного в раствор, и образцового полуэлемента.
Принципиальное устройство рН-метра показано на рис. 4.62.
 1
1
8
2 3
H2 KCl
4
H2 5
7 6
KCl Hg2Cl2 Hg
Рис. 4.62. Устройство рН-метра: 1 – вывод; 2 – пластинка;
3 – электролитический ключ; 4 – полуэлемент; 5 – полупроницаемые пробки; 6 – колба; 7 – трубка; 8 – отверстие
В колбу 6 налит испытуемый раствор. Так как необходимо из- мерять концентрацию ионов водорода, то согласно принципу дей- ствия гальванических преобразователей электрод должен быть вы- полнен из водорода. Так как водород является газом и выполнить электрод из него невозможно, пользуются способностью водорода адсорбироваться на поверхности платины. Измерительный (водо-
родный)электрод представляетсобой пластинку 2 из черненой платины, которая обтекается непрерывно поступающим через трубку 7 водородом. Водород выходит через отверстие 8. От пла- тиновой пластинки отходит вывод 1 в измерительную цепь.
Для получения второго потенциала колба с испытуемым рас- твором соединяется через электролитический ключ 3 с вторым образцовым полуэлементом 4. Электролитический ключ пред- ставляет собой трубку, закрытую полупроницаемыми пробками 5 и заполненную насыщенным раствором KC1. Такое соединение сильно снижает диффузионный потенциал, вносящий погреш- ность в измерения.
В качестве образцового полуэлемента чаше всего используют каломельный полуэлемент, металлом которого является ртуть, ионы которой получают из раствора каломели Hg2Cl2. Концен- трация электролита КС1 определяет потенциал ртути, который (при насыщенном растворе КС1) равен 0,24 В.
Кроме каломельного используются также хлорсеребряный, бромсеребряный и другие образцовые элементы.
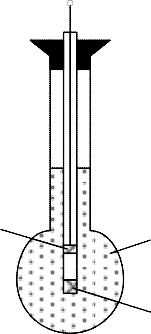
Применение водородного электрода в производстве обычно неудобно, так как связано с подачей газообразного водорода. По- этому на практике большое распространение получил стеклян- ный электрод (рис. 4.63).
 3 1
3 1
2
Рис. 4.63. Стеклянный электрод: 1 – колбочка; 2 – фильтр; 3 – электрод
Он представляет собой шаровую тонкостенную колбочку 1, выдуваемую на конце трубки из специальных электропроводных сортов стекла. Толщинастенки колбочкиравна 0,05...0,1 мм.
Колбочка заполняется контрольным (нормальным) раствором какой-либо соли или кислоты с известным рН и погружается в исследуемый раствор. На границе стекло–раствор появляется определенный потенциал, зависящий от концентрации водород- ных ионов раствора, в который погружен стеклянный электрод.
При работе используются обе поверхности стеклянного элек- трода, так как снять потенциал с одной только поверхности не- возможно (невозможно включить поверхность стекла в электри- ческую цепь). Внутрь колбочки 1, заполненной образцовым рас- твором, вставляется вспомогательный электрод 3 (обычно хлор- серебряный), с которого снимается потенциал стеклянного элек- трода.
Если в испытуемыйрастворпоместить еще и каломельный полуэлемент, то ЭДС на выводах преобразователя будет являться алгебраической суммой ЭДС хлорсеребряного полуэлемента, внутренней поверхности и наружной поверхности стеклянного электрода и потенциала каломельного полуэлемента. Так как при изменении рН исследуемого раствора будет изменяться только потенциал наружной поверхности электрода, а все остальные со- ставляющие ЭДС останутся неизменными, то, измеряя ЭДС на выводах преобразователя, можно судить о концентрации (рН) исследуемого раствора.
Потенциал стеклянного электрода изменяется примерно от 0,3 (при рН ≈ 0) до 0,9 В (при рН ≈ 10).
Наиболее обоснованное объяснение действия стеклянного электрода состоит в следующем. При помещении стеклянного электрода в раствор ионы натрия из стекла переходят в раствор, а их места замешают ионы водорода из раствора. В результате это-
го поверхностный слой стекла оказывается насыщенным водо- родными ионами и стеклянный электрод приобретает свойства водородного электрода. Существуют также хингидронный, сурь- мяный электроды. Градуировка рН-метров производится по об- разцовым буферным растворам, обладающим высокой стабиль- ностью значений рН (±0,01 рН в диапазоне температур 0...95ºC).
Погрешности рН-метров. Основным требованием, предъяв- ляемым к методу измерения ЭДС рН-метрами, является возмож- но меньший ток через преобразователь, так как он, во-первых, создает падение напряжения на его внутреннем сопротивлении, вследствие чего результат занижается, во-вторых, вызывает явле- ние поляризации, что также влечет за собой отрицательную по- грешность. Падение напряжения в преобразователе определяется также его сопротивлением, которое особенно велико в рН-метре со стеклянным электродом (десятки и дажесотни МОм).
Поэтому непосредственное измерение ЭДС можно осуще- ствить лишь с применением электронных усилителей с большим входным сопротивлением порядка 108...1010 Ом. Чаще всего при- меняют компенсационный метод. Как известно, в момент изме- рения входное сопротивление компенсатора практически равно бесконечности.
Наиболее значительной погрешностью рН-метров является температурная погрешность, так как при измерении температуры изменяется ЭДС измерительных полуэлементов и сопротивление преобразователя(особенно со стеклянным электродом).Для уменьшения температурной погрешности в измерительную цепь вводят элементы температурной компенсации, например в виде включения термочувствительного сопротивления, помещаемого в раствор.
Кроме того, у гальванических преобразователей может быть погрешность от наличия диффузионных потенциалов, возникаю-
щих на границе жидкостных контактов растворов, входящих в электрическую цепь преобразователя. В целях уменьшения этой погрешности, как было указано выше, для соединения испытуе- мого раствора с каломельным полуэлементом применяется элек- тролитический ключ с полупроницаемыми пробками, заполнен- ный насыщенным раствором КС1.
Как следует из самого принципа их действия, гальванические преобразователи применяются для измерения концентрации раз- личных растворов по концентрации водородных ионов. Это дает возможность контролировать технологические процессы в пище- вом, бумажном, текстильном, резиновом производствах, в ряде производств химической промышленности и др.
Контрольные вопросы
Назовите основные характеристики измерительных преобразова- телей.
Опишите метод прямого преобразования.
Дайте характеристику дифференциального метода.
Опишите динамические свойства измерительных преобразова- телей.
Приведите классификацию ИП.
Опишите фотоэлектрические преобразователи.
Охарактеризуйте емкостные преобразователи.
Опишите термопары.
Что представляют собой термометры сопротивления?
Каковы особенности магнитоупругих преобразователей?
Охарактеризуйте пьезоэлектрические преобразователи.
