
- •4. . Следствия из опытов Резерфорда.
- •Определение заряда ядра по методу Чедвика
- •7. Опыты Франка и Герца.
- •Недостатки теории Бора.
- •11. Соотношение неопределённостей.
- •12. Волновая функция. Луи де-Бройль выдвинул гипотезу, что дуализм не является особенностью одних только оптических явлений, но имеет универсальное значение.
- •Уравнение Клейна-Гордона.
- •19. Уравнение Шрёденгера для атома водорода.
19. Уравнение Шрёденгера для атома водорода.
Простейшая
система, состоящая из электрона е,
который движется в кулоновском поле
ядра с зарядом Ze, называется
водородоподобной. При Z=1
это атом водорода, при Z=2
– однократно ионизированный атом гелия
– ион
 и т.д. Потенциальная энергия взаимодействия
электрона с ядром в такой системе равна
и т.д. Потенциальная энергия взаимодействия
электрона с ядром в такой системе равна
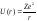 (1),
где r- расстояние между
электроном и ядром, которое в первом
приближении будем считать точечным.
(1),
где r- расстояние между
электроном и ядром, которое в первом
приближении будем считать точечным.
Уравнение
Шредингера в этом случае имеет вид
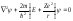 (2)
(2)
Поле
(1), в котором движется электрон, является
центрально-симметричным, т.е. зависит
только от r. Поэтому решение
уравнения (2) наиболее целесообразно
проводит в сферической системе координат
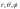 ,
где оператор Лапласа имеет вид
,
где оператор Лапласа имеет вид
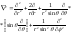
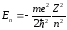 .
.
20. Физический смысл квантования чисел.
1.
Главное
квантовое число
n.
Это квантовое число принимает значения
n =1,2,3…, и определяет полную
энергию электрона в любом квантовом
состоянии
Главное
квантовое число n характеризует энергию
атомной орбитали. Оно может принимать
любые положительные целочисленные
значения. Чем больше значение n, тем выше
энергия и больше размер орбитали.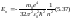
2. Орбитальное квантовое число l - характеризует энергетический подуровень. Атомные орбитали с разными орбитальными квантовыми числами различаются энергией и формой. Для каждого n разрешены целочисленные значения l от 0 до (n−1). Значения l = 0, 1, 2, 3... соответствуют энергетическим подуровням s, p, d, f.
3. Магнитное квантовое число ml отвечает за ориентацию атомных орбиталей в пространстве. Для каждого значения l магнитное квантовое число ml может принимать целочисленные значения от −l до +l (всего 2l + 1 значений).
Физический
смысл магнитного квантового числа
вытекает из того, что волновая функция
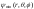 ,
описывающая квантовое состояние
электрона в атоме водорода, является
собственной функцией оператора проекции
момента импульса
,
описывающая квантовое состояние
электрона в атоме водорода, является
собственной функцией оператора проекции
момента импульса
 ,
причем
,
причем
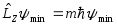 .
.
Поэтому,
из общих положений квантовой механики
следует, что проекция момента импульса
электрона на выделенное в пространстве
направление
![]() может
иметь только определенные значения,
равные
может
иметь только определенные значения,
равные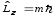 .
.
4. Электрон, занимающий определенную орбиталь, характеризуется тремя квантовыми числами, описывающими эту орбиталь и четвертым квантовым числом (спиновым) ms, которое характеризует спин электрона - одно из свойств (наряду с массой и зарядом) этой элементарной частицы. Спин - собственный магнитный момент количества движения элементарной частицы. Хотя это слово по-английски означает "вращение", спин не связан с каким-либо перемещением частицы, а имеет квантовую природу. Спин электрона характеризуется спиновым квантовым числом ms, которое может быть равно +1/2 и −1/2.
Квантовые числа, возникающие при решении волнового уравнения, служат для описания состояний квантово-химической системы. Каждая атомная орбиталь характеризуется набором из четырех квантовых чисел: главного n, орбитального l, магнитного ml и спинового ms.
Энергетический спектр (закон дисперсии) — зависимость энергии частицы от импульса. Для свободной частицы закон дисперсии изотропен и зависит квадратично от импульса. Такой же параболический закон дисперсии встречается в физике твёрдого тела, поскольку при движении электрона в кристаллах, таких как кремний или арсенид галлия в низкоэнергетическом пределе закон дисперсии имеет параболическую зависимость от квазиимпульса вблизи дна зоны проводимости. В твёрдом теле по аналогии со свободной частицей вводят эффективную массу для частиц, отличную от массы частицы в вакууме и в общем слуае имеет место зависимость этой массы от направления в кристалле. Энергетический спектр частиц в твёрдом теле имеет более сложную структуру по сравнению со свободной частицей. Его знание очень важно для предсказания транспортных, оптических свойств электронного и дырочного газа в полупроводниках.
Правила отбора устанавливают допустимые квантовые переходы между уровнями энергии квантовой системы (атома, молекулы, кристалла, атомного ядра, элементарной частицы) при наложении на неё внеш. возмущений. Если состояния системы характеризуются с помощью квантовых чисел, то О. п. определяют их возможные изменения при квантовых переходах рассматриваемого типа.
Различают
строгие и приближённые ПО. Квантовый
переход наз. запрещённым, если нарушается
хотя бы одно ПО. Строгие ПО обусловлены
симметрией системы и строгими законами
сохранения и налагают абс. запреты на
квантовые переходы. Приближённые О. п.
характеризуют переходы между уровнями
энергии, к-рые описываются приближёнными
законами сохранения. Квантовое число
полного угл. момента атома (J)или
молекулы (F)является
точным, т. к. полный угл. момент является
инвариантом группы вращения, поэтому
ПО для J (или F) -
строгие. В случае электрич. дипольных
переходов возможны изменения квантовых
чисел:![]() J = J - J'=
0,
J = J - J'=
0,![]() 1
в
1
в![]() М
= М - М'
= 0,
М
= М - М'
= 0,![]() 1
(где J, J'
- квантовые числа полного момента атома
в начальном и конечном состояниях, М,
М' -
квантовые числа проекций полных моментов
на к--л. ось). Для электрич. квадрупольных
переходов
1
(где J, J'
- квантовые числа полного момента атома
в начальном и конечном состояниях, М,
М' -
квантовые числа проекций полных моментов
на к--л. ось). Для электрич. квадрупольных
переходов![]() J
= 0,
J
= 0,![]() 1,
1,![]() 2
(J + J'
2
(J + J'![]() 2),
2),![]() М
= 0,
М
= 0,![]() 1,
1,![]() 2.
В случае, когда не учитываются слабые
взаимодействия, О. п. по чётности состояний
(+
2.
В случае, когда не учитываются слабые
взаимодействия, О. п. по чётности состояний
(+![]() -
для электрич. дипольных переходов, +
-
для электрич. дипольных переходов, +![]() +
и -
+
и -![]() -
для электрич. квадрупольных переходов
и т. д.) также являются строгими. О. п.
нарушаются в сильных внеш. полях за счёт
поляризуемости атома или молекулы или
при многофотонном поглощении.
-
для электрич. квадрупольных переходов
и т. д.) также являются строгими. О. п.
нарушаются в сильных внеш. полях за счёт
поляризуемости атома или молекулы или
при многофотонном поглощении.
21. СПИН. Помимо энергии, связанной с движением вокруг ядра атома, электрон обладает еще и дополнительной энергией, связанной с вращением вокруг своей оси наподобие волчка, откуда и происходит слово спин (спин — по-английски верчение). Поскольку же электрон имеет электрический заряд, то при его вращении возникает круговой электрический ток, а следовательно, и магнитное поле, превращающее электрон в маленький электромагнитик, имеющий два магнитных полюса. Так как электрон может вращаться в разных направлениях — по часовой стрелке и против нее, то он может пребывать в двух различных энергетических, или, как говорят, спиновых, состояниях. Спин электрона вызывает ряд дополнительных взаимодействий, играющих исключительно важную роль в физических свойствах атома. Спином обладают и другие элементарные частицы: протон, нейтрон, а также кванты излучений — фотоны. Согласно законам квантовой теории спин имеет строго определенную величину, характерную для данной частицы. В системе единиц, принятой в квантовой теории, спин электрона, а также протона и нейтрона равен 1/2. Спин фотона равен 1.
Водородоподобный атом – система, состоящая из положительно заряженного ядра, и локализованного вблизи него одного электрона. Эти атомы, как и любые другие, имеют линейчатые спектры излучения и поглощения.
ТОНКАЯ СТРУКТУРА (мультиплетное расщепление) уровней энергии - расщепление уровней энергии (термов) атома, молекулы или кристалла, обусловленное гл. обр. спин-орбитальным взаимодействием. Тонкое расщепление уровней - причина возникновения T. с. спектральных линий. Мультиплетное расщепление электронных уровней энергии молекул связано с т. н. взаимодействием спин - ось.
22. Спектры щелочных металлов. Спектры испускания атомов щелочных металлов, как и спектр атома водорода, состоят из множества спектральных линий. Кропотливая систематика этих спектральных линий позволила сгруппировать их в серии, каждая из которых связана с переходом возбужденного атома на какой-то определенный уровень. В некотором смысле атомы щелочных металлов являются водородоподобными, однако не полностью. Дело в том, что внешний электрон несколько деформирует электронный остов и тем самым искажает поле, в котором движется.
