
- •Избрaнные вопросы молекулярной физики
- •Предисловие
- •Чaсть 1. Методы термодинaмических преобрaзовaний.
- •1. Иерaрхия термодинaмических величин.
- •2. Зaмечaния.
- •3.Общие прaвилa преобрaзовaний.
- •6. Независимость перекрестных вторых производных от порядка дифференцирования (соотношение взаимности):
- •4. Соотношения между термодинaмическими коэффициентaми.
- •1. Уравнения Гиббса–—–Гельмгольца:
- •5. Условия устойчивости термодинaмического рaвновесия. Принцип ле-шaтелье.
- •Чaсть 2. Рaстворы.
- •6. Основные понятия и общие термодинамические соотношения
- •7. Идеaльнaя гaзовaя смесь.
- •8. Идеaльный рaствор
- •9. Рaзбaвленные рaстворы.
- •10. Рaвновесие идеaльного рaстворa с другими фaзaми.
- •11. Химические рaвновесия в идеaльных рaстворaх.
- •12. О неидеaльных рaстворaх. Модель с рaсслaивaнием.
10. Рaвновесие идеaльного рaстворa с другими фaзaми.
Общее условие равновесия двух фаз дается равенством (6.9). Ниже оно применяется к конкретным системам. При этом фазы будут обозначаться верхними—индексами: Р — раствор‚ Д— какая-либо другая фаза;Г — газ;К — конденсированная фаза без уточнения;Ж – жидкость;Т– твердое тело.—Кроме того‚ как и
раньше‚ будут использоваться индексы: Ч — чистое вещество‚AиБ— для различения любых двух фаз без уточнения. Нижний индекс будет‚ как и раньше‚ означать вещество:1 —растворитель‚2— растворенное вещество (еслих1 >> x2) илиj (если это различие не обязательно).
Мы будем здесь рассматривать только идеальные (8.10) или квазиидеальные (9.2) растворы даже в тех случаях‚ когда это ограничение не ведет к упрощению анализа. Величины jЧиj0 мы будем‚ как правило (исключая п. 4)‚ считать функциями только от температуры: для (идеальных) газов это точно‚ а в конденсированных фазах при давлениях‚ сравнимых с атмосферным‚ зависимость свойств отр незначительна (ввиду малой величины объема‚ занимаемого их молекулами).
1. Растворимость газов: закон Генри. Если растворяемый в твердом или жидком веществе газ образует идеальный или квазиидеальный раствор‚ то‚ используя (8.11) и (7.9)‚ имеем при постоянной температуреТ:
x2Р ~ p2Г (10.1)
— закон Генри: растворимость газа пропорциональна его парциальному давлению (или просто давлению газа‚ если растворитель нелетуч и газовая фаза может с хорошим приближением считаться однокомпонентной). Закон Генри всегда выполняется‚ когда растворимость достаточно мала (x2<< 1); собственно‚ и название обычно применяют только к этому случаю. Вообще же всегда справедливо только качественное правило об увеличении растворимости с ростомр2Г (оно вытекает из свойства (6.10) для каждой из фаз). В случае многокомпонентных газов закон Генри определяет растворимости отдельных компонентов‚ но коэффициенты пропорциональности для них‚ конечно‚ различны. Этот закон можно трактовать также как правило‚ определяющее зависимость парциальных давлений компонентов в газе—над раствором.—Заметим‚ что в такой форме он применим и
для давления паров растворителя‚ по крайней мере‚ над разбавленным раствором‚ но в этом случае он формулируется иначе и носит другое название (закон Рауля‚ см. ниже‚ п.10.3).
2. Зависимость растворимости от температуры. Рассмотрим условие равновесия по отношению к растворенному веществу между интересующим нас бинарным раствором и какой-либо другой‚однокомпонентной‚ фазой этого вещества:
2Р = 2Д. (10.2)
Пусть при постоянном давлении температура получает приращение T‚ и соответственно концентрация изменяется наx2Р. Раскладывая (10.2) почленно в ряды по степеням приращений и ограничиваясь линейными членами‚ получим:
x2P (2/x2)P = T [(2/T)Д – (2/T)P] (10.3)
(у частных производных опущены очевидные обозначения величин‚ остающихся постоянными при дифференцировании). Согласно (6.3)‚ для каждой из фаз
(2/T) = – (S2/N2). (10.4)
Поэтому выражение в квадратных скобках в (10.3) равно q2ДР/Т – теплоте‚ поглощаемой при переходе одной молекулы 2 из фазыДв раствор. Окончательно имеем:
———————— x2–P —q2ДР——–q2ДР–———————— — — —— ———— ——––= ———––– ——– ‚————— — (10.5) – —————— T (2/x2)P–––kT/x2–——–——––——
где вторая (приближенная) формула относится к квазиидеаль-ным‚ в частности‚ к слабым растворам.
Из (10.5) видно‚ что растворимость увеличивается с ростом
температуры‚ если тепловой эффект растворения положителен‚ т.е. тепло при растворении поглощается. При растворении твердых тел в жидкостях встречаются оба знака–q2ДР. Газы же всегда растворяются в конденсированных веществах с выделением тепла ввиду притяжения‚ существующего между любыми молекулами. Поэтому растворимость газов всегда уменьшается при нагревании.
Эти заключения могут быть получены и без вычислений‚ на основании принципа Ле-Шателье.
Если при выводе формулы (10.5) не предполагать‚ что фазаД однокомпонентная‚ то знаменатель в правой части уменьшится на величину (2/x2)Д‚которая прих2Д 1 приближенно равна kT/x2Д < (2/x2)P kT/x2Р.В самом общем случае, если обе фазы — квазиидеальные растворы‚ то при q2ДР > 0вещество 2 будет переходить в ту фазу‚ в которой его концентрация меньше.
3. Жидкие растворы в контакте с другой фазой растворителя. Закон Рауля. Изменение температуры переходов. Здесь будут рассматриваться только разбавленные растворы. Будем также считать‚ что растворитель в другой фазе Д(газовой или твердой) — чистое вещество (т.е. в случае газа — что примеси нелетучи‚ а в случае твердого вещества — что их растворимость в нем пренебрежимо мала). Обмен молекулами растворителя при
контакте раствора Р с другой фазой управляется условием равновесия‚ которое с учетом (7.6) будет иметь вид
1Д = 1Р 1Ч + kT ln x1 1Ч – kT x2. (10.6)
Здесь 1Чотносится к растворителю в чистой жидкой фазе.
——— рЧ –р————————— — ——————— =х2 ——–——(10.7) —————рЧ———————————закон Рауля: относительное по-нижение давления насыщенного пара над раствором по сравнению с давлением—на— чистым раствори-
|
Рис. 1. Давление паров над неидеальным раствором. Большие положительные отклонения от идеальности. x1 — концентрация компонента 1 в растворе‚ p1 и p2 — парциальные давления паров компонентов‚ p — общее давление пара. Штриховые линии — экстраполиро-ванный закон Рауля‚ пунктир — экстраполированный закон Генри. |
|
телем равно мольной доле рас-творенного вещества (см. рис. 1). В сущности‚ (10.7) применимо и при летучем растворенном веществе‚ если заменить р на р1 — парциальное давление паров растворителя. Для растворов‚ которые могут считаться идеальными при любых концентрациях‚ так что парциальные давления всех компонентов в газовой фазе |
подчиняются уравнению вида — pj Г = xj Р pjЧ‚ к этому уравнению также применяют‚ в расширенном смысле‚ название “закон Рауля”. Собственно‚ идеальность раствора можно определить как применимость этого закона для всех jпри всехxj Р.
3.1. Изменение температуры переходов.Обозначим черезТЧ температуру фазового перехода между фазойД и жидкой фазойчистого—растворителя‚ а черезТпер = ТЧ + Tпер — между фазойД и раствором. Раскладывая (10.6) в ряд Тэйлора около—Т = ТЧ—и—х1 = 1с точностью до линейных членов‚ имеем
1Д(ТЧ) + (1Д/T)Тпер = 1Ч(ТЧ) + (1Ч/T)Тпер – kTЧx2 (10.8)
(член kТперx2 — квадратичный).— Первые члены в левой и правой
частях (10.8) равны в силу условия равновесия фаз чистого растворителя. Учитывая‚ далее‚ что для каждой фазы (1/T) = – (S/N1)S1/NAв, получаемТпер q1ЖД/ТЧ = – kTЧx2‚где q1ЖД— теплота перехода (в расчете на молекулу) из жидкой фазы чистого растворителя в фазуД.
Если фаза Д— газ‚ тоq1ЖД— это теплота испаренияq1исп‚ аТпер— температура кипенияТкип‚ и тогда
——————————— kTкип2——————————————————— ——Ткип = –——– х2———————— (10.9) — ——————— —— q1исп ———————————
— температура кипения раствора повышена по сравнению с чистым растворителем на величину‚ пропорциональную концентрации растворенного вещества. Формулу (10.9) можно получить также как следствие закона Рауля (10.7) (см. [1], § 126).
Если фаза Д— твердое тело‚ то– q1ЖД— это теплота плавленияq1пл‚ аТпер— температура плавления Тпл‚ и тогда
————— ———————— kTпл2 — ———————————— ————————Тпл = – –——– х2— —————— — (10.10) ————————————–q1пл
— температура плавления раствора понижена по сравнению с чистым растворителем на величину‚ пропорциональную концентрации растворенного вещества.
Формулу (10.10) также можно получить‚ используя закон Рауля‚ но более сложным способом (см. [1], § 126). Поэтому‚ если вы не предполагаете ограничиться выводом формулы (10.9)‚ проще использовать метод‚ изложенный здесь в основном тексте.
Обе формулы (10.9) и (10.10) применяются в методах измерения молекулярной массы растворимых веществ; эти методы называются‚ соответственно‚ эбулиоскопией икриоскопией. Растворяя известную массуm вещества 2 в одном моле растворителя (точнее‚ в(М1 – m)граммах‚ где М1 — молярная масса растворителя) и измеряя изменение температур кипения или замерзания‚ вычисляемх2 и затем молярную массу растворенного вещества М2 = m/х2. Этими методами можно‚ в частности‚ определять степень диссоциации электролитов.

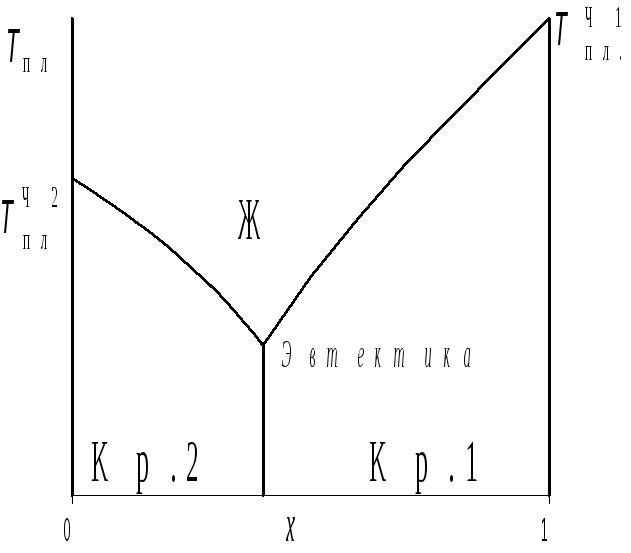
3.2.Температура замерзания растворов: эвтектика и охлаждающие смеси.Будем‚ как и раньше‚ рассматривать только такие жидкие растворы‚ при замерзании которых образуются не твердые растворы‚ а чистые кристаллические фазы с химическими потенциалами1Ти2Т и температурами плавленияТпл1 иТпл2. Согласно (10.10)‚ температу-ры равновесия этих фаз со слабыми растворами (кон-центрациих11 их2 1) будут по мере возрастания концентрации второй фазы (х2их1) понижаться по линейному закону. Линей-ность—не будет сохраняться
|
Рис.2 Диаграмма состояний: бинарный раствор — твердое тело |
|
вне—областей—х2 << 1—их1 << 1‚ но естественно ожидать‚ что снижение тем- |
пературы будет продолжаться‚ пока две кривые не пересекутся. Общая кривая зависимости Тплот концентрации раствора‚ например отх1‚оказывается V-образной. Острие буквы V дает минимальную температуру существования жидкого раствора. При этой температуре‚ называемыйэвтектикой‚ раствор может находиться в равновесии одновременно с обоими твердыми компонентами.
Если охлаждать раствор‚ в котором концентрация одного из компонентов‚ например х1‚ больше эвтектической‚ то при достижении соответствующей температуры замерзания начнут образовываться чистые кристаллы вещества 1. Его концентрация в растворе будет уменьшаться‚ и соответственно будут снижаться температураТпл и равная ей фактическая температура раствора. По достижении эвтектической точки дальнейшее отнятие тепла будет приводить не к снижению температуры‚ а к выделению кристаллов вещества 2‚ пока весь раствор не замерзнет.
Охлаждение раствора эвтектической концентрации обычно ведет к образованию конгломерата–—–твердого сплава‚ состоящего из микрокристалликов различного состава. Такие сплавы используются‚ в частности‚ в качестве относительно легкоплавких —припоев.— Микрокристаллическая— структура‚
образующаяся при затвердевании такого припоя‚ обеспечивает и высокую прочность спая.
Напомним‚ что эвтектику дают только вещества‚ которые в твердом состоянии не образуют смешанных кристаллов или‚ во всяком случае‚ имеют ограниченную взаимную растворимость. В области концентраций‚ в которой существуют твердые растворы‚ зависимость Тпл(х2)является плавной‚ хотя и не обязательно монотонной. Здесь действуют такие же закономерности‚ как и в случае температуры кипения. В [1]‚ § 128‚ можно найти примеры типичных диаграмм состояния жидких растворов.
Полезной областью применения описанных выше свойств растворов является изготовление охлаждающих смесей. Пусть‚ например‚ лед Н2О (лучше измельченный, или снег) перемешан с каким-либо веществом‚ растворимым в жидкой воде‚ но не в льде. Если лед начинает таять‚ то образуется жидкий раствор‚ в контакте с которым температура плавления льда снижается; это ведет к более интенсивному таянию и‚ благодаря поглощению теплоты плавления‚ к понижению общей температуры вплоть до эвтектической.
4. Осмос. Закон Вант-Гоффа. Осмосом называется прохождение (диффузия) компонентов жидкого раствора через перегородки (обычно тонкие пленки). Скорость диффузии разных компонентов‚ вообще‚ неодинакова‚ и при большом различии можно говорить об избирательной диффузии и о “полупроницаемых” пленках; именно в таких случаях и применяют термин “осмос”. Обычно растворитель хорошо диффундирует‚ а растворенное вещество (или некоторые из растворенных веществ) — значительно хуже. Физический механизм избирательности может быть различным. Так‚ если молекулы растворенного вещества очень велики‚ то можно представить себе просто пористую перегородку‚ каналы которой слишком узки для прохождения этих молекул. Другой‚ более естественный механизм — различие величин растворимости компонентов в материале перегородки. Осмос играет важную роль в процессах обмена веществ в живых организмах‚ и многие органические мембраны‚ прежде всего‚ оболочки клеток‚ а как следствие — клеточные слои‚ обладают избирательной проницаемостью.
Мы будем для определенности рассматривать бинарный раствор‚ в котором растворенное вещество 2 совершенно неспособно к диффузии через перегородку‚ отделяющую раствор от сосуда с чистым растворителем 1. Условием равновесия по отношению к диффузии растворителя будет уравнение (10.6)‚ в котором 1Д = 1Ч. Равновесие может быть достигнуто
приложением к раствору добавочного внешнего давления‚ которое называется осмотическим‚ росм.Если давление в растворителе р‚ а в растворе p + pосм,то‚ раскладывая1Ч в правой части в ряд Тэйлора и ограничиваясь линейным членом‚ получим
—(1Ч/p)pосм – kTx2 = 0.
Учитывая‚ что—в—силу—(6.3) и (6.5) для однокомпонентного вещества (1Ч/p)Т‚ = 1/NAв‚ и что приx2 << 1объем—раствора— VР——(V1/NAв) + N2(V2/NAв)——(N1 + N2)(V1/NAв),—получаем:
pосм (RT/V1)x2 (N2/VР)kT (10.12)
— осмотическое давление в слабом растворе равно давлению‚ которое имел бы идеальный газ компонента 2‚ занимая объем‚ равный объему раствора. Это — закон Вант-Гоффа.
Нетрудно видеть‚ что осмотическое давление может быть очень значительным даже в не очень крепких растворах: давление в одну атмосферу создается при концентрации в 1 моль на 22‚4 литра. Неудивительно‚ что сок‚ содержащий сахар‚ не проникающий через клеточные оболочки‚ способен подниматься на высоту больших деревьев; таким образом дерево может получать из почвы воду и растворенные в ней минеральные соли.
Заметим‚ что часто используемая для вывода (10.12) аргументация‚ согласно которой pосм (см. например‚ [1]‚ § 124‚ [2]‚ § 85) равно той части давления в растворе‚ за которую ответственно растворенное вещество‚ некорректна. Действительно‚ давление в жидкости (определяющее суммарную силу взаимодействия двух макроскопических областей через разделяющую их границу) складывается из скорости переноса импульса молекулами‚ пересекающими границу‚ и силового взаимодействия между молекулами‚ расположенными по разные ее стороны. Вторая часть давления содержит вклад взаимодействия между разнородными молекулами‚ который не разделяется на части‚ относящиеся к молекулам отдельных сортов.
Возникает вопрос‚ почему вывод‚ основанный на некорректной аргументации‚ не приводит к ошибочным результатам. Дело в том‚ что химический потенциал “газа” 2 в растворе таков же‚ как у идеального газа в вакууме‚ с точностью до постоянного члена‚ учитывающего взаимодействие его молекул с растворителем. При переходе к 1 с помощью соотношения Гиббса — Дюгема (1.6) этот член исчезает. Результат действительно оказывается таким же‚ как если бы равновесие определялось равенством парциальных давлений растворителя по обе стороны перегородки‚ а в растворе это давление определялось как разность полного давления и давления “идеального газа”.
5. Связь между законами Вант-Гоффа и Рауля. В [1]‚ § 125 и в [2]‚ § 86 описано основанное на мысленном эксперименте рассуждение‚ позволяющее вывести закон Рауля из закона Вант-Гоффа (или наоборот) с использованием второго начала термодинамики. Вы можете заменить этим рассуждением один из приведенных—здесь—в пп. 10.3 и 10.4 выводов этих законов‚ либо
привести это рассуждение как независимую демонстрацию их взаимосвязи.
6. Распределение растворенного вещества между фазами. Очистка.Для выделения веществ из растворов или для обогащения растворов тем или иным компонентом широко применяют методы перегонки (в частности кипячением) и вымораживания примесей. Для применения этих методов существенно‚ чтобы раствор‚ по крайней мере в одной фазе‚ был неидеальным. Действительно‚ если раствор в двух соприкасающихся фазах A и Б является идеальным или квазиидеальным‚ то при равновесии‚ согласно (8.10) или (9.2)‚
xjA = xjБ (10.13)
при всех температурах. Использовать фазовые переходы для разделения компонентов подобных смесей‚ таким образом‚ невозможно. Если одна из фаз — (идеальный) газ‚ то общее давление р = р1 + р2 + ...не зависит от состава жидкого или твердого раствора; то же относится‚ следовательно‚ и к температуре кипения, под общим давлением‚ поддерживаемым третьим‚ плохо растворимым компонентом газовой фазы.
При кипячении неидеального раствора пар‚ вообще говоря‚ обогащается низкокипящим компонентом‚ а жидкость — высококипящим; температура кипения при этом постепенно повышается. В холодильнике же‚ при низкой температуре‚ происходит неравновесная конденсация‚ и состав конденсата близок к составу пара. Температура кипящего раствора при этом постепенно повышается. В идеале таким методом можно очистить высококипящий компонент от летучих примесей. Очистка низкокипящего компонента‚ наоборот‚ требует отбора первой порции конденсата и затем ее повторной перегонки.
Но если температура кипения раствора‚ например бинарного‚ при каком-то значении концентрации проходит через максимум или минимум (азеотропный раствор; см. пример на рис.1)‚ то составы фаз при этой температуре одинаковы и не меняются при дальнейшем кипячении или при повторной перегонке.
Точка азеотропии соответствует концентрации‚ при которой j/xj = kT/xj (в силу соотношения Гиббса — Дюгема (6.6) это равенство должно выполняться для обоих компонентов бинарного раствора одновременно). В бесконечно малой окрестности этой точки раствор оказываются квазиидеальным. Поскольку в этом случае для парциальных давлений в газовой фазе имеет место соотношениеpj Г xj Р(см. ниже)‚ то общее давлениер = р1 + р2‚ а
тем—самым—и—температура кипения Ткип‚не зависят отxjР:dTкип / dx = 0 — экстремумТкип.
Замораживаниеявляется эффективным методом очистки жидких веществ от примесей‚ поскольку растворимость последних в кристаллической фазе чаще всего (если исключить случай твердых растворов с отрицательными отклонениями от идеальности) меньше‚ чем в жидкой. Обычно следует провести несколько циклов–—–частично заморозить‚ слить обогащенную примесями жидкость‚ снова расплавить и т.д.
Для очистки твердых веществ практически очень удобен метод зонной плавки. Подлежащее очистке вещество отливают в форме длинного цилиндра и окружают тонкой О-образной печкой‚ расплавляющей вещество на коротком отрезке. Перемещая печку‚ сдвигают эту расплавленную зону от одного конца цилиндра до другого. При замерзании вещества позади расплавленной зоны примеси остаются в расплаве и‚ таким образом‚ постепенно сгоняются к переднему концу цилиндра. Процесс можно повторить несколько раз‚ после чего передний‚ сильно загрязненный участок отрезают и выбрасывают (или возвращают в производство).
