
- •Учебно-методический комплекс дисциплины «физическая химия» для студентов всех форм обучения
- •Содержание
- •1. Цели освоения учебной дисциплины
- •2. Место учебной дисциплины в структуре ооп университета
- •2.1. Из курса «Химия»
- •2.2. Из курса «Физика»
- •2.3.Из курса «Математика»
- •3. Компетенции студента, формируемые в результате освоения дисциплины
- •По окончании изучения курса студент должен:
- •4. Структура дисциплины Объем дисциплины и виды учебной работы
- •Содержание и тематическое планирование дисциплины
- •5. Образовательные технологии
- •6. Оценочные средства для текущего контроля успеваемости, промежуточной аттестации по итогам освоения дисциплины и учебно-методическое обеспечение самостоятельной работы студентов
- •6.1.Задания и методические указания для выполнения контрольной работы
- •6.1.1. Теоретические сведения
- •1. Первый закон термодинамики для химических процессов
- •Изохорический и изобарический тепловые эффекты
- •Связь между изобарическим и изохорическим тепловыми эффектами
- •Термохимическое уравнение
- •Стандартное состояние
- •Теплота образования химического соединения
- •Расчет стандартного теплового эффекта (стандартной энтальпии) при заданной температуре реакции
- •2. Второй закон термодинамики
- •2.1.Определительное уравнение энтропии
- •2.2 Расчеты изменений энтропии различных систем Изобарический нагрев веществ без фазовых превращений
- •Учет фазовых превращений 1-го рода при расчете энтропии системы
- •Расчет стандартного изменения энтропии () при протекании химической реакции
- •При нагревании от 298к до заданной температуры т
- •3. Основные фрагменты по теме “химическое равновесие. Константа равновесия”
- •Влияние температуры на константу равновесия. Уравнение изобары
- •Расчет химического сродства () в нестандартных условиях. Уравнение изотермы
- •6.1.2. Задания к контрольной работе
- •6.2. Вопросы для подготовки к зачету
- •Поверхностные явления в физико-химических системах
- •Кинетика растекания жидкостей (расплавов. Кинетика химических реакций
- •6.3. Практические работы
- •6.3.1. Практическая работа «первый закон термодинамики» Задание 1
- •Задание 2
- •Задание 3
- •Задание 4
- •Задание 5
- •Задание 6
- •Задание 7
- •Задание 8
- •Задание 9
- •Задание 10
- •6.3.2. Практическая работа «Стандартное химическое сродство элементов к кислороду"
- •Контрольные задания
- •6.3.3. Практическая работа «расчет химических равновесий» Задание 1
- •6.3.4. Практическая работа « поверхностные явления
- •6.3.5. Практическая работа «кинетика химических реакций»
- •Задание 5
- •8. Материально-техническое обеспечение дисциплины
Поверхностные явления в физико-химических системах
Поверхностная энергия (поверхностное натяжение). Факторы, влияющие на поверхностное натяжение.
Явление адсорбции
Межфазное натяжение
Явление смачивания. Краевой угол смачивания
Особенности контакта расплавленного шлака и расплавленного металла
Явление адгезии. Адгезия шлака к поверхности металла. Когезия.
Кинетика растекания жидкостей (расплавов. Кинетика химических реакций
Скорость химической реакции. Зависимость скорости химической реакции от концентрации. Понятие порядка и молекулярности реакции.
Скорость химической реакции. Энергия активации. Зависимость скорости химической реакции от температуры.
Гетерогенные реакции. Скорость гетерогенных реакций. Кинетический и диффузионный режимы гетерогенных реакций.
Диффузионный режим гетерогенной реакции. Стационарный поток диффузии. 1-й и 2-й законы Фика.
Конвективная диффузия. Ламинарное и турбулентное течение. Критерий Рейнольдса.
6.3. Практические работы
6.3.1. Практическая работа «первый закон термодинамики» Задание 1
Реакции окисления сопровождаются изменением энтальпии Н. Какой знак характерен для величины Н?
отрицательный;
положительный.
2. Чему равна разность (Qр - QV) изобарического и изохорического тепловых эффектов процесса Siт+ 6Fe2O3 т = 4Fe3O4 т + SiO2т?
-2 RT;
5 RT;
0;
12 RT.
3. Какое из приведенных ниже уравнений используется для выявления температурной зависимости теплового эффекта химической реакции?
Qр = Cр m (T2- T1);
Cр = a + bT + c'/T2;
dH/dT = Cр.
Вычислите по справочным данным стандартную энтальпию ΔН
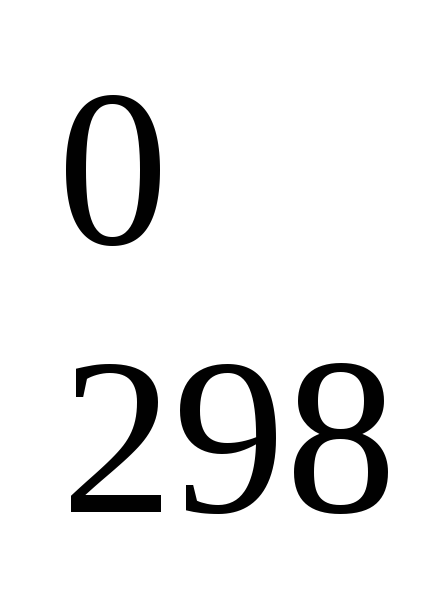 (кДж)
реакцииMgO
т
+ H2
г = Mg
т
+ H2O
г.
(кДж)
реакцииMgO
т
+ H2
г = Mg
т
+ H2O
г.
300 кДж;
360 кДж;
-360 кДж.
Вычислите, сколько тепла выделится при сжигании 2 кг водорода по реакции Н2 г + 0,5 О2 г = Н2О г, Н = -241,8 кДж.
-241800 кДж;
241800 кДж;
-241,8 кДж.
Задание 2
Какая из указанных ниже реакций является эндотермической?
С т + СО2 г = 2СО г, ΔН
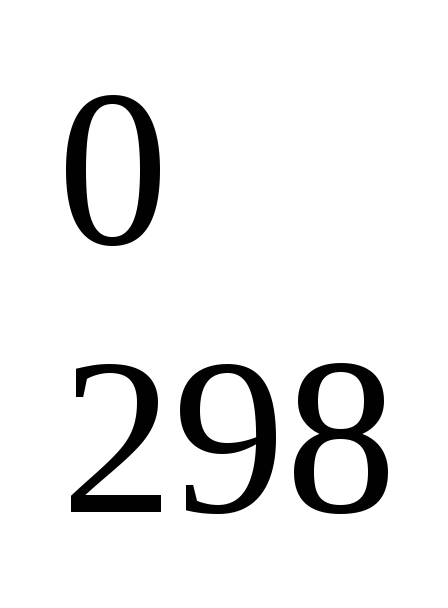 = 170,4 кДж;
= 170,4 кДж;С т + О2 г = СО2 г, ΔН
 = -373,5 кДж.
= -373,5 кДж.
Чему равна разность (Qp - QV) изобарического и изохорического тепловых эффектов процесса NH3 г + HCl г = NH4Clт?
0;
- RT;
-2 RT;
3 RT .
Чему равен изохорический тепловой эффект QV химической реакции?
изменению энтальпии Н;
изменению внутренней энергии U.
Вычислите по справочным данным стандартную энтальпию ΔН
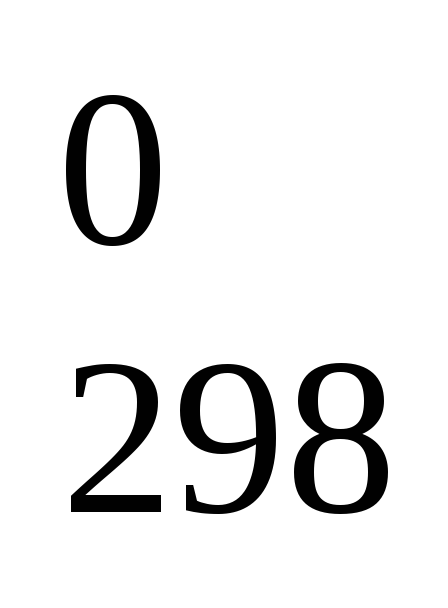 (кДж)
реакцииSi
т +
6Fe2O3
т = 4Fe3O4
т + SiO2
т и укажите
правильное соотношение:
(кДж)
реакцииSi
т +
6Fe2O3
т = 4Fe3O4
т + SiO2
т и укажите
правильное соотношение:
>(-407), <(-397);
>(-397), <(-370);
>(-427), <(-407).
Вычислите, сколько тепла (кДж) выделится при полном сгорании 2 кг графита по реакции Ст + О2 г = СО2г, Н
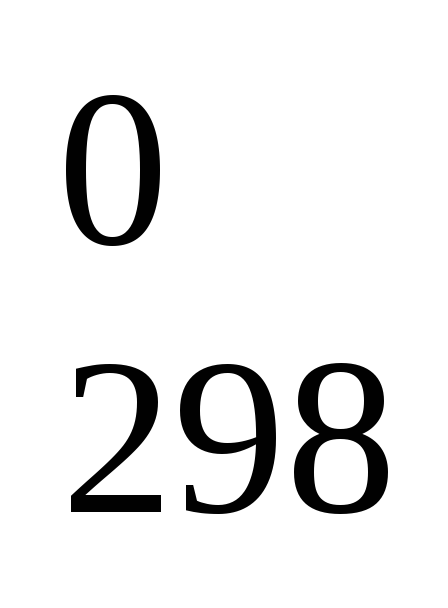 = - 393,5 кДж.
= - 393,5 кДж.
>(-67000), <(-63000);
>(-71000), <(-67000);
>(-63000), <(-61000).
Задание 3
Каков знак изменения энтальпии Н реакции термического разложения химического соединения?
отрицательный;
положительный.
Чему равна разность (QP - QV) изобарического и изохорического тепловых эффектов процесса 3Fe2O3 т + C т = 2Fe3O4 т + CO2 г?
RT;
-RT;
0;
7 RT.
Для реакции С т + СО2 г = 2СО г известны справочные данные о стандартных энтальпиях образования Н
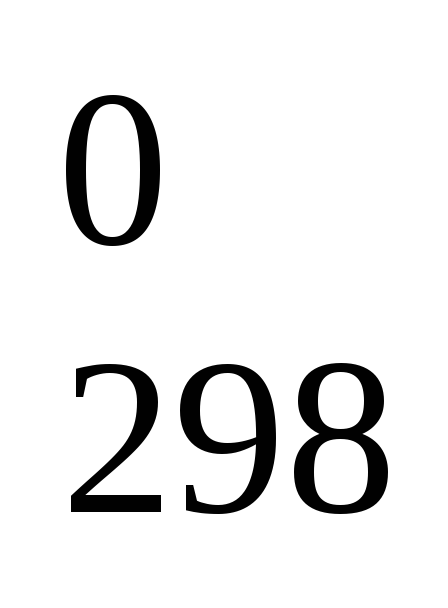 химических соединений. По какой из
формул следует вести расчет теплового
эффекта реакции?
химических соединений. По какой из
формул следует вести расчет теплового
эффекта реакции?
Н
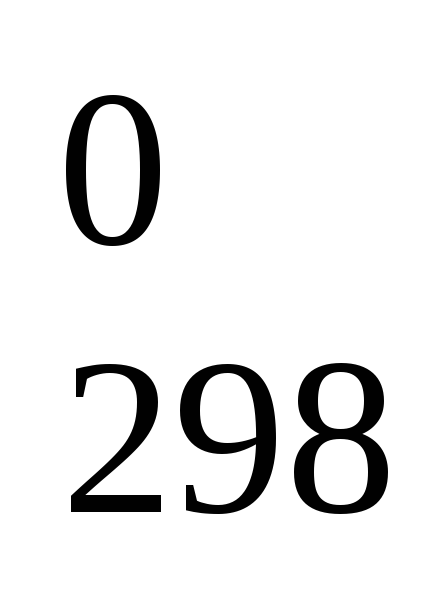 = 2Н
= 2Н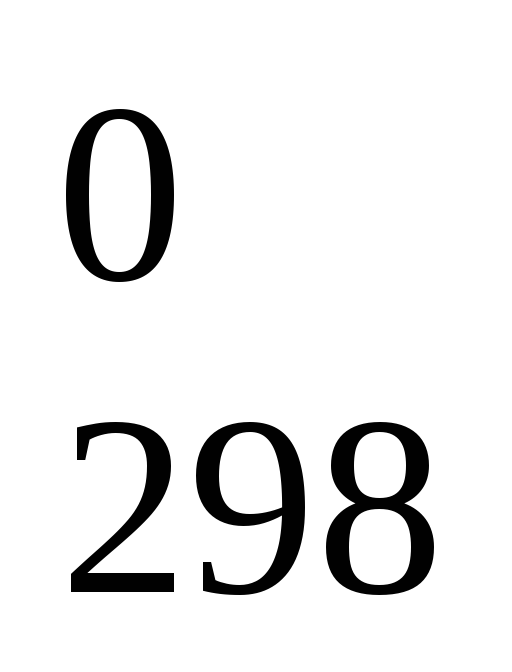 (СО)
-
(СО)
-
 ;
;Н
 = 2Н
= 2Н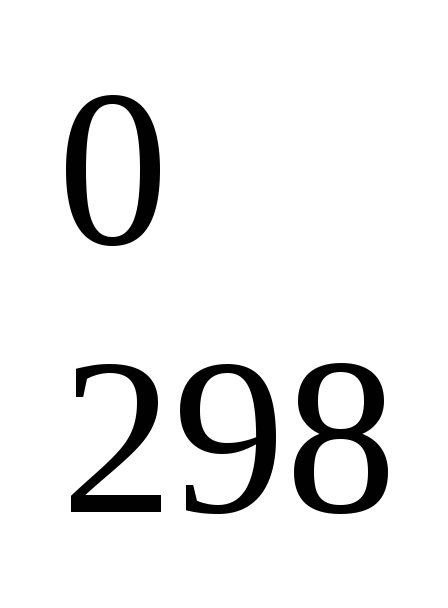 (СО) -
(СО) -
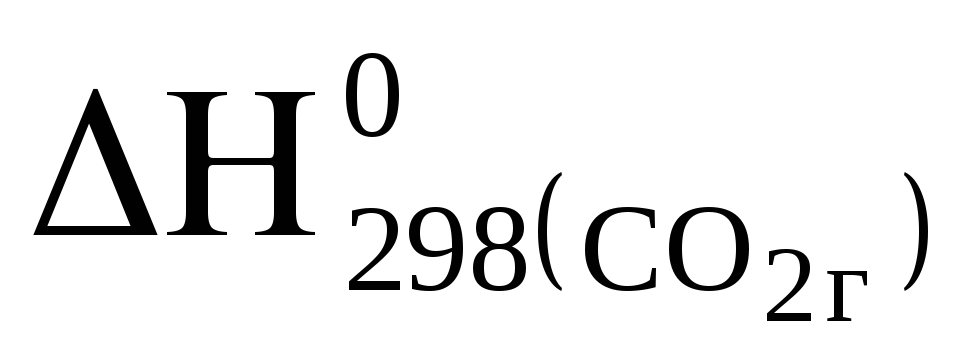 -Н
-Н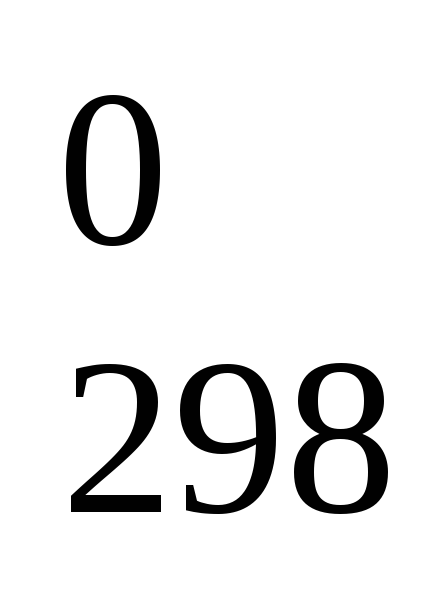 (С);
(С);Н
 =
=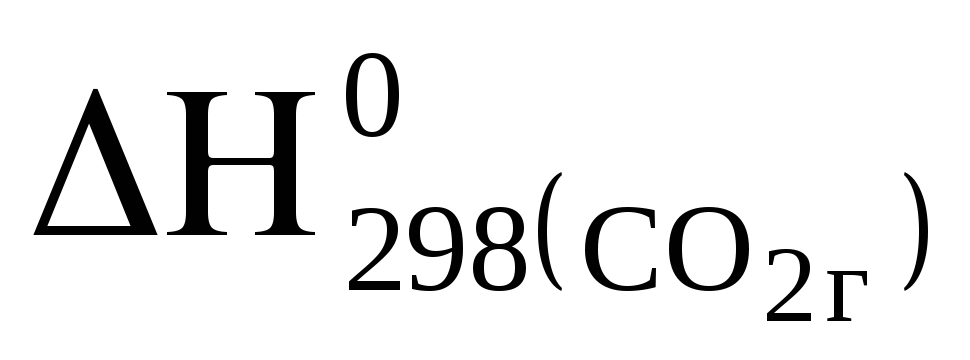 - 2Н
- 2Н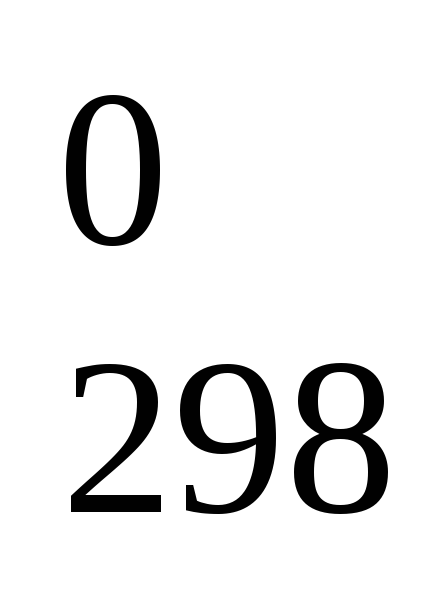 (СО);
(СО);Н
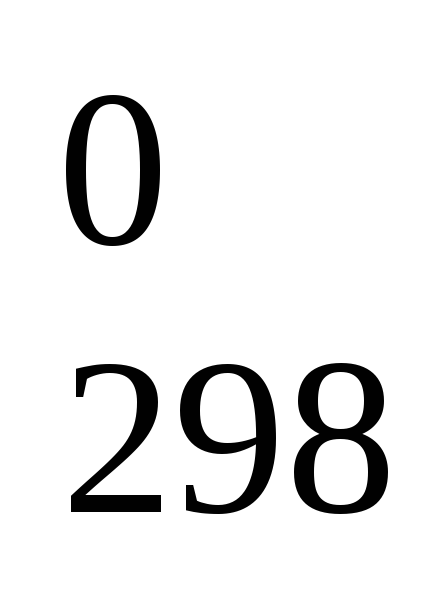 = 2Н
= 2Н (СО)
+
(СО)
+
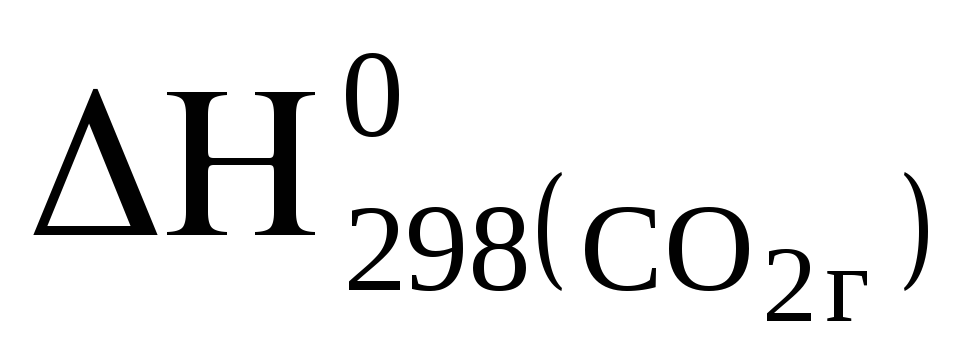 +Н
+Н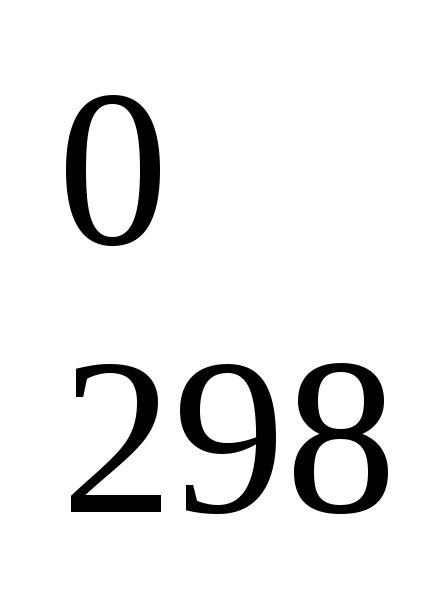 (С).
(С).
Вычислите по справочным данным стандартную энтальпию ΔН
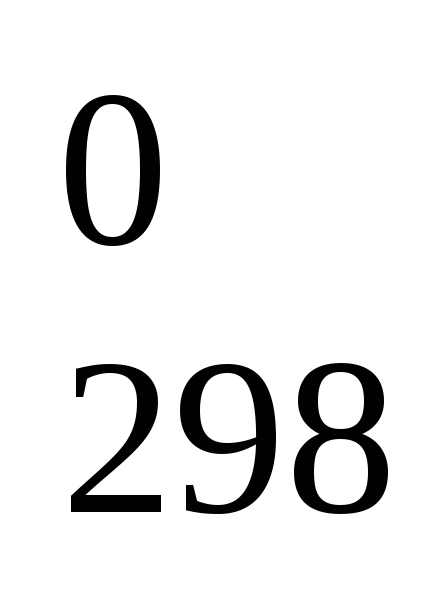 (кДж)
реакции 2Н2S
г
+ 3О2 г
= 2Н2О
г
+ 2SO2
г и укажите
правильное соотношение:
(кДж)
реакции 2Н2S
г
+ 3О2 г
= 2Н2О
г
+ 2SO2
г и укажите
правильное соотношение:
<(-1032), >(-1042);
<(-1042), >(-1052);
<(-1012), >(-1022).
Вычислите, сколько тепла израсходуется при восстановлении 1 кг металлического магния из оксида MgO по реакции MgO т + H2 г = Mg т+ H2O г, Н
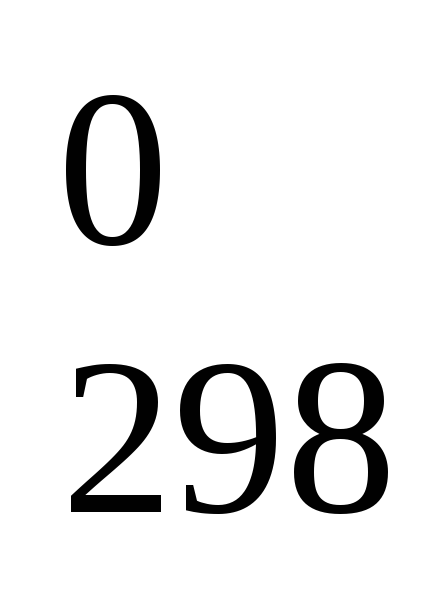 = 359,4 кДж.
= 359,4 кДж.
>12000, <16000;
>8000, <12000;
<20000, >16000.
