
- •Учебно-методический комплекс дисциплины «физическая химия» для студентов всех форм обучения
- •Содержание
- •1. Цели освоения учебной дисциплины
- •2. Место учебной дисциплины в структуре ооп университета
- •2.1. Из курса «Химия»
- •2.2. Из курса «Физика»
- •2.3.Из курса «Математика»
- •3. Компетенции студента, формируемые в результате освоения дисциплины
- •По окончании изучения курса студент должен:
- •4. Структура дисциплины Объем дисциплины и виды учебной работы
- •Содержание и тематическое планирование дисциплины
- •5. Образовательные технологии
- •6. Оценочные средства для текущего контроля успеваемости, промежуточной аттестации по итогам освоения дисциплины и учебно-методическое обеспечение самостоятельной работы студентов
- •6.1.Задания и методические указания для выполнения контрольной работы
- •6.1.1. Теоретические сведения
- •1. Первый закон термодинамики для химических процессов
- •Изохорический и изобарический тепловые эффекты
- •Связь между изобарическим и изохорическим тепловыми эффектами
- •Термохимическое уравнение
- •Стандартное состояние
- •Теплота образования химического соединения
- •Расчет стандартного теплового эффекта (стандартной энтальпии) при заданной температуре реакции
- •2. Второй закон термодинамики
- •2.1.Определительное уравнение энтропии
- •2.2 Расчеты изменений энтропии различных систем Изобарический нагрев веществ без фазовых превращений
- •Учет фазовых превращений 1-го рода при расчете энтропии системы
- •Расчет стандартного изменения энтропии () при протекании химической реакции
- •При нагревании от 298к до заданной температуры т
- •3. Основные фрагменты по теме “химическое равновесие. Константа равновесия”
- •Влияние температуры на константу равновесия. Уравнение изобары
- •Расчет химического сродства () в нестандартных условиях. Уравнение изотермы
- •6.1.2. Задания к контрольной работе
- •6.2. Вопросы для подготовки к зачету
- •Поверхностные явления в физико-химических системах
- •Кинетика растекания жидкостей (расплавов. Кинетика химических реакций
- •6.3. Практические работы
- •6.3.1. Практическая работа «первый закон термодинамики» Задание 1
- •Задание 2
- •Задание 3
- •Задание 4
- •Задание 5
- •Задание 6
- •Задание 7
- •Задание 8
- •Задание 9
- •Задание 10
- •6.3.2. Практическая работа «Стандартное химическое сродство элементов к кислороду"
- •Контрольные задания
- •6.3.3. Практическая работа «расчет химических равновесий» Задание 1
- •6.3.4. Практическая работа « поверхностные явления
- •6.3.5. Практическая работа «кинетика химических реакций»
- •Задание 5
- •8. Материально-техническое обеспечение дисциплины
2.1.Определительное уравнение энтропии
Согласно следствию из второго закона термодинамики вводится новая термодинамическая функция (S) – энтропия, изменение (dS) которой определяется уравнением:
![]() (21)
(21)
интегрируя уравнение (1.3) можно рассчитать энтропию вещества при нагреве от Т1 до Т2 по формуле:
 (22)
(22)
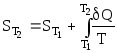 dT (23)
dT (23)
Изменение энтропии при нагревании (охлаждении) nмолей любого вещества от температуры Т1и Т2при постоянном давлении или постоянном объеме вычисляют по следующим уравнениям:
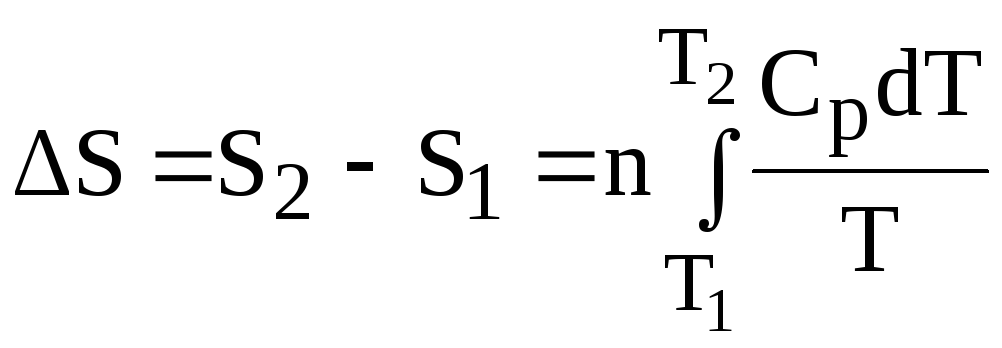 ;
( 24)
;
( 24)
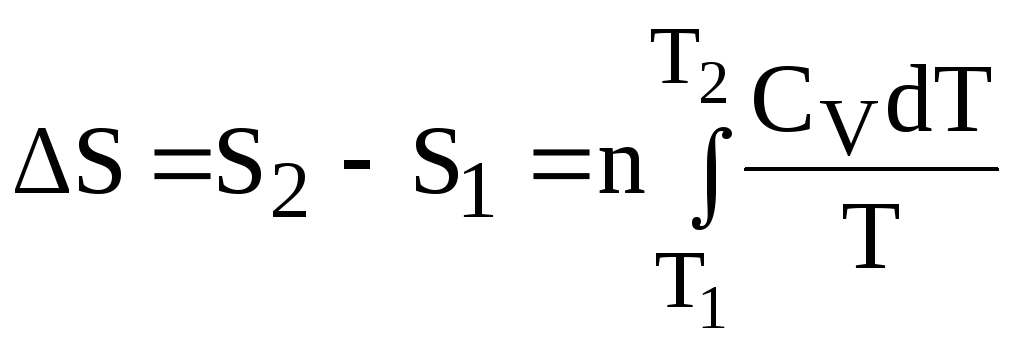 ( 25)
( 25)
Если принять Ср=constили Сv=const, то исходя из (24) и (25) можно получить следующие уравнения:
![]() ( 26)
( 26)
![]() (27)
(27)
Изменение энтропии при изотермическом расширении nмолей идеального газа можно определить по формуле:
![]() или (28)
или (28)
![]() (29)
(29)
Изменение энтропии nмолей идеального газа при переменных Т и р и при переменных Т иVможно записать в виде:
При V =
const ![]() (30)
(30)
При р
= const ![]() (31)
(31)
При адиабатическом расширении идеального газа изменение энтропии определяют по формуле:
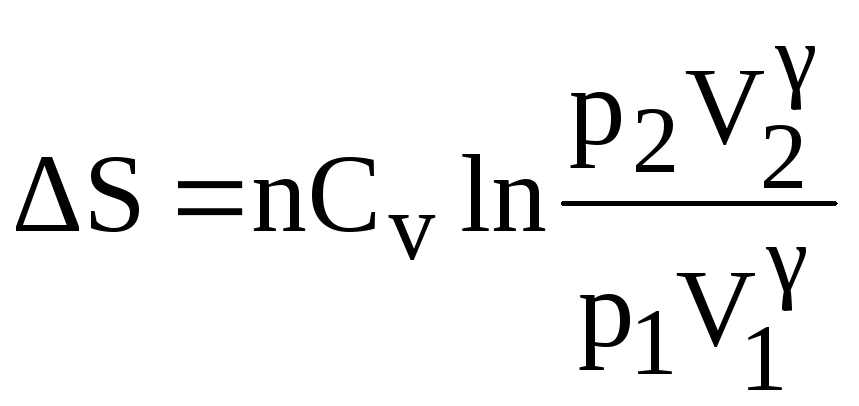 (32)
(32)
2.2 Расчеты изменений энтропии различных систем Изобарический нагрев веществ без фазовых превращений
При изобарическом нагреве (р = const) определительное уравнение для энтропии запишется в виде: dS = dH/T
Следовательно,
![]() (33)
(33)
а) Если принять,
что Ср
= const, Ср
справочная величина, то
![]() (34)
(34)
б) Если учесть зависимость Ср = а + bT + c¢/T2 в виде ( а, b, c - справочные константы), то расчетное уравнение будет иметь вид:
![]() (35)
(35)
Часто расчет проводят от исходного стандартного состояния (р = 1атм, Т = 298 К). В этом случае вычисляется абсолютное значение энтропии вещества:
![]() (36)
(36)
Учет фазовых превращений 1-го рода при расчете энтропии системы
Поскольку фазовые превращения с чистыми веществами происходят изотермически, то из определительного уравнения для энтропии dS = dQ/T следует:
![]() (37)
(37)
Для изобарических условий dS = dH/T уравнение (37) имеет вид:
![]() (38)
(38)
Следовательно, изменение энтропии с учетом фазовых превращений, имеющих место в заданной интервале температур, будет рассчитано по следующему уравнению:
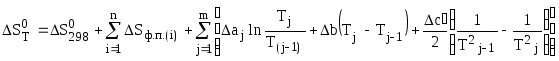 (39)
(39)
где j - фазовое состояние вещества; Ср - константы теплоемкости этого состояния вещества; Tj - температуры фазовых превращений j-го состояния вещества в (i + 1) состояние, ΔSj ф.п - энтальпии фазовых превращений.
Расчет стандартного изменения энтропии () при протекании химической реакции
При Т = 298 К
![]() , (40)
, (40)
где
![]() (прод.),
(прод.),![]() (исх. в-ва)-абсолютные значения энтропий
соответственно продуктов реакции и
исходных веществ.
(исх. в-ва)-абсолютные значения энтропий
соответственно продуктов реакции и
исходных веществ.
При нагревании от 298к до заданной температуры т
![]() =
=
![]() +DСр
×
ln
+DСр
×
ln
![]() (41)
(41)
если DСр – const , т.е. не зависит от температур.
3. Основные фрагменты по теме “химическое равновесие. Константа равновесия”
Для состояния химического равновесия химической реакции
aA + bB = cC + dD
характерно, что:
а) скорость реакции равна нулю (т.е. скорости прямого и обратного процессов равны);
б)
![]()
в) в системе устанавливаются такие равновесные активности реагирующих веществ, что отношение:
![]() (42)
(42)
представляет
собой константу К, зависящую только от
температуры. Величину К называют
константой равновесия химической
реакции, а величины
![]() - активностями соответствующих веществ
в состоянии равновесия.
- активностями соответствующих веществ
в состоянии равновесия.
Активность чистого конденсированного (жидкое, твердое) вещества максимальна и равна единице.
Активность газообразного вещества равна парциальному давлению газа в смеси газов (рг).
Активность вещества в растворе равна коэффициенту активности, умноженному на процентную массовую концентрацию вещества аi = fi [%i]
Константа равновесия химической реакции (К) связана с стандартным химическим сродством формулой
![]() =
-RT
lnK,
(43)
=
-RT
lnK,
(43)
где R – газовая постоянная (R = 8,31 Дж/(моль × К))
исходя
из этого, рассчитав
![]() по формуле
по формуле
![]() =
=
![]() –
–
![]() ,
(44)
,
(44)
можно найти значение константы равновесия при заданной температуре.
К
=
![]() (45)
(45)
Термодинамические
величины простых веществ и химических
соединений (![]() ,
,![]() )
приведены в таблице приложения.
)
приведены в таблице приложения.
Задача:
Выразить константу равновесия химической реакции
6Fe2O3 (чист. кр.) = 4Fe3O4 (чист.кр.) + O2 (газ)

так как
![]() ,
,![]() (кристал.чистые вещества, взаимно не
растворимы),
(кристал.чистые вещества, взаимно не
растворимы),![]() ,
то
,
то![]() .
.
2) Используя термодинамические величины, вычислить константу равновесия реакции при Т = 2000 К.
![]()
![]()
![]()
![]()
![]() , прямая реакция
при Т = 2000 К возможна
, прямая реакция
при Т = 2000 К возможна
3) Находим константу равновесия
![]()
![]()
![]() .
.
