
- •Учебно-методический комплекс дисциплины «физическая химия» для студентов всех форм обучения
- •Содержание
- •1. Цели освоения учебной дисциплины
- •2. Место учебной дисциплины в структуре ооп университета
- •2.1. Из курса «Химия»
- •2.2. Из курса «Физика»
- •2.3.Из курса «Математика»
- •3. Компетенции студента, формируемые в результате освоения дисциплины
- •По окончании изучения курса студент должен:
- •4. Структура дисциплины Объем дисциплины и виды учебной работы
- •Содержание и тематическое планирование дисциплины
- •5. Образовательные технологии
- •6. Оценочные средства для текущего контроля успеваемости, промежуточной аттестации по итогам освоения дисциплины и учебно-методическое обеспечение самостоятельной работы студентов
- •6.1.Задания и методические указания для выполнения контрольной работы
- •6.1.1. Теоретические сведения
- •1. Первый закон термодинамики для химических процессов
- •Изохорический и изобарический тепловые эффекты
- •Связь между изобарическим и изохорическим тепловыми эффектами
- •Термохимическое уравнение
- •Стандартное состояние
- •Теплота образования химического соединения
- •Расчет стандартного теплового эффекта (стандартной энтальпии) при заданной температуре реакции
- •2. Второй закон термодинамики
- •2.1.Определительное уравнение энтропии
- •2.2 Расчеты изменений энтропии различных систем Изобарический нагрев веществ без фазовых превращений
- •Учет фазовых превращений 1-го рода при расчете энтропии системы
- •Расчет стандартного изменения энтропии () при протекании химической реакции
- •При нагревании от 298к до заданной температуры т
- •3. Основные фрагменты по теме “химическое равновесие. Константа равновесия”
- •Влияние температуры на константу равновесия. Уравнение изобары
- •Расчет химического сродства () в нестандартных условиях. Уравнение изотермы
- •6.1.2. Задания к контрольной работе
- •6.2. Вопросы для подготовки к зачету
- •Поверхностные явления в физико-химических системах
- •Кинетика растекания жидкостей (расплавов. Кинетика химических реакций
- •6.3. Практические работы
- •6.3.1. Практическая работа «первый закон термодинамики» Задание 1
- •Задание 2
- •Задание 3
- •Задание 4
- •Задание 5
- •Задание 6
- •Задание 7
- •Задание 8
- •Задание 9
- •Задание 10
- •6.3.2. Практическая работа «Стандартное химическое сродство элементов к кислороду"
- •Контрольные задания
- •6.3.3. Практическая работа «расчет химических равновесий» Задание 1
- •6.3.4. Практическая работа « поверхностные явления
- •6.3.5. Практическая работа «кинетика химических реакций»
- •Задание 5
- •8. Материально-техническое обеспечение дисциплины
Контрольные задания
Задание 1
Определить расчетным путем термодинамическую возможность протекания приведенной химической реакции при заданных температурах.
Т = 298 К и Т = 2000 К O2 г +2Сат = 2СаОт
Задание 2
Определить расчетным путем термодинамическую возможность протекания приведенной химической реакции при заданной температуре.
Т = 298 К и Т = 2000 К 2 Feт + O2 г = 2 FeOт
Задание 3
Определить расчетным путем термодинамическую возможность протекания приведенной химической реакции при заданной температуре.
Т = 298 К и Т = 2000 К 2Siт + O2 г = SiO2 т
Задание 4
Определить расчетным путем термодинамическую возможность протекания приведенной химической реакции при заданной температуре.
Т = 298 К и Т = 2000 К Tiт + О2 г = TiО2 т
Задание 5
Определить расчетным путем термодинамическую возможность протекания приведенной химической реакции при заданной температуре. Т = 298 К и Т = 2000 К
4/3 Crт + O2 г = 2/3Сr2O3 т
Задание 6
Определить расчетным путем термодинамическую возможность протекания приведенной химической реакции при заданной температуре.
Т = 298 К и Т = 2000 К О2 г + 4/3 Alт = 2/3Al2О3 т
Задание 7
Определить расчетным путем термодинамическую возможность протекания приведенной химической реакции при заданной температуре.
Т = 298 К и Т = 2000 К 2Сuт + O2 г = 2СuОт
Задание 8
Определить расчетным путем термодинамическую возможность протекания приведенной химической реакции при заданной температуре.
Т = 298 К и Т = 2000 К 2Cт + O2 г = 2COг
Задание 9
Определить расчетным путем термодинамическую возможность протекания приведенной химической реакции при заданной температуре.
Т = 298 К и Т = 2000 К 2Niт + O2 г = 2NiОт
Задание 10
Определить расчетным путем термодинамическую возможность протекания приведенной химической реакции при заданных температурах.
Т = 298 К и Т = 2000 К O2 г +2Сат = 2СаОт
6.3.3. Практическая работа «расчет химических равновесий» Задание 1
Выразить константу равновесия химической реакции (К).
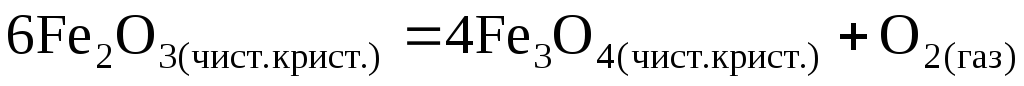
Используя термодинамические величины, вычислить
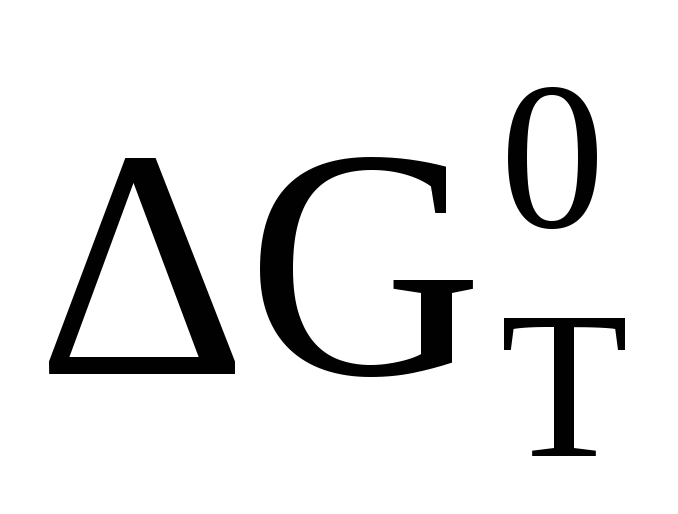 и константу равновесия для данной
реакции при
и константу равновесия для данной
реакции при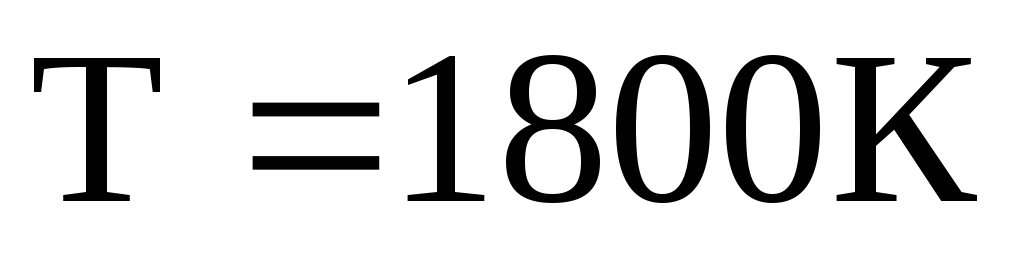 .
.Возможна ли данная реакция при Т = 1800 К, если
 ?
?Как следует изменить давление кислорода, чтобы оксид железа (+3) при данной температуре не разлагался?
Задание 2
Выразить константу равновесия химической реакции (К)
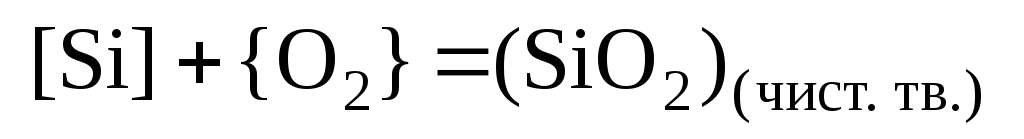 (приняв
расплав идеальным)
(приняв
расплав идеальным)Используя термодинамические величины, вычислить
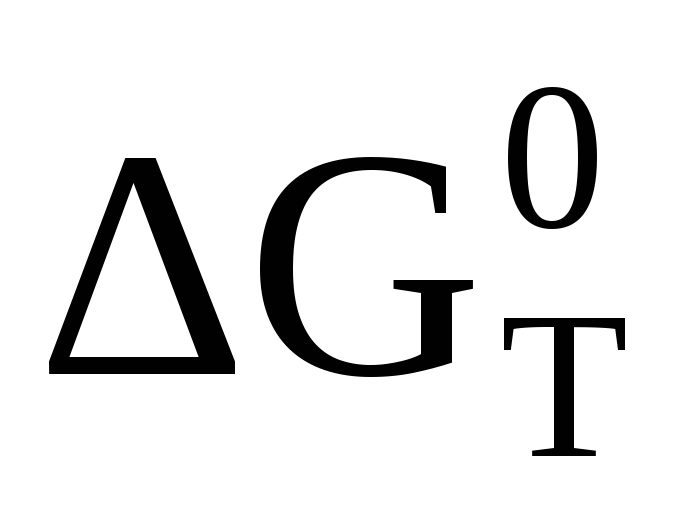 и константу равновесия для данной
реакции при Т = 1800 К.
и константу равновесия для данной
реакции при Т = 1800 К.Будет ли окисляться кремний в атмосфере воздуха
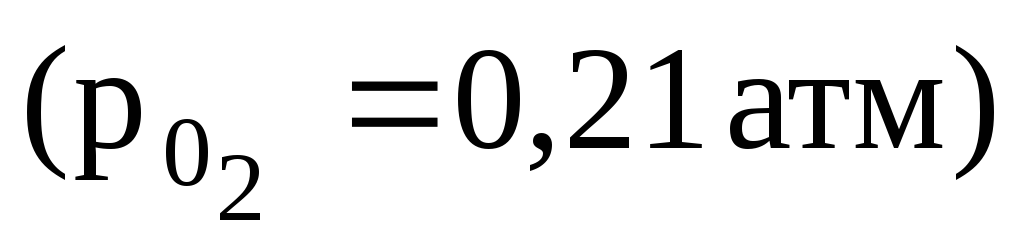 при Т = 1800 К и
при Т = 1800 К и
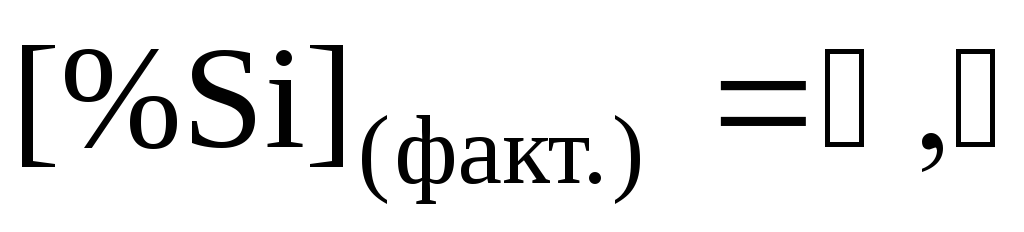 ?
?Как изменится константа равновесия обратной реакции
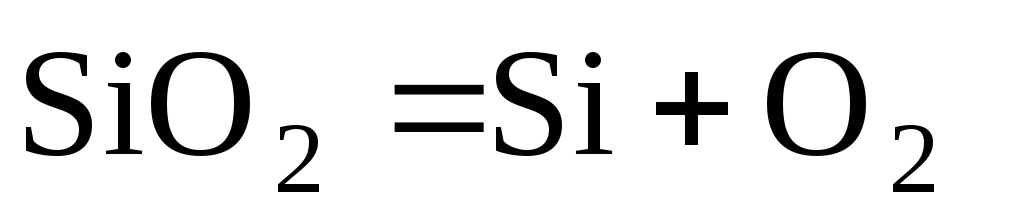 с
повышением температуры?
с
повышением температуры?
Задание 3
Выразить константу равновесия химической реакции (К).
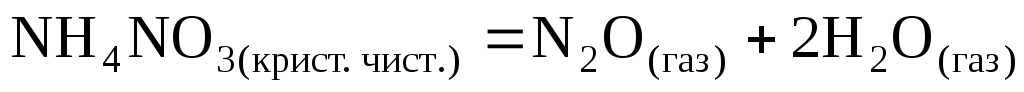
Используя термодинамические величины, вычислить
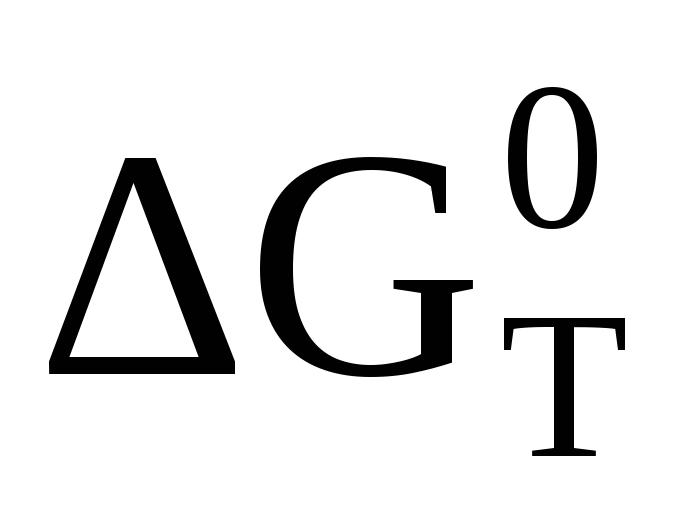 и константу равновесия для данной
реакции при Т = 1000 К.
и константу равновесия для данной
реакции при Т = 1000 К.Возможно ли осуществление данной реакции при Т = 1000 К, если
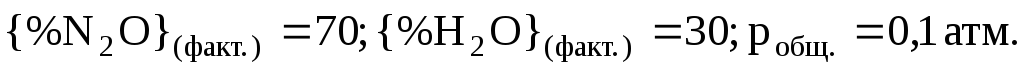 ?
?Как изменится константа равновесия данной реакции при понижении температуры?
Задание 4
1. Выразить константу равновесия химической реакции (К).
![]()
2. Используя
термодинамические величины, вычислить
![]() и
и![]() .
.
3. Будет ли разлагаться
водяной пар при
![]() ,
если
,
если
![]() ?
?
4. Как изменится равновесный состав системы при уменьшении общего давления?
Задание 5
1. Выразить константу равновесия химической реакции (К)
![]()
2. Используя
термодинамические величины, вычислить
![]() и константу равновесия при
и константу равновесия при![]() .
.
3. Возможен ли
прямой процесс при Т = 1000К и
![]() ?
?
4. Как изменится равновесное содержание СО в данном процессе при увеличении температуры?
Задание 6
Выразить константу равновесия химической реакции (К)
C6H6 (чист. жидк.) +7,5O2 (газ) = 6СО2 (газ) + 3Н2О(газ)
Используя термодинамические величины вычислить
 и
и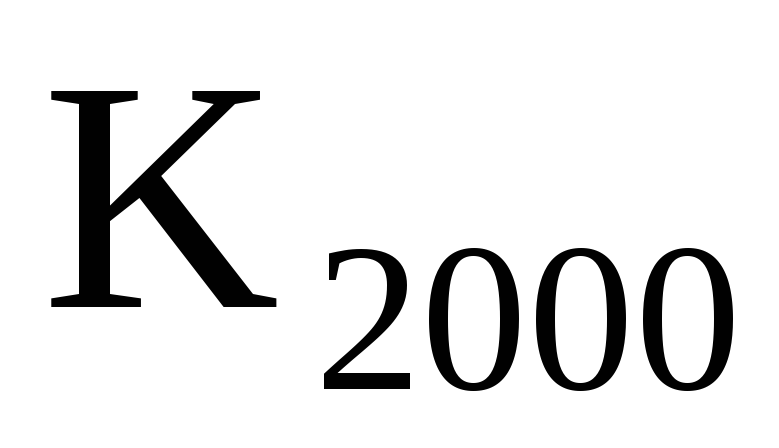 .
.Возможно ли горение бензола при Т = 2000 К и
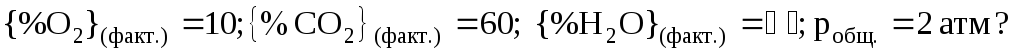
4. Как изменится константа равновесия химической реакции (К) с повышением температуры?
Задание 7
1. Выразить константу равновесия химической реакции (К)
С(чист. графит.) +2N2O(газ) = СО2 (газ) +2N2 (газ)
2. Рассчитать константу равновесия при Т = 2000К, исходя из термодинамических величин.
3. Возможна ли данная реакция при Т = 2000К, если
![]() ?
?
4. В каком направлении сместится равновесие при уменьшении давления?
Задание 8
Выразить константу равновесия химической реакции (К)
2(FeО) + [Si] = 2[Fe](чист.) + (SiO2), приняв расплав идеальным.
Рассчитать константу равновесия при Т = 2200К, исходя из термодинамических величин.
Будет ли окисляться кремний при T = 2200K, если в металле [%Si] = 2; в шлаке (% FeO) = 10, (% SiO2) = 30?
В каком направлении сместится равновесие при уменьшении давления?
Задание 9
1.Выразить константу равновесия химической реакции (К)
2H2S (газ) + 3O2 (газ) = 2H2O (газ) + 2SO2 (газ)
2.Вычислить
![]() ,
используя расчеты
,
используя расчеты![]() .
.
3.Возможна ли данная
реакция при Т = 1800К, если {%SO2}(факт.)=
11,5;
![]()
4. В каком направлении сместится равновесие химической реакции с увеличением давления?
Задание 10
Выразить константу равновесия химической реакции (К)
2CaF2 (чист.) + SiO2 (чист.) = 2СаО (чист.) + SiF4 (г)
Рассчитать константу равновесия при Т = 2000К, используя термодинамические данные.
Будет ли выделяться фтористый кремний SiF4 в атмосферу, при Т = 2000К и
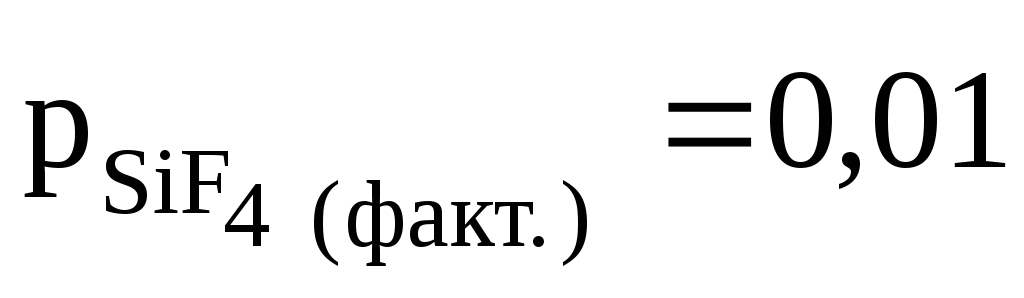 атм?
атм?При каком давлении фторида кремния реакция прекратится?
